方案详情
文
屡见不鲜的蜂蜜掺假现象对养蜂行业产生了巨大的冲击,制约了蜂蜜市场的健康发展。近年来越来越多的养蜂者为加快蜂蜜生产进度,不等自然封盖即进行频繁摇蜜,产出的未成熟蜂蜜经后续浓缩、脱水等步骤,使蜂蜜的水分、糖含量达到标准规定。尽管此类浓缩蜂蜜的各项基础理化指标与天然成熟蜂蜜无异,但蜂蜜中的微量物质及其具有的生物学活性却可能受到很大影响。为探究未成熟蜂蜜与自然成熟蜂蜜间的差异,本研究以我国最具代表性的油菜(Brassica napus L.)意蜂(Apis Mellifera L.)蜂蜜为研究对象,对比研究了封盖成熟油菜蜂蜜与未封盖不成熟油菜蜂蜜的化学组成以及生物学活性。主要研究结果如下:1、采用国标中规定的方法检测了两种油菜蜂蜜中的水分、糖、酸度、糠醛值、淀粉酶值等基础理化指标。结果表明,封盖成熟油菜蜂蜜的各项理化参数均符合标准规定,而未封盖油菜蜂蜜除羟甲基糠醛值符合标准规定外,其余各项指标均不达标。2、通过超高效液相色谱-四极杆串联质谱技术对蜂蜜提取物中的小分子物质进行采集分析,并结合代谢组学数据分析技术进行非靶向分析。经主成分判别分析两类蜂蜜可以实现有效区分。差异性分析结果表明,未成熟油菜蜂蜜中有机酸、糖苷、植物碱等物质含量较多,而成熟蜂蜜中酚类物质含量较高。3、对油菜蜂蜜中常见的多酚类物质进行靶向代谢组学分析,两种蜂蜜中共检出20 种多酚类物质,其中山奈酚、芹菜素、松属素、3, 4-二甲氧基肉桂酸、白杨素、咖啡酸苯乙酯在未成熟油菜蜂蜜中的含量低于检测限,除香草酸、丁香酸外,其余12 种酚类物质含量均低于成熟油菜蜂蜜。4、DPPH、ABTS+·自由基清除能力、铁还原能力测定结果表明,成熟油菜蜂蜜相较未成熟油菜蜂蜜体外抗氧化能力更强;抑菌实验结果表明,两种蜂蜜对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)均有抑制效果,且成熟油菜蜂蜜的抑菌效果更为明显,但两种蜂蜜对枯草芽孢杆菌(Bacillus subtilis)均无抑制作用。5、建立过氧化氢诱导小鼠L929 成纤维细胞氧化应激模型,探索两种蜂蜜对H2O2 诱导的细胞氧化应激损伤的保护作用。成熟油菜蜂蜜提取物在浓度为300 μg/mL 时即可显著提升H2O2 诱导的受损细胞的生长活力,而未成熟油菜蜂蜜提取物在浓度为600 μg/mL 时才表现出上述效果;两种蜂蜜提取物均可在一定程度上上调细胞相关抗氧化基因的表达,但成熟油菜蜂蜜提取物对氧化应激受损细胞中抗氧化基因调节作用更为明显。本研究结果表明,成熟油菜蜜具有更丰富的多酚类化合物和更好的生物学活性,这也为成熟蜂蜜的质量标准和评判依据奠定了理论基础。
方案详情

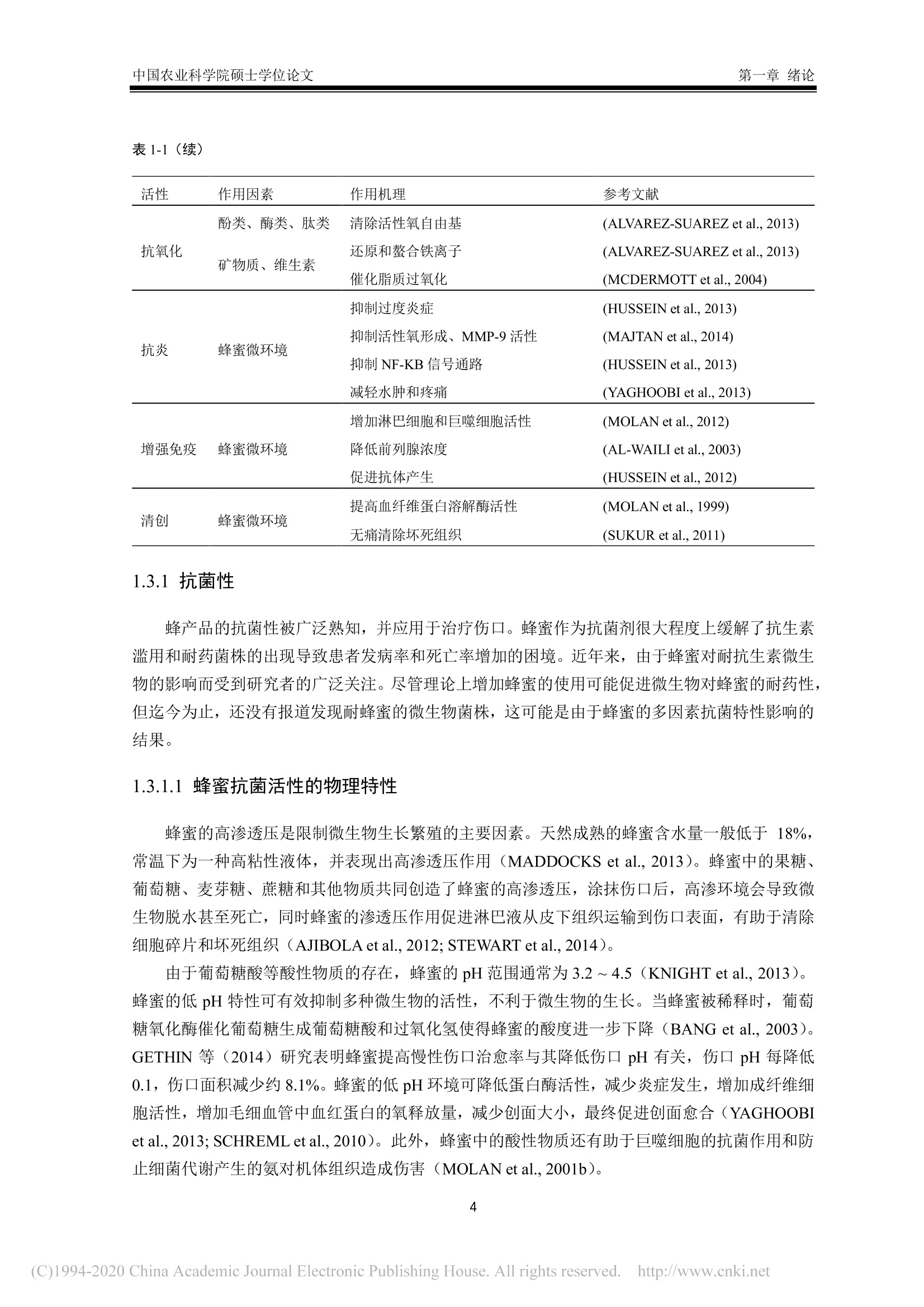
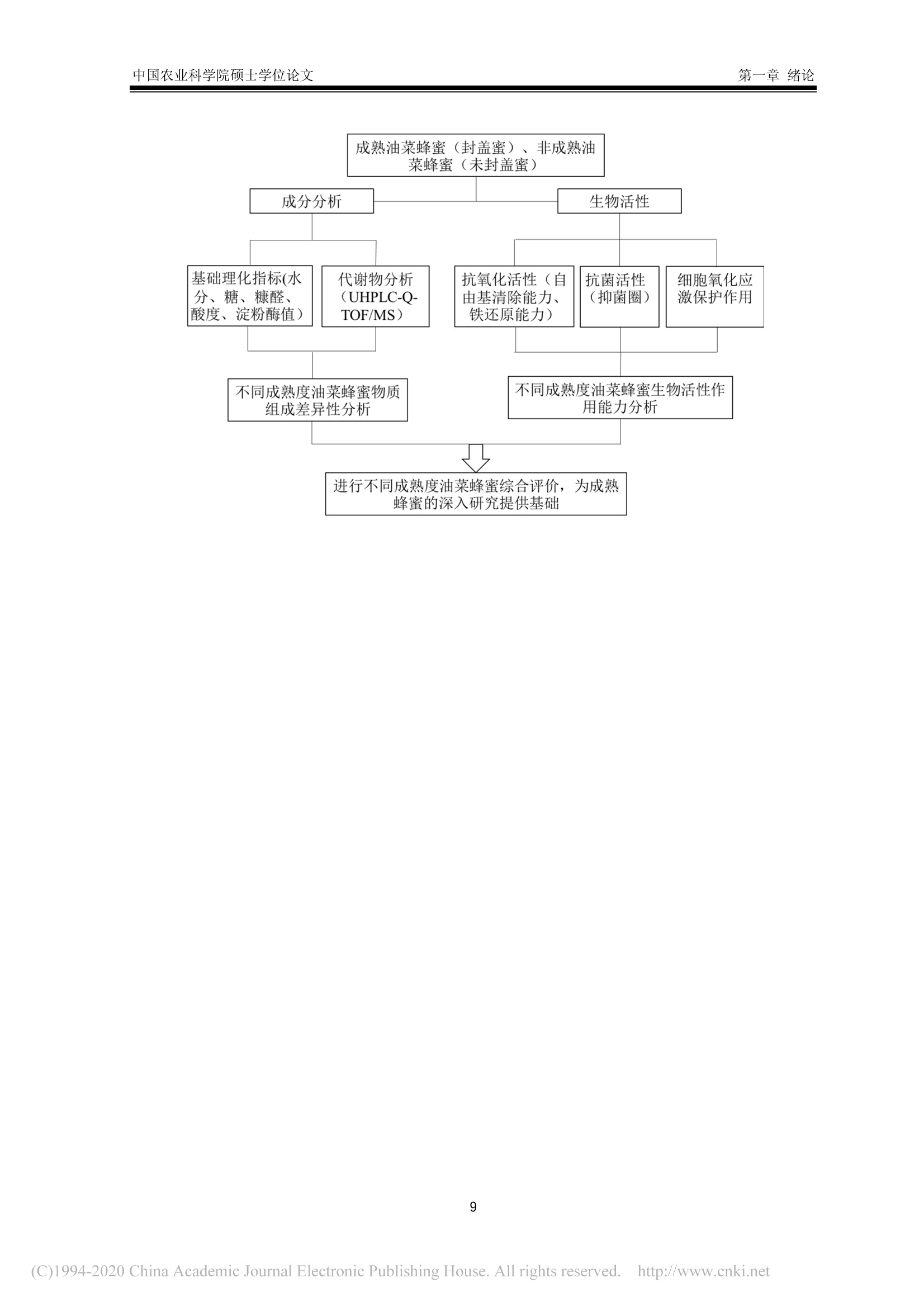
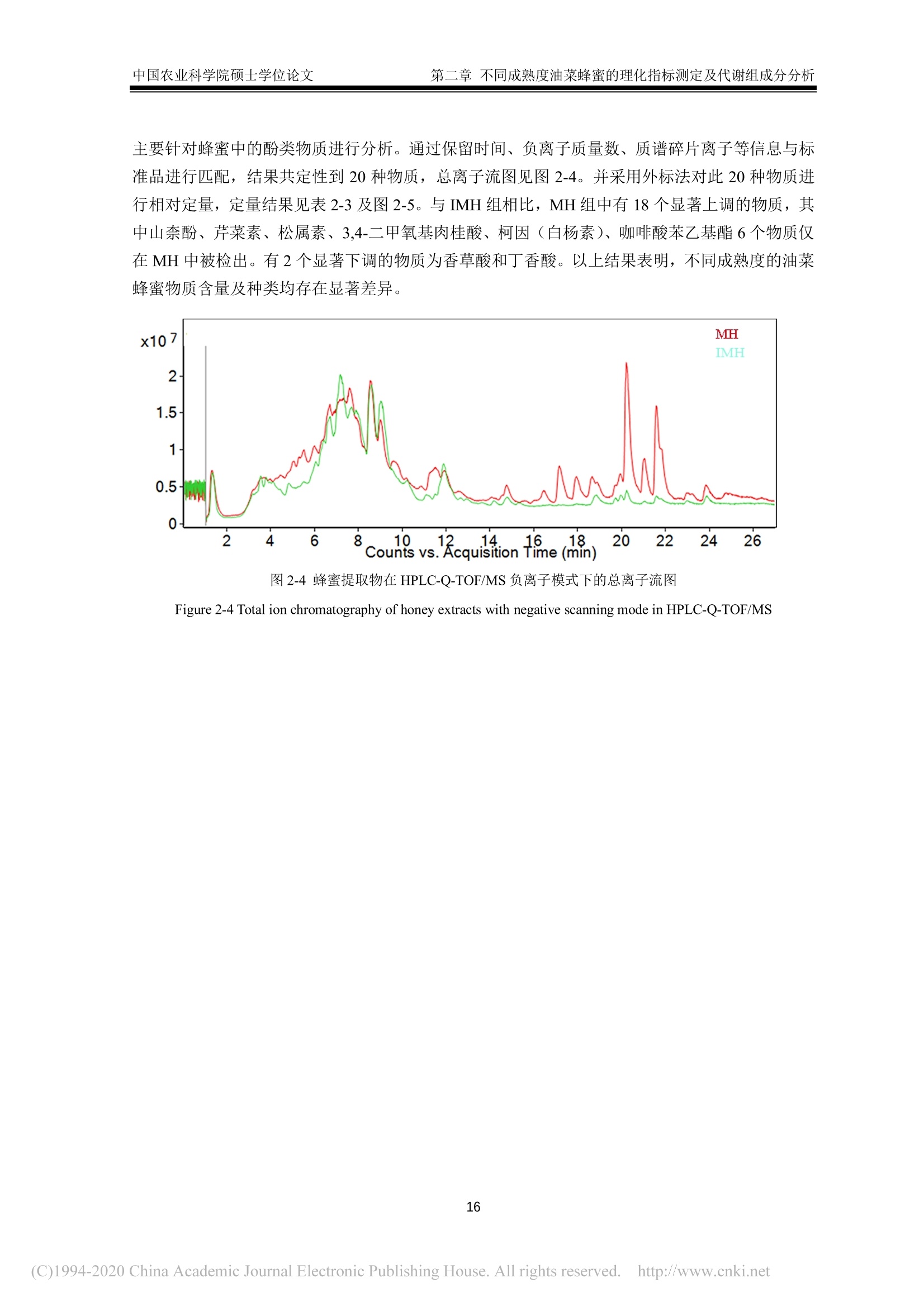
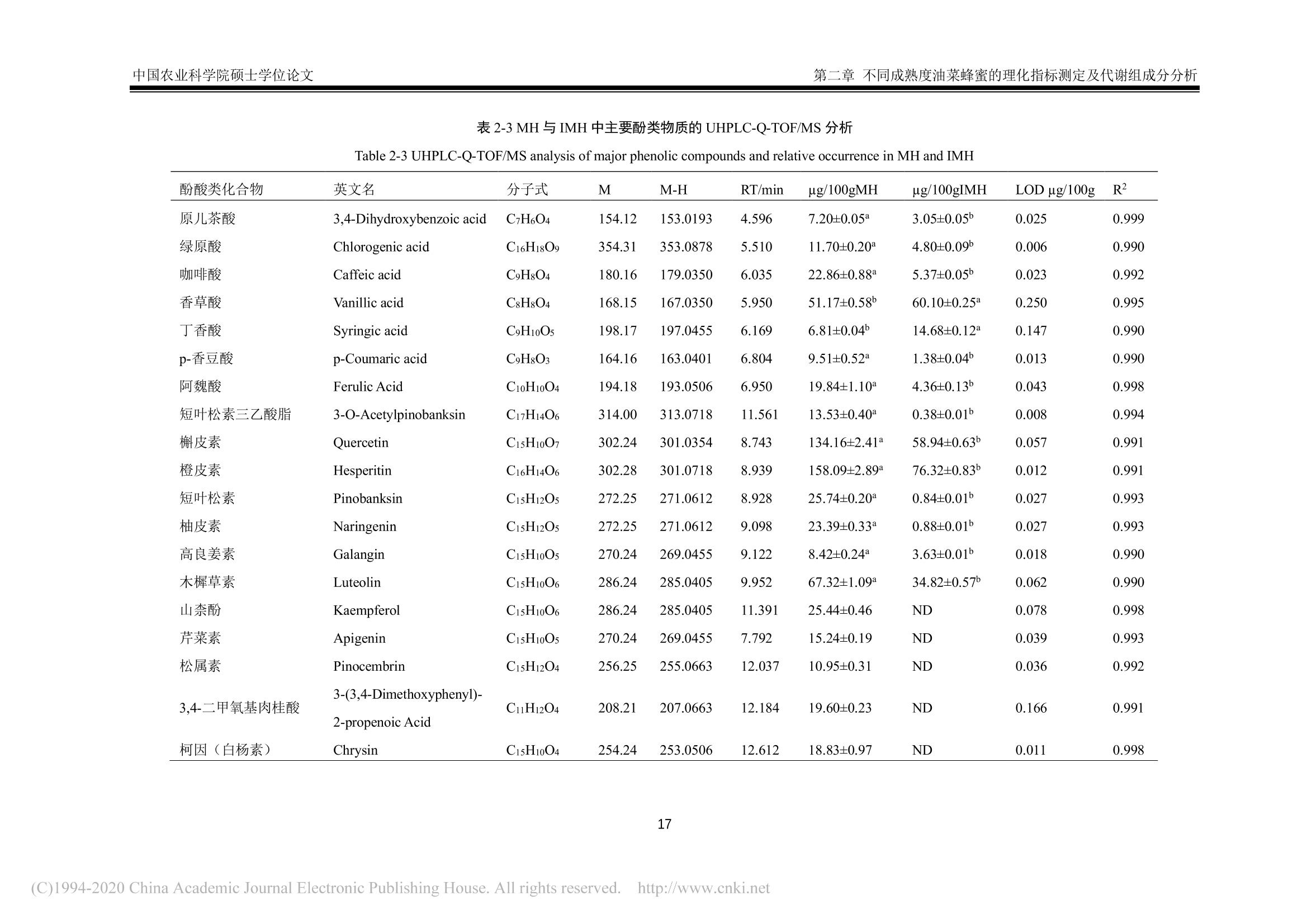
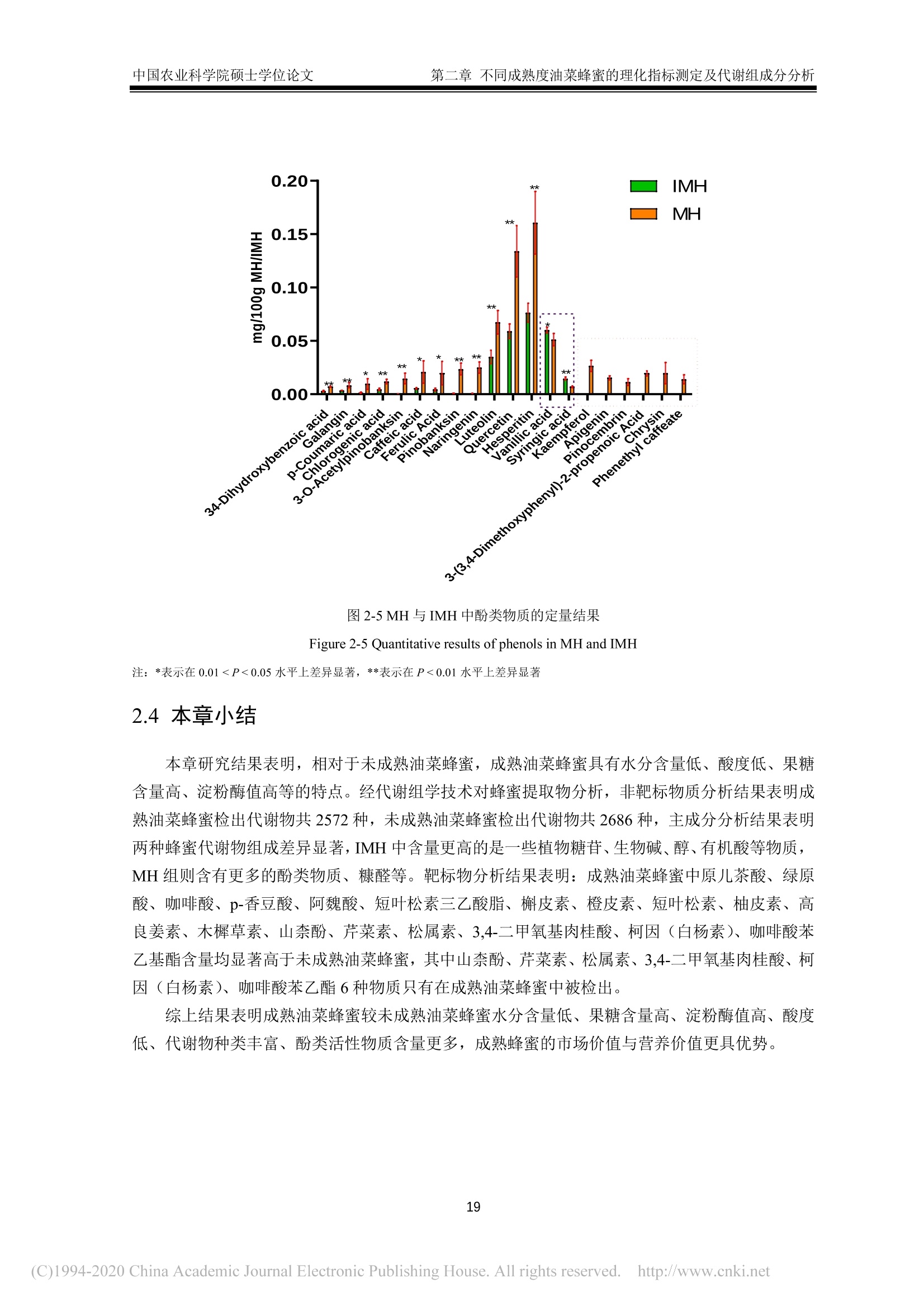
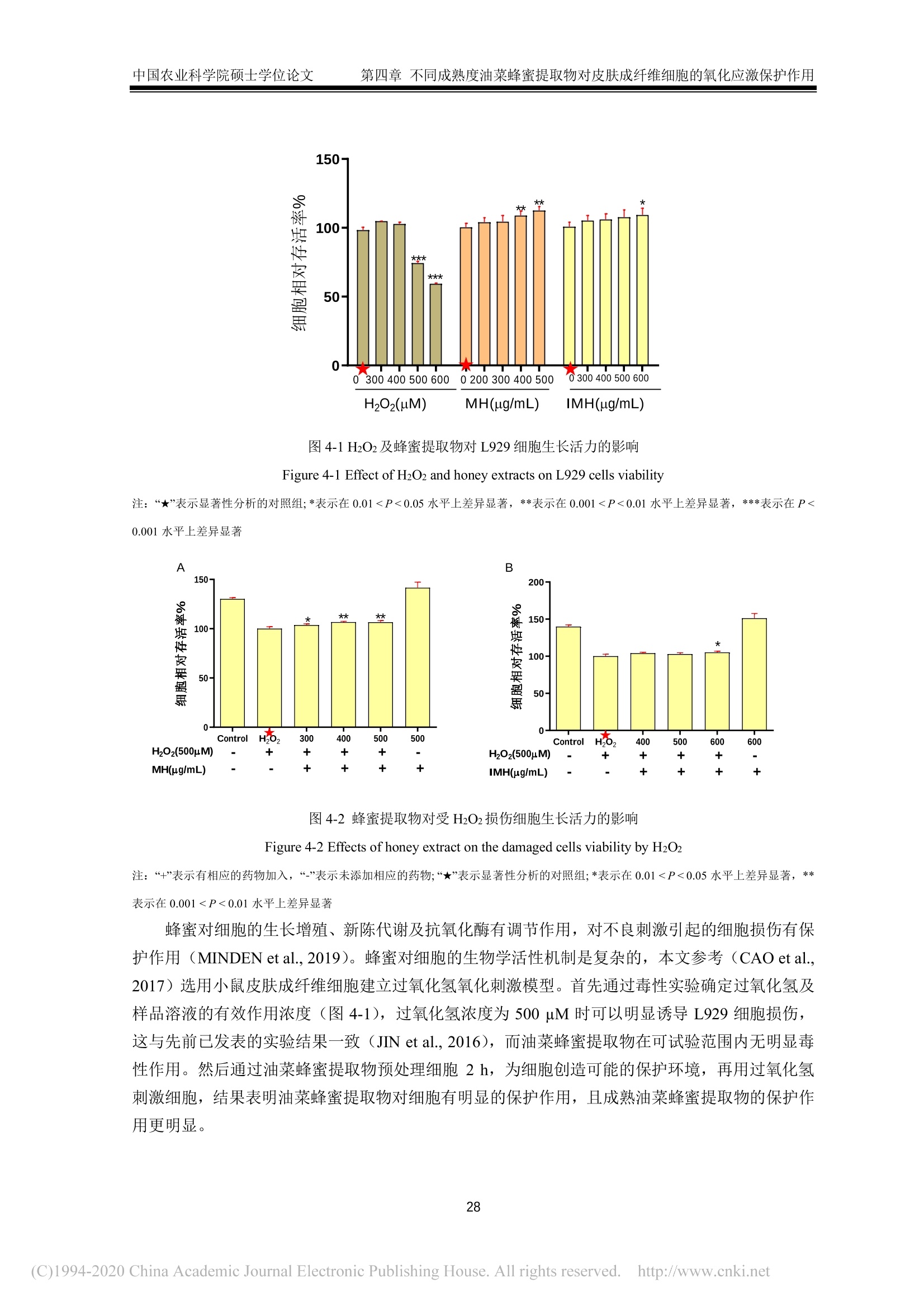
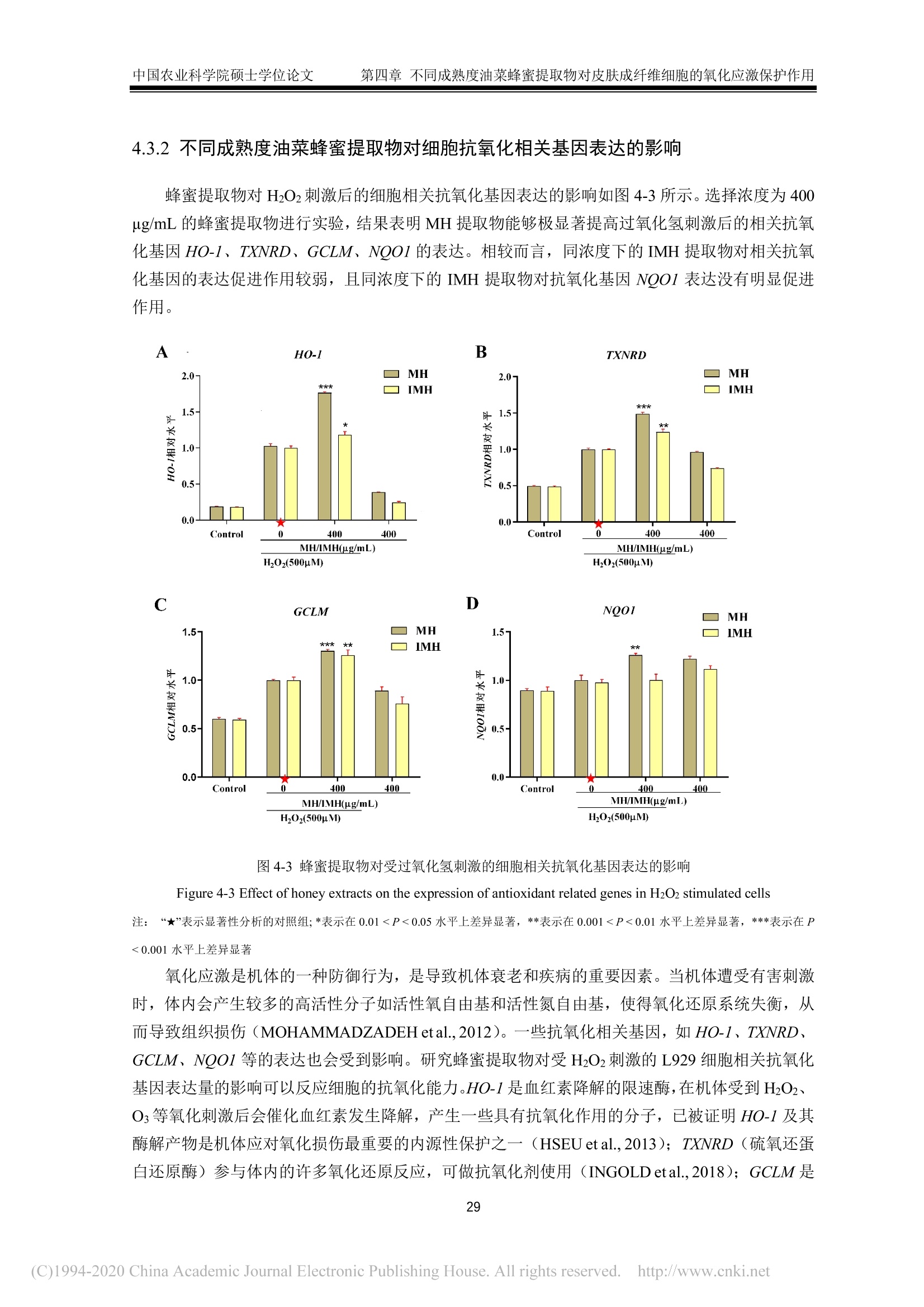
中国农业科学院硕士学位论文第一章绪论 中国农业科学院硕士学位论文第一章绪论 密级: 论文编号: 中国农业院学位论文 酿造成熟与未成熟油菜蜂蜜成分组成及生物学活性比较研究 硕士研究生:郭娜娜 学 号:82101172145 指-导 教 师:彭文君研究员 申请学位类别:工学硕士 专 业:食品科学 研 究方向:功能食品与生物活性物质培音养 单 位:蜜蜂研究所 研究生院 2020年6月 Secrecy: No. Chinese Academy of Agricultural SciencesThesis A Comparative Study on the Composition and BiologicalActivity Between Naturally Mature Honey andImmature Honey from Rape Flower Candidate:Guo Nana Student ID: 82101172145 Supervisor: Professor PENG Wenjun Degree Type:Master of Science in Food ScienceMajor: Food Science Research Field: Functional Food and BioactiveComponents Institution: Institute of Apiculture ResearchGraduate School June 2020 中国农业科学院 硕士学位论文评阅人、答辩委员会签名表 论文题目 酿造成熟与未成熟油菜蜂蜜成分组成及生物学活性比较研究 论文作者 郭娜娜 专业 食品科学 研究方向 功能食品与生物活性物质 指导教师 彭文君 培养单位 蜜蜂研究所 姓名 职称 硕(博)导师 单 位 业 签名 评阅人 硕导口博导口 硕导口博导口 硕导口博导口 州 张峰 研究员 硕导口博导口 中国检验检疫科学研究院 十 答辩委员 万向元 教授 硕导口博导口 北京科技大学 李景明 教授 硕导口博导口 中国农业大学 金建明 教授 硕导口博导口 北京工商大学 物 金建 王敏 研究员 硕导口博导口 中国农业科学院质标所 会议记录(秘书) 王妙 论文答辩时间地点 2020年5月29日13:00 蜜蜂所学会二楼会议室 独创性声明 本人声明所呈交的论文是我个人在导师指导下进行的研究工作及取得的研究成果。尽我所知,除了文中特别加以标注和致谢的地方外,论文中不包含其他人已经发表或撰写过的研究成果,也不包含为获得中国农业科学院或其他教育机构的学位或证书而使用过的材料。与我一同工作的同志对本研究所做的任何贡献均已在论文中作了明确的说明并表示了谢意。 研究生签名: 时间: 2020年6月:3日 关于论文使用授权的声明 本人完全了解中国农业科学院有关保留、使用学位论文的规定,即:中国农业科学院有权保留送交论文的复印件和磁盘,允许论文被查阅和借阅,可以采用影印、缩印或扫描等复制手段保存、汇编学位论文。同意中国农业科学院可以用不同方式在不同媒体上发表、传播学位论文的全部或部分内容。 研究生签名: 时间: 72020年6月3日 导师签名: 时间: 20200年年6月4日 摘 要 屡见不鲜的蜂蜜掺假现象对养蜂行业产生了巨大的冲击,制约了蜂蜜市场的健康发展。近年来越来越多的养蜂者为加快蜂蜜生产进度,不等自然封盖即进行频繁摇蜜,产出的未成熟蜂蜜经后续浓缩、脱水等步骤,使蜂蜜的水分、糖含量达到标准规定。尽管此类浓缩蜂蜜的各项基础理化指标与天然成熟蜂蜜无异,但蜂蜜中的微量物质及其具有的生物学活性却可能受到很大影响。为探究未成熟蜂蜜与自然成熟蜂蜜间的差异,本研究以我国最具代表性的油菜( Brassica napus L.)意蜂 (Apis Mellifera L.) 蜂蜜为研究对象,对比研究了封盖成熟油菜蜂蜜与未封盖不成熟油菜蜂蜜的化学组成以及生物学活性。主要研究结果如下:1、采用国标中规定的方法检测了两种油菜蜂蜜中的水分、糖、酸度、糠醛值、淀粉酶值等基础理化指标。结果表明,封盖成熟油菜蜂蜜的各项理化参数均符合标准规定,而未封盖油菜蜂蜜除羟甲基糠醛值符合标准规定外,其余各项指标均不达标。2、通过超高效液相色谱-四极杆串联质谱技术对蜂蜜提取物中的小分子物质进行采集分析,并结合代谢组学数据分析技术进行非靶向分析。经主成分判别分析两类蜂蜜可以实现有效区分。差异性分析结果表明,未成熟油菜蜂蜜中有机酸、糖苷、植物碱等物质含量较多,而成熟蜂蜜中酚类物质含量较高。3、对油菜蜂蜜中常见的多酚类物质进行靶向代谢组学分析,两种蜂蜜中共检出20种多酚类物质,其中山奈酚、芹菜素、松属素、3,4-二甲氧基肉桂酸、白杨素、咖啡酸苯乙酯在未成熟油菜蜂蜜中的含量低于检测限,除香草酸、、丁香酸外,其余12种酚类物质含量均低于成熟油菜蜂蜜。4、DPPH、ABTS+自由基清除能力、铁还原能力测定结果表明,成熟油菜蜂蜜相较未成熟油菜蜂蜜体外抗氧化能力更强;抑菌实验结果表明,两种蜂蜜对金黄色葡葡球菌 (Staphylococcus aureus)、大肠杆菌 (Escherichia coli) 均有抑制效果,且成熟油菜蜂蜜的抑菌效果更为明显,但两种蜂蜜对枯草芽孢杆菌 (Bacillus subtilis ) 均无抑制作用。5、建立过氧化氢诱导小鼠L929成纤维细胞氧化应激模型,探索两种蜂蜜对 H202诱导的细胞氧化应激损伤的保护作用。成熟油菜蜂蜜提取物在浓度为 300 ug/mL 时即可显著提升 H202诱导的受损细胞的生长活力,而未成熟油菜蜂蜜提取物在浓度为 600 ug/mL 时才表现出上述效果;两种蜂蜜提取物均可在一定程度上上调细胞相关抗氧化基因的表达,但成熟油菜蜂蜜提取物对氧化应激受损细胞中抗氧化基因调节作用更为明显。本研究结果表明,成熟油菜蜜具有更丰富的多酚类化合物和更好的生物学活性,这也为成熟蜂蜜的质量标准和评判依据奠定了理论基础。 关键词:油菜蜂蜜,成熟度,代谢组学分析,生物学活性, UHPLC-Q-TOF/MS Abstract . The phenomenon of honey adulteration that has a huge negative impact on the beekeeping industryand restricting the healthy development of the honey market. For a long time, people did not harvesthoney until the bees were capped with beeswax, and it was also known as mature honey. Nevertheless,recent years more and more beekeepers didn’t wait for bees to capped with beeswax and harvest theimmature honeys to increase the honey yield. Obtained immature honey will subsequently concentratedand dehydrated, and those processed honeys still fall within the standard. Although the basic physical andchemical indicators of the concentrated honey had no differences from natural mature honey, the tracesubstances and biological activity of honey may be influenced greatly. So, to explore the differencebetween immature honey and naturally mature honey, we compared the capped mature rape honey(Mature honey, MH) and uncapped immature rape honey (Immature honey, IMH) from the same rape(Brassica napus L.) flower seasons in the western honeybees (Apis Mellifera L.) colonies. The mainresults of the study are as follows: I. The water, sugar, acidity, HMF value, amylase value and other basicphysical and chemical indexes in two kinds of rape honey were tested following the methods provided bythe national standard. The results showed that all the physical and chemical indexes of MH were inaccordance with the standard, while the indexes of IMH were not up to the standard except the HMFvalue. Ⅱ. The information of the small-molecule substances in the honey was collected and analyzed byultra-high performance liliquid chromatography combinedl wi1t hquadrupole time-of-flight massspectrometry-based untargeted metabolomic. MH and IMH can be effectively distinguished by principalcomponent discriminant analysis, and the difference analysis results showed that composition weresignificant differences between MH and IMH. The contents of organic acids, glycosides, plant bases andother substances in IMH were richer than MH, while the contents of phenolic substances in MH werehigher than IMH. Ⅲ. The polyphenols in rape honey were studied by targeted metabolomics analysis. Theresults showed that a total of 20 polyphenols were detected, among which Kaempferol,Apigenin,Pinocembrin, 3-(3, 4-Dimethoxyphenyl)-2-propenoic acid, Chrysin and Phenethyl caffeate is lower inIMH than the detection limit. Vanillic acid and Syringic acid content in IMH is higher than the MH, butthe rest of common phenolics is lower. IV. The results of determination ofDPPH and ABTSfree radicalscavenging ability and iron reduction ability showed that MH had stronger in vitro antioxidant ability thanIMH. The results of bacteriostatic experiments showed that both kinds of honey showed inhibitory effectsagainst Staphylococcus aureus and Escherichia coli, and MH had a larger bacteriostatic sphere and astronger bacteriostatic effect, but both two kinds of honey had no inhibitory effect on Bacillus subtilis. V.The oxidative stress model of mouse fibroblasts L929 was induced by hydrogen peroxide and theprotective effect of two kinds of honey against oxidative stress damage were evaluated. Results showedthat the honey extract from MH at a concentration of 300 pg/mL significantly increase the cell viabilityof H2O2-induced damaged cells, while the honey extracts from IMH at a concentration of 600 ug/mLshowed the above effect. Two kinds of honey extract increased the expressions of antioxidant genesImportantly, the mature rape honey extract has more potent inductive effects on the antioxidant genes in the cells damaged by oxidative stress. Our study showed that the mature rape honey had more abundantpolyphenols and a better biological activity, which also laid a theoretical foundation for the qualitystandard and evaluation basis of the mature honey in the future. Keywords: Rape honey, Maturity, Metabolomic analysis, Biological activity, UHPLC-Q-TOF/MS 目三:录 第一章绪论.. 1.1蜂蜜概述.... 1.2成熟蜂蜜的研究现状.. .2 1.3蜂蜜的生物学活性. 3 1.3.11抗菌性. 4 1.3.2抗氧化活性..... 5 1.3.3抗炎活性. .6 1.3.4激活机体免疫系统..l...... 6 1.3.5清创...... .6 1.4代谢组学技术及其在蜂蜜研究中的应用.... 7 1.4.1代谢组学.... .7 1.4.2代谢组学在蜂蜜研究中的应用... 7 1.5本课题研究目的与主要内容. .8 1.6技术路线.. 8 第二章不同成熟度油菜蜂蜜的理化指标测定及代谢组成分分析.. .10 2.1.试剂及仪器. .10 2.1.1试剂.. .10 2.1.2仪器... .....10 2.2实验方法.... .10 2.2.11样品采集方法 .10 2.2.2理化指标测定...... ......10 2.2.3蜂蜜提取物富集.c.. .11 2.2.4蜂蜜提取物的 HPLC-Q-TOF/MS分析. .11 2.2.55数据处理. .12 2.3结果与讨论.I.. 12 2.3.11理化指标. .12 2.3.2基于UHPLC-Q-TOF/MS 的非靶标代谢物分析. .14 2.3.3基于UHPLC-Q-TOF/MS 的靶标代谢物分析. 15 2.47本章小结... 19 第三章不同成熟度油菜蜂蜜提取物体外抗氧化能力及抗菌能力的对比分析...20 3.1试剂及仪器. 20 3.1.1试剂. .20 .3.1.2仪器. .20 3.2实验方法.5.. 20 3.2.1.总多酚及总黄酮含量测定 .20 3.2.22自由基清除能力测定........ 2 3.2.3铁还原能力的测定........ 21 3.2.4抗菌能力的测定. 21 3.2.55数据处理. 22 3.3结果与讨论.1.. 22 3.3.1.总酚和总黄酮1.. .22 3.3.2 DPPH、ABTS+自由基清除能力及铁还原能力. .23 3.3.3蜂蜜的抑菌性. 24 .3.4本章小结.. 25 第四章不同成熟度油菜蜂蜜提取物对皮肤成纤维细胞的氧化应激保护作用...26 4.1试剂及仪器. .26 4.1.11试剂. .26 4.1.2仪器. 26 .4.2实验方法. 26 4.2.11 细胞培养及细胞活力测定. .26 4.2.2 RNA 提取和荧光定量 PCR.......: .26 4.3结果与讨论.... 27 4.3.11不同成熟度油菜蜂蜜提取物对过氧化氢刺激的L929细胞活力的影响.27 4.3.2不同成熟度油菜蜂蜜提取物对细胞抗氧化相关基因表达的影响..........294.4本章小结.. .30 第五章全文结论与展望.... 3 5.1不同成熟度油菜蜂蜜的理化指标测定及代谢组成分分析. 3 5.2不同成熟度油菜蜂蜜提取物体外抗氧化能力及抗菌能力的对比分析........:3 5.3不同成熟度油菜蜂蜜提取物对细胞氧化应激的保护作用...... 3 5.4 全文展望. 3 参考文献...... 33 .致谢..... .41 作者简历J.. .42 第一章绪论 1.1蜂蜜概述 蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,经蜜蜂收集、与自身特殊物质质合、转化、储存、脱水到熟成的天然甜味物质(中华人民共和国卫生部,2011)。常见的蜂蜜分类依据是其植物来源、蜂种和和理状态等(申永波等,2016;中华全国供销合作总社,2012)。具体而言,根据蜂蜜来源于一种或两种以上的蜜源植物,可分为单花蜂蜜或多花蜂蜜(又称百花蜜);根据其物理状态,可分为固态结晶蜂蜜和液态蜂蜜;依据采集蜂种,由意大利蜂(Apis Mellifera L.) 采集酿造获得的蜂蜜被称为意蜂蜂蜜,而由中华蜜蜂 (Apis Cerana Cerana)采集酿造获得的蜂蜜被称为中蜂蜂蜜;依据蜂蜜的酿造和采集时间,可分为成熟蜂蜜与未成熟蜂蜜。 蜂蜜中含有大量的碳水化合物和少量的矿物质、有机酸、蛋白质、维生素、黄酮、酚酸、酶和其他植物化学物质等(VALLIANOU et al., 2014)。作为一种天然产物,蜂蜜中这些物质的组成依赖于蜜源植物、地理源,同时受气候、加工及贮藏过程的影响 (DZUGANetal.,2018)。碳水化合物(糖类)是蜂蜜中含量最高的物质,约占蜂蜜总重量的70~80%,其中包括约75%的单糖,10~15%的双糖及少量其他糖类(MICHAELet al., 2016; WU et al.,2017)。在大多数单花蜂蜜中,果糖占比较高,如洋槐蜜、枣花蜜、荆条蜜等,但在油菜、蒲公英等蜂蜜中葡萄糖含量可能高于果糖(MICHAEL et al., 2016)。蜂蜜中的蛋白质约占 0.044~0.391 g/100g(宋凤艳等,2016),其主要来源于蜂蜜酿造过程的蜜蜂唾液腺分泌物,主要是王浆主蛋白(MRJP),包括MRJP-1、MRJP-2、MRJP-5、MRJP-7, 其中MRJP-1含量最高(CHUA etal.,2015),蜂蜜中还有一小部分蛋白质是酶类,如转化酶、α-和β-葡萄糖苷酶、过氧化氢酶、酸性磷酸酶、淀粉酶和葡萄糖氧化酶等(SAK-BOSNAR et al.,2012; WON et al.,2008)。蜂蜜中的蛋白质因蜜源、蜂种的不同而有所差异,中蜂蜂蜜蛋白质含量为 0.1%~3.3%,,意大利蜜蜂蜂蜜蛋白质含量为 0.2%~1.6%(LEEetal.,1998)。此外,蜂蜜中的蛋白质也会随着储存时间的不同而有所改变 (IGLESIAS etal.,2006)。蜂蜜中的氨基酸主要包括脯氨酸、苯丙氨酸、酪氨酸、赖氨酸、精氨酸、谷氨酸、组氨酸和缬氨酸等 (HERMOS et al.,2003),其中氨氨酸约占总氨基酸的50~80%(TRUZZI et al.,2014)。脯氨酸某种程度上可以作为蜂蜜的评判标准,特别是用于识别糖浆掺假蜂蜜(MISSIO et al., 2016).蜂蜜中的有机酸含量约为蜂蜜总量的0.57%,且几乎所有的蜂蜜中都含有机酸(KARABAGIAS etal.,2014)。这些有机酸有些直接来源于花蜜,有些来源于花蜜向蜂蜜转化过程中蜜蜂的分泌物以及物质转化过程中形成的中间产物 (CHERCHI et al., 1994),包括天冬氨酸、酪酸、柠檬酸、醋酸、甲酸、延胡索酸、半乳糖醛酸、葡萄糖酸、戊二酸、丙二酸、草酸等,其中蜂蜜中最主要的有机酸是葡萄糖酸,它是蜂蜜成熟过程中蜜蜂分泌的葡萄糖氧化酶作用于葡萄糖的产物(KARABAGIAS et al.,2014)。有机酸影响着蜂蜜的风味、色泽以及蜂蜜的化学特性,如酸度、pH值、电导率等 (MATO et al., 2006)。蜂蜜中的维生素主要来源于蜂蜜中的花粉,尤其是B族维生素, 包括B1、B2、B3、B5、B6、B8、B9等(BONTE et al.,2013)。此外还含有维生素C,但蜂蜜中的维生素C不稳定,极易受光、热影响,且易被葡萄糖氧化所产生的过氧化氢所分解(CIULU et al., 2011)。蜂蜜中的矿物质约有54种,其含量约占蜂蜜总重量的0.03~0.9%,其中常量元素有钾、钙、钠、镁、磷、硫、氯,微量元素包括铝、铜、锌、锰、钴等(SOLAYMAN et al., 2016),其中钾元素是含量最高的,约占蜂蜜矿物质总含量的1/3(NAYIK etal.,2018; YASINetal.,2013)。蜂蜜中矿物质的种类与含量很大程度上取决于蜜源地的土壤环境(ESCUREDOet al.,2013),其性质比较稳定,不易受光、热、氧化剂等因素的影响,而这些矿物质也是蜂蜜中酶发生作用的酶促因子 (POHLetal.,2012)。蜂蜜中的酚类物质主要以酚酸和黄酮类化合物为主,主要包括羟基肉桂酸类、羟基苯甲酸类两大类酚酸类化合物,以及黄酮类、黄酮醇类、黄烷酮等黄酮类化合物,这些物质共同的结构特点为芳香环连接一个或者多个羟基,主要物质有阿魏酸、咖啡酸、p-香豆酸、丁香酸、香草酸、羟基苯甲酸、黄芩素、芹菜素、白杨素、檞皮素、桑色素、柚皮素、山奈酚、短叶松素、高良姜素、儿茶素、杨梅素、松属素、绿原酸、橙皮素、苯甲酸等(ALVAREZ-SUAREZ et al., 2012)。蜂蜜中的酚类物质及其他有机物质受环境条件的影响较大,45℃甚至更高温度处理将会导致蜂蜜中的酚类物质含量的明显下降 (ESCRICHE et al., 2014)。 蜂蜜由于丰富的物质含量及较高的营养价值,长久以来受到消费者的青睐,却也遭受着掺假行为的威胁。这些掺假行为包括勾兑糖浆冒充天然蜂蜜、使用离子交换树脂对蜂蜜脱色以次充好、混淆蜂蜜蜜源种类、在采集期人工饲喂蔗糖及收获未成熟蜂蜜以提高产量等 (GARCIA, 2018;MELUCCI et al., 2019)。其中收集未成熟蜂蜜来提高产量获得更高收益的行为在近些年变得最为常见,收购商为了使蜂蜜达到标准规定的要求,对蜂蜜进行高温加热脱水处理,在这个过程中蜂蜜的水分、总糖含量等基本指标保持在标准规定的范围内,但是加热过程破坏了蜂蜜中的活性物质,同时产生了美拉德反应的产物,严重影响蜂蜜的营养价值(吴黎明等,2019)。随着人们对蜂蜜的研究不断深入,越来越多的研究也证实成熟蜂蜜较未成熟蜂蜜具有明显优势,而收获未成熟蜂蜜以及对未成熟蜂蜜浓缩脱水的行为将被淘汰,成熟蜂蜜将成为蜂产品市场上的主流。 1.2成熟蜂蜜的研究现状 蜂蜜的成熟过程从蜜蜂采集花蜜的工作完成时就已经开始,采集蜂将花蜜或蜜露摄入到蜜囊里带回蜂巢,在蜂巢内开始蜂蜜的酿造。花蜜在蜂巢内不断地被加工和分配,直至最终完成酿造,然后蜜蜂用蜂蜡将酿造好的蜂蜜储存起来,这种用蜂蜡封盖后的蜂蜜称为成熟蜂蜜(陈黎红等,2019)。但是,目前养蜂实践及科学研究通常根据蜂蜜在蜂巢内的封盖情况,将封盖后的蜂蜜定义为成熟蜂蜜,而未封盖蜂蜜被认为是未成熟蜂蜜(吴黎明等,2019)。蜂蜜在蜂巢中酿造的过程中,发生了脱水以及物质的转化,同时蜂蜜的性质也不断发生变化。蜂蜜在酿造过程中的脱水包括主动脱水和被动脱水,这主要是在蜜蜂不断的吞吐行为以及蜂巢内外环境下完成的,蜂巢表面积越大、环境湿度越低,水分浓缩越快(陈黎红等,2019)。伴随着脱水过程的进行,蜂蜜中的糖含量不断升高、吸湿性也同时增加,水分含量降低到18%左右,糖含量增加到70%以上。蜂蜜中的蔗糖等多糖在蜜蜂分泌的转化酶作用下分解成葡萄糖和果糖等单糖。蜂蜜中的微生物在不断的成熟过程中变得稳定易保存 (VAZQUEZ-QUINONESet al.,2017)。与此同时,蜂蜜的性质也会因蜂蜜成熟过程中的物质变化而发生显著变化,如水分的降低使得蜂蜜不易发酵、吸湿性提高;蜜蜂分泌的葡萄糖氧化酶能分解蜂蜜中的葡萄糖,产生葡萄糖酸和过氧化氢,使得蜂蜜具有明显的抑菌作用。蜂蜜的成熟过程是一个不断变化的过程,这个复杂过程需要更多的科学研究去解释。 Ma 等(2019)研究了成熟与未成熟洋槐蜂蜜的理化指标,表明酚类物质、蛋白质、糖含量是洋槐蜂蜜成熟过程的主要变量,主成分分析结果表明洋槐蜂蜜的理化指标与成熟度有很好的相关 性。张然等(2019)研究了四个不同时间点采集的洋槐蜂蜜,结果表明9种酚类物质在蜂蜜酿造过程中发生了变化,故而推测利用酚类物质的变化可能实现对不同成熟度蜂蜜的区分。于泽浩等(2017)研究了花蜜、蜜囊内蜜液以及在蜂巢内酿造9日的蜂蜜,表明蜂蜜在酿造成熟过程中总糖含量增加,蔗糖和麦芽糖含量降低,果糖和葡萄糖含量升高;淀粉酶及蔗糖转化酶值增加。叶梦迪等(2015)研究了油菜蜂蜜成熟过程中的蛋白质和糖含量,结果表明蜂蜜中的蛋白质组成较稳定,且随着酿造天数的增加蛋白质含量升高,果糖在α-葡萄糖苷酶的水解作用下,含量不断升高。张创等(2015)探讨了封盖蜂蜜和未封盖蜂蜜中的脯氨酸含量,表明脯氨酸含量与成熟度并没有显著的相关性。宋心仿等(2006)对比了生产成熟蜂蜜与高产量未成熟蜂蜜之间的经济效益,表明生产成熟蜂蜜大大提高了市场竞争力,经济效益平均提高了7.1%。综上所述,蜂蜜的成熟过程同其理化参数具有很大的相关性,生产成熟蜂蜜可以大大提高蜂蜜的经济效应以及蜂蜜的品质。 在我国,油菜蜂蜜是最大宗、稳产的蜜种,全年约占蜂蜜总产量40%以上,同时大部分油菜蜂蜜的生产是最普遍也是最典型的未成熟期收获蜂蜜(叶梦迪,2015)。油菜在我国广泛种植,且蜜粉兼备,是我国养蜂最重要的蜜粉源。但养蜂人为了追求更高的产量以获取更大经济收益,频繁采收油菜花盛花期的未成熟蜂蜜进行销售,久而久之,油菜蜂蜜市场形成了品质低廉的恶性循环。我国油菜蜂蜜蜜源分布广、花期长,从2月份的云南、广西、福建等地,到7月份的青海、内蒙古等地,油菜花期长达6个月。天然优质的油菜蜜源却没有成就优质的油菜蜂蜜,油菜蜂蜜在市场上罕见,经常以掺假蜂蜜的形式出现,如油菜蜂蜜掺入到洋槐蜂蜜中以次充好(刘琪,2014)。目前对于油菜蜂蜜也有一些研究,且相对于洋槐蜂蜜、荆条蜂蜜、枣花蜂蜜等这些常见的蜂蜜,油菜蜂蜜在物质组成上并没有明显的劣势 (DZUGAN et al., 2018; KUS et al., 2014)。油菜蜂蜜中含有多种挥发性物质,如脱氢芳樟醇、苯甲醛、异戊睛、2-苯基乙醇、壬酸等,这些物质很多都是天然的食品香料,也常作为制备香精的主要原料 (KRUZiK et al.2019)。油菜蜂蜜中含有有皮素、山奈酚、高良姜素等黄酮类物质(邢建军等,2010),这些活性物质赋予了油菜蜂蜜抗菌性、抗氧化等功能。因此,针对我国蜂蜜的现状,本文选择成熟油菜蜂蜜以及未成熟油菜蜂蜜进行研究,对不同成熟度蜂蜜的物质组成及生物学活性差异进行初探。 1.3蜂蜜的生物学活性 蜂蜜中物质种类含量丰富,营养价值高,长久以来被广泛研究以及实践应用,蜂蜜中复杂的物质组成使得蜂蜜发挥多种功能活性,如抗菌性、抗氧化性、抗炎性等(表1-1)。 表1-1蜂蜜的生物学活性 Table 1-1Biological activities of honey 活性 抗菌性 作用因素 作用机理 参考文献 高渗透压、低 pH 提供不适宜微生物生长繁殖的微环境 (BANG et al., 2003) 过氧化氢 抗坏血酸 降低初始染菌数 (KNIGHT et al., 2013) 浓度机制将白细胞诱导到伤口处 (KNIGHT et al., 2013) 增加溶菌酶对微生物的溶解 (SCHREML et al.,2010) 甲基乙二醛 抑制细菌分裂 (DART et al.,2015) 防御素 破坏胞膜完整性 (IRISH et al.,2011) 表1-1(续) 活性 作用因素 作用机理 参考文献 抗氧化 酚类、酶类、肽类 清除活性氧自由基 (ALVAREZ-SUAREZ et al., 2013) 矿物质、维生素 还原和螯合铁离子 (ALVAREZ-SUAREZ et al., 2013) 催化脂质过氧化 (MCDERMOTT et al.,2004) 抑制过度炎症 (HUSSEIN et al.,2013) 抗炎 蜂蜜微环境 抑制活性氧形成、MMP-9活性 (MAJTAN et al., 2014) 抑制 NF-KB信号通路 (HUSSEIN et al.,2013) 减轻水肿和疼痛 (YAGHOOBI et al.,2013) 增加淋巴细胞和巨噬细胞活性 (MOLAN et al.,2012) 增强免疫 蜂蜜微环境 降低前列腺浓度 (AL-WAILI et al.,2003) 促进抗体产生 (HUSSEIN et al., 2012) 清创 蜂蜜微环境 提高血纤维蛋白溶解酶活性 (MOLAN et al., 1999) 无痛清除坏死组织 (SUKUR et al.,2011) 1.3.1抗菌性 蜂产品的抗菌性被广泛熟知,并应用于治疗伤口。蜂蜜作为抗菌剂很大程度上缓解了抗生素滥用和耐药菌株的出现导致患者发病率和死亡率增加的困境。近年来,由于蜂蜜对耐抗生素微微物的影响而受到研究者的广泛关注。尽管理论上增加蜂蜜的使用可能促进微生物对蜂蜜的耐药性,但迄今为止,还没有报道发现耐蜂蜜的微生物菌株,这可能是由于蜂蜜的多因素抗菌特性影响的结果。 1.3.1.1蜂蜜抗菌活性的物理特性 蜂蜜的高渗透压是限制微生物生长繁殖的主要因素。天然成熟的蜂蜜含水量一般低于18%,常温下为一种高粘性液体,并表现出高渗透压作用 (MADDOCKS et al., 2013)。蜂蜜中的果糖、葡萄糖、麦芽糖、蔗糖和其他物质共同创造了蜂蜜的高渗透压,涂抹伤口后,高渗环境会导致微生物脱水甚至死亡,同时蜂蜜的渗透压作用促进淋巴液从皮下组织运输到到口表面,有助于清除细胞碎片和坏死组织 (AJIBOLA et al., 2012; STEWART et al., 2014)。 由于葡萄糖酸等酸性物质的存在,蜂蜜的 pH 范围通常为3.2~4.5(KNIGHT et al., 2013)。蜂蜜的低 pH 特性可有效抑制多种微生物的活性,不利于微生物的生长。当蜂蜜被稀释时,葡萄糖氧化酶催化葡萄糖生成葡萄糖酸和过氧化氢使得蜂蜜的酸度进一步下降 (BANG et al., 2003)。GETHIN 等(2014)研究表明蜂蜜提高慢性伤口治愈率与其降低伤口pH有关,伤口 pH每降低0.1,伤口面积减少约8.1%。蜂蜜的低 pH 环境可降低蛋白酶活性,减少炎症发生,增加成纤维维胞活性,增加毛细血管中血红蛋白的氧释放量,减少创面大小,最终促进创面愈合(YAGHOOB]et al., 2013; SCHREML et al., 2010)。此外,蜂蜜中的酸性物质还有助于巨噬细胞的抗菌作用和防止细菌代谢产生的氨对机体组织造成伤害(MOLAN et al.,2001b)。 1.3.1.2蜂蜜抗菌活性的化学物质基础 过氧化氢是蜂蜜发挥抗菌活性的主要有效成分,是由葡萄糖氧化酶催化葡萄糖分解而产生的(KNIGHTet al.,2013)。在蜂蜜成熟过程中葡萄糖氧化酶逐渐处于失活状态,并随着蜂蜜的稀释其活性被激活。研究表明,30%~50%的蜂蜜浓度有更高的过氧化氢积累,而高浓度蜂蜜中的过氧化氢含量则很低 (BANGetal.,2003),就过氧化氢含量而言,低浓度的蜂蜜比高浓度蜂蜜抗菌效果更好。过氧化氢可以通过浓度梯度机制将白细胞诱导到伤口处,发挥抗菌活性。在受到氧化诱导后巨噬细胞可进一步刺激血管内皮生长因子释放和促进血管生成,此外在急性炎症中中性粒细胞释放活性氧也可起到杀灭细菌的作用 (KNIGHTet al.,2013)。通常情况下,单纯利用过氧化氢不利于伤口愈合,因为其会诱导过度炎症和组织损伤,而蜂蜜中过氧化氢浓度很低,其浓度不到医用过氧化氢浓度的 1/1000,对伤口愈合不造成损害作用 (MOLAN et al., 2001a; AJIBOLA etal.,2012)。 蜂蜜中抗坏血酸、甲基乙二醛(Methylglyoxal,MGO)、防御素和甲基丁香酸酯等物质的存在也可以发挥抗菌活性。蜂蜜中的抗坏血酸可以增强过氧化氢的抗菌活性。研究表明在在兰氏阴性菌中,过氧化氢和抗坏血酸的混合物增加了溶菌酶对生物体的溶解和死亡(SCHREML et al.,2010)。同时蜂蜜中抗坏血酸等物质的抗氧化性会保护伤口免于过氧化氢产生的氧自由基的损害。 MGO能够与 DNA 等大分子亲核中心相互作用,在革兰氏阳性菌中MGO 抑制细菌细胞壁裂解和细胞分裂,在革兰氏阴性菌中 MGO 调控与细胞壁稳定性相关基因的表达(DART etal.,2015)。防御素是蜜蜂体内一种可诱导的抗菌肽,有防御素-1、防御素-2两种存在形式,其中防御素-1可以在蜂蜜中被检测到,其通过破坏病原菌细胞膜的完整性和渗透压而发挥抗菌作用(IRISH et al., 2011;MCDERMOTT et al., 2004)。蜜蜂防御素-1对真菌菌丝、阳兰氏阳性菌和部分革兰氏阴性菌均具有防御功能,但对耐抗生素微生物则没有明显防御功效,对耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)也仅有轻微的抑制作用(WILLIAMS et al.,2009;KWAKMAN et al., 2011)。 1.3.2抗氧化活性 蜂蜜具有良好的抗氧化活性,多种生物活性物质成分,如黄酮(如,芹黄素、松属素、山奈酚、檞皮素、高良姜素、白杨素、橙皮素)、酚酸(如,鞣花酸、咖啡酸、对香豆酸、阿魏酸)、抗坏血酸、生育酚、过氧化氢酶、超氧化物歧化酶、还原型谷胱甘肽、美拉德反应中间产物、多肽类、氨基酸和矿物质等是蜂蜜发挥抗氧化活性的基础(MCDERMOTT et al., 2004; ALVAREZ-SUAREZ et al., 2013)。其中多酚类是蜂蜜发挥抗氧化活性最重要的物质种类。酚类化合物具有还原和螯合铁离子、催化脂质过氧化、清除活性氧自由基、过氧基、烷基过氧化物、羟基和超超化物自由基的能力,其抗氧化作用大小取决于羟基在芳环中的相对位置 (ALVAREZ-SUAREZ et al.,2013)。蜂蜜的抗氧化性与总酚含量有很大相关性,通常深色蜂蜜较浅色蜂蜜总酚含量高抗氧化能力强。此外,蜂蜜中美拉德反应的产物也是自由基清除能力的主要成分(MAJTAN et al.,2014;SARICet al.,2013)。蜂蜜中抗氧化物质的存在可以避免伤口长期暴露在活性氧环境中而造成的细胞损伤和伤禾延迟愈合(MAJTAN et al., 2014)。 1.3.3抗炎活性 炎症是机体抵抗有害刺激并启动伤口愈合的生物反应,是导致伤口疼痛和水肿的主要原因。炎症期的延长会导致肉芽肿和纤维化形成,而使用蜂蜜可以缩短炎症期、减轻或消除疤痕的形成(YAGHOOBI et al., 2013; MAJTAN et al., 2014)。研究表明蜂蜜可以抑制活性氧形成、白细胞浸润、基质金属蛋白酶-9(MMP-9)活性、环氧合酶-2(COX-2)活性和诱导一氧化氮(NO) 的合成发挥抗炎作用(MAJTANet al.,2014;HUSSEIN et al.,2013)。蜂蜜能够抑制核转录因子 KB (NF-KB)信号通路的激活,进而减少 COX-2和肿瘤坏死因子-α(TNF-α)等炎症介质的释放(HUSSEINetal.,2013)。研究发现蜂蜜可以阻断激活 IkB 激酶复合物(Ikk)的传入信号通路,控制IKB 蛋白降解,阻止 NF-KB 亚基的易位(p65 和p50), 最终抑制诱导型一氧化氮合酶 (iNOS)、COX-2、TNF-α和白介素-6(IL-6)的表达、前列腺素E2(PGE2)和NO 的生成 (HUSSEIN etal.,2013)。此外,蜂蜜作为一种免疫调节剂,具有促炎和抗炎的双重作用。在轻微炎症或刺激下,蜂蜜可以刺激炎症因子和角质形成细胞中 MMP-9的形成,而在伤口感染发生炎症时,蜂蜜可以抑制炎症因子和 MMP-9的形成(MAJTAN et al., 2014)。 1.3.4激活机体免疫系统 机体免疫系统受到外界刺激后会立即启动,以防止伤口进一步感染,而蜂蜜的使用可以使免疫系统发挥更多样的免疫功能。蜂蜜可以增加淋巴细胞和巨噬细胞活性、降低前列腺素(PGs)浓度、促进抗体产生而提高机体免疫能力(YAGHOOBI et al., 2013; MOLAN et al., 2012:JASTRZEBSKA-STOJKO et al.,2013)。研究表明,蜂蜜可以刺激淋巴细胞活化,并激活中性粒细胞的吞噬作用,刺激单核细胞(MMP-6)分泌细胞因子、TNF-a、IL-1和IL-6等激活机体的免疫应答 (YAGHOOBI et al., 2013; MOLAN et al., 2012;JASTRZEBSKA-STOJKO et al., 2013)。蜂蜜可以降低导致炎症和疼痛的介质-PGs, 其被认为是可以降低B淋巴细胞和T淋巴细胞功能的免疫抑制剂,而蜂蜜的使用可以有效降低血浆中前列腺素的浓度并且作用时间越长效果越强(AL-WAILI et al.,2003)。蜂蜜诱导 PGs 浓度的降低,可减轻水肿和炎症,激活淋巴细胞产生针对伤口病原体的抗体(HUSSEIN et al., 2012)。研究表明蜂蜜中的酚类物质,如鞣花酸可以阻止单核细胞中 PGE2 的释放,檞皮素、白杨素、木樨草素可以抑制白介素-1B(IL-1B)和 COX-2的表达、PGE2的合成、NF-KB 的激活 (JASTRZEBSKA-STOJKO et al., 2013)。临床发现摄入天然蜂蜜溶液可以降低正常人血浆中的前列腺素浓度,包括 PGE2、PGF2a 和凝血素 B2等(AL-WAILIet al., 2003;HUSSEIN et al.,2012)。 1.3.5清创 伤口清创是手术切除坏死组织的过程,也是诱导组织修复的重要环节,清创通常在局部镇痛下进行,然而这种方法会引起伤口感染细菌,产生毒素,破坏周围组织(SUKUR et al., 2011)。蜂蜜提供的湿润环境,高渗透压与过氧化氢对蛋白酶的激活可使得蜂蜜发挥清创功能,且蜂蜜可以实现无痛清除坏死组织(AJIBOLA et al., 2012; MIGUEL et al., 2017; SUKUR et al.,2011)。体外实验表明蜂蜜可以提高培养基中的血纤维蛋白溶解酶活性,消化附着在创面粘膜上的纤维蛋白而不 消化组织修复所需的胶原基质(MOLANet al.,1999). 1.4代谢组学技术及其在蜂蜜研究中的应用 1.4.1代谢组学 代谢组学是继基因组学、蛋白质组学之后兴起的一种组学分析手段,是一门探索个体生命系统与其代谢物之间的联系,及代谢物筛选和代谢通路分析的科学,是研究生物样品系统代谢变化的整体方法。代谢组学以生命体的代谢物为研究对象,主要研究分子量1000以下的小分子,根据所研究对象的不同可以分为探究已知化合物的靶向代谢组学和分析未知化合物的非靶向代谢组学(许彦阳等,2019)。靶向物质分析是针对某些特定的物质进行高通量检测和定量分析,非靶向物质分析是对生命体中的代谢物质做系统广泛地分析,更多地定性和定量生命体中的代谢物。由于代谢组学研究对象繁多复杂,个体间存在很大差异,必须借助有效的分析工具。如今,普遍的代谢组学分析技术是核磁共振和色谱质谱分析技术。核磁共振技术是根据能量吸收曲线分析原子在分子中的位置及数量,从而实现物质的定性分析和定量分析,具有样品无损伤、实时检测的优点,可以实现对完好组织的代谢分析,在农产品成分分析、品质鉴别、质量控制等方面应用广泛。但是核磁共振灵敏度低,会导致丰度高的物质掩盖低丰度物质,对于痕量成分及样品量小的样品不适用。色谱质谱分析技术是将色谱质谱联用,既有色谱的分离效果又有质谱的高灵敏度、高选择性能并且可以提供物质的相对分子质量与结构信息,可实现复杂混合物的更快分离,大大缩短样本的分离时间,降低了样本的检出限。色谱质谱联用技术是目前代谢分析最流行的技术之一。主要有气相色谱质谱联用和液相色谱质谱联用。气相色谱分析易挥发成分,弱极性,热稳定性的化合物。液相色谱质谱分析技术主要用于分析性质活跃、难挥发的的性成分。 经分析仪器得到的代谢物数据复杂且量大,需要使用相应的数据分析软件件行单因素变量分析和多元变量等统计学分析(亓云鹏等,2008)。通过相应分析软件特有的功能探究代谢物的变化情况、变量权重和差异性变化,结合多种数据分析揭示不同样品中的代谢物差异,通过进一步筛选分析获得目标差异代谢物。目前,代谢组学技术的不断应用使得符合数据采集软件特点的数据分析软件应运而生,如AGILENT公司的 MPP 软件、WATERS 公司的QI软件、SCIEX 公司的Lipid View 软件等,这些分析软件的使用让代谢组学分析更为方便,大大简化了分析工作(许彦阳等,2019)。且根据配备的数据库(如HMDB、KEGG、METLIN、NIST)进行代谢物的结构鉴定和相应代谢通路分析,通过数据库的匹配,进一步对物质进行靶向分析。 1.4.2代谢组学在蜂蜜研究中的应用 近年来,代谢组学数据分析技术广泛应用于生物样品的代谢物分析,已经成为分析和比较生物体内的代谢物,描述生物样品的内在相似性和差异性的有利工具。目前代谢组学已被应用于蜂蜜研究的许多方通,包括蜂蜜品种鉴别、掺假鉴别、活性成分研究以及蜂蜜与蜜蜂之间的关系等(SONG et al., 2020; WANGet al., 2019)。总的来说代谢组学能够根据生物体的代谢物揭示其某种性质,这在蜂蜜研究上具有巨大的潜力。 SONG 等利用 'H-NMR 对掺假洋槐蜂蜜(掺有油菜蜂蜜)进行了研究,结果表明利用0.00~ 6.00 ppm 光谱范围内的化合物,可以有效实现对掺假洋槐蜂蜜的有效鉴别,为我国洋槐蜂蜜的品质控制提供了科学依斗 (SONG et al.,2020); WANG等利用 GC-MS分析了中蜂蜂蜜与意大利蜜蜂蜂蜜的挥发性代谢物,通过非靶向与靶向代谢组学分析,结果表明两种蜂蜜存在明显的差异,为中蜂蜂蜜的后续研究提供了契机(WANG et al.,2019); RAZALI 等利用 H-NMR 和UHPLC-QTOF MS 探究了蜜蜂起源地对蜂蜜的影响,通过研究三种不同蜜蜂起源地的无刺蜂蜂蜜,揭示了蜜蜂起源地对蜂蜜品质有重要的影响 (RAZALI et al., 2018); LUONG 等利用 NMR 对蜂蜜进行无损分析,通过主成分分析有效区分了不同蜜源的蜂蜜 (LUONG et al.,2019);WANG等利用LC-MS 寻找特种蜂蜜的潜在标志物,通过对夏枯草蜂蜜代谢组学的研究,揭示了迷迭香酸是夏枯草蜂蜜的潜在标志物,从而建立了夏枯草蜂蜜的指纹图谱,为特种蜂蜜的开发提供了科学保障(WANG et al., 2019)。由此可以看到,代谢组学对于蜂蜜中低分子量的代谢物展现出了系统性、无偏见的分析,为蜂蜜的更深入研究提供了强有力的保障。 1.5本7课题研究目的与主要内容 当前,国内蜂蜜市场混乱,盛花期收获未成熟蜂蜜以求在短时间内提高蜂蜜产量是目前养蜂生产中的普遍行为,此类欺诈性的行为破坏了蜂蜜的营养价值,同时损害了蜂产品市场的良性循环。随着人们生活水平的提高以及对蜂蜜的不断认识,蜂产品质量与营养价值越来越成为消费者看重的品质。自然成熟蜂蜜作为一种天然产品备受消费者青睐,因此,比较自然成熟蜂蜜与未成熟蜂蜜的物质差异以及二者之间的功能活性差异尤为重要,通过本次研究力争为规范蜂蜜市场提供重要的科学依据。 本课题以自然酿造成熟和未成熟油菜蜂蜜为研究对象,围绕蜂蜜中的物质组成及功能活性,主要进行了以下四方面的研究: 1、研究自然酿造成熟蜂蜜与未成熟蜂蜜的基础理化指标。选用同一蜜源及同一蜜源地的未成熟及成熟油菜蜂蜜,根据标准中规定的方法测定蜂蜜中的水分、糖类、酸度、酶值等指标,分析自然酿造成熟蜂蜜与未成熟蜂蜜的主要理化指标差异。 2、研究自然酿造成熟蜂蜜与未成熟蜂蜜中非靶向及靶向代谢物差异。蜂蜜含有复杂多样的物质,除经常被研究的酚酸、黄酮类物质外,还含有许多其他的微量物质。基于 UHPLC-Q-TOF/MS及代谢组学分析技术,对蜂蜜中的代谢物进行非靶向宏观分析,研究成熟蜂蜜与未成熟蜂蜜之间的代谢物差异及种类,进一步对蜂蜜中的酚类物质进行靶向研究,寻找成熟蜂蜜与未成熟蜂蜜的潜在差异标志化合物。 3、研究比较两种蜂蜜的体外抗氧化活性及抗菌活性差异。通过体外自由基清除实验和体外抑菌实验,比较两种蜂蜜之间体外抗氧化能力和抑菌作用。 4、研究两种蜂蜜对过氧化氢诱导细胞损伤的保护作用。以小鼠皮肤成纤维细胞(L929)为研究对象,建立过氧化氢刺激细胞氧化损伤模型,通过研究蜂蜜处理后对受损细胞活力的影响以及对抗氧化基因表达的影响,比较两种蜂蜜对细胞氧化损伤的保护作用效果。 1.6技术路线 第二章不同成熟度油菜蜂蜜的理化指标测定及代谢组成分分析 2.1试剂及仪器 2.1.1试剂 纯水, Millipore; 水溶性维生素E、抗坏血酸、没食子酸、皮素等标准品,(上海)生工生物工程责任有限公司; 1,1-二苯基-2-三硝基苯肼 (DPPH)、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(ABTS*), 美国 Sigma 公司; 色谱级甲醇、甲酸等, Fisher 公司; Sep-Pak C18 固相萃取小柱, Waters 公司; 0.22um尼龙膜,津腾公司。 2.1.2仪器 电子分析天平(千分之一), METTLER-TOLEDO公司; 混合振荡器,(海门市)其林贝尔仪器制造责任有限公司; 阿贝折光仪,(上海)恒平科学仪器有限公司; 固相微萃取装置,(天津)奥特赛恩斯仪器公司; KQ-500DE 数控超声波清洗器,昆山市超生仪器有限公司; 超高效液相色谱-质谱(UHPLC-Q-TOF/MS),Agilent 公司; SpectraMax@i3 全扫描酶标仪,上海美谷分子仪器责任有限公司。 2.2实验方法 2.2.1样品采集方法 油菜蜂蜜样品于2019年3月采自四川省成都市天府新区籍田镇粮丰村试验蜂场(意蜂)。挑选三群群势一致的蜂群,清空巢脾内的蜂蜜,仅留少量供蜜蜂食用。采集流蜜24h 的蜂蜜记为未封盖不成熟蜂蜜 (Immature honey,IMH),同时在同一蜂箱中采集封盖面积大于70%的蜂蜜记为封盖成熟蜂蜜 (Mature honey, MH)。每个蜂群分别采集3个 IMH和MH样品,共18蜂蜜样品,包括9个未成熟蜂蜜样品,9个成熟蜂蜜样品,-20℃保存。 2.2.2理化指标测定 所有理化指标按照国家相关标准测定,羟甲基糠醛含量测定:GB/T 18932.18-2003《蜂蜜中羟甲基糠醛含量的测定》;淀粉酶值含量测定: GB/T18932.16-2003《蜂蜜中淀粉酶值的测定》;酸度的测定:GH/T1141-2017《蜂蜜及其制品酸度的测定》;糖含量的测定: GB 5009.8-2016《食品 中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》;水分含量测定: SN/T0852-2012《进出口蜂蜜检疫规程》,每个样品平行测定三次,结果取平均值。 2.2.3蜂蜜提取物富集 称取蜂蜜样品 5 g, 加入10 mL 去离子水,震荡溶解,60 kHz 功率超声处理 10 min, 8000 rpm离心5 min, 取上清液待测。将 Sep-PakC18 固相萃取柱安放在固相萃取装置上,先后用 5mL 甲醇和 5mL纯水对 C18固相萃取小柱进行活化,取离心后的上清液置于 C18 固相萃取柱,使用泵调节流速至 1~1.5 mL/min, 待样品溶液全部流出后,用10mL纯水淋洗 C18小柱,负压下将水抽干,然后用8mL 甲醇洗脱,收集甲醇洗脱液,常温下氮气吹干制得蜂蜜提取物。-20℃保存备用。 2.2.4蜂蜜提取物的 HPLC-Q-TOF/MS分析 蜂蜜提取物用甲醇复溶至 10 mg/mL,充分溶解后经0.22 um 尼龙滤膜过滤,置于棕色小瓶内待测。色谱条件: Poroshell120EC-C18 (2.1×100 mm, 2.7 um) 色谱柱; 0.1%甲酸水(A)、甲醇(B)做流动相;2uL进样量;柱温30℃; 0.25 mL/min 流速;梯度洗脱程序见表2-1。 表2-1梯度洗脱程序Table 2-1 Gradient elution procedures 时间 min A (%) B (%) 0-1 95 5 1-6 45 55 6-20 5 95 20-26 5 95 26-27 95 5 质谱条件:ESI 离子源;载气温度 320℃;:气体流速8L/min;喷雾器压力 40 psi;毛细管电压3500V;鞘气流速:11L/min;鞘气温度:350℃;扫描模式:负离子扫描模式。 制备标准曲线:配制浓度为1000 mg/L的原儿茶酸(3,4-Dihydroxybenzoic acid)、绿原酸(Chlorogenic acid)、咖啡酸 (Caffeic acid)、香草酸(Vanillic acid)、丁香酸 (Syringic acid)、P-香豆酸(p-Coumaric acid)i阿魏酸 (Ferulic Acid)、短叶松素三乙酸脂(3-O-Acetylpinobanksin)、榭皮素(Quercetin )、橙皮素 (Hesperitin)、短叶松素(Pinobanksin)、柚皮素(Naringenin)、高良姜素 (Galangin)、木樨草素(Luteolin)、山柰酚(Kaempferol)、芹菜素 (Apigenin)、松属素( pinocembrin )、3,4-二甲氧基肉桂酸(3-(3,4-Dimethoxyphenyl)-2-propenoic Acid)、白杨素(Chrysin)、咖啡酸苯乙基酯 (Caffeic acid phenethylester)标准品储备液,-20℃保存备用。制备30 mg/L的标准品混合液,然后逐级稀释成15、10、7.5、5、2.5、1.25、1、0.5、0.1mg/L,根据峰面积及浓度制得标准曲线。 2.2.5数牧处理 2.2.5.1非靶标物数据分析 非靶标代谢物的分析过程见图2-1。拷贝 HPLC-Q-TOF/MS 所得原始数据, 经Muss HunterProfinder 数据分析软件提取得 CEF 文件。如此蜂蜜中所有可能的物质的保留时间、响应丰度都被以列表的形式给出,然后这些数据通过 Mass Profiler Professional (MPP)软件进行频度过滤(F>70%)。过滤后的数据进一步通过T检验、单因素方差分析分析以及主成分分析分析其差异性。同时根据已有中药库(Traditional Chinese Medicines (TCM), Agilent Technologies)进行物质匹配。 图2-1非靶标代谢物分析流程 Figure 2-1 The analysis process of untargeted metabolite 2.2.5.2酚类物质分析 利用 Mass Hunter Qualitative Analysis 软件提取样品色谱图,利用物质的保留时间、分子量、质谱谱图进行定性,同时利用外标法进行物质定量分析。定量结果通过T检验进行差异性分析。 利用 Excel 进行常规数据整理,利用 SPSS 9.6 和 GraphPad Prism. 8进行数据处理及图片绘制。 2.3结果与讨论 2.3.1 理化指标 蜂蜜的各项理化指标是表征蜂蜜品质质简单、最基本的指标。我们测定了蜂蜜中的水分、糖、 酸度、羟甲基糠醛、淀粉酶值的含量,见表2-2。结果表明成熟油菜蜂蜜的理化指标:水分含量为18.31±1.52%,酸度为13.67±1.88 meq/kg, 总糖含量73.22±2.71%,果糖含量为 36.40±0.37%,淀粉酶值为 6.71±1.01 mL/(g*h); 未成熟油菜蜂蜜的理化指标:水分质量分数为31.20±1.81%,酸度为19.9±0.42 meq/kg, 总糖含量61.11±2.09%,果糖含量为 30.86±0.64%,淀粉酶值为3.20±0.98mL/(g*h)。由于植物源、气候、收获时间、贮藏条件的不同,蜂蜜中的理化参数有一定的差异,但都保持在一定的范围内。水分含量是影响蜂蜜货架期的关键因素,蜜蜂采集的花蜜中水分含量超过一半,而后经蜜蜂带回蜂巢,在蜂巢环境及蜜蜂作用下脱水。因此,早期收获的未成熟蜂蜜水分含量高,这增加了蜂蜜在储存过程中发生发酵的风险。本试验成熟蜂蜜的水分含量(18.32±1.52%)低于标准(中华全国供销合作总社,2012)对蜂蜜的规定(≤20g/100g)。而未成熟蜂蜜的含水量(31.20±1.81%)明显高于标准规定,这意味着未成熟蜂蜜更容易发生发酵,品质更加低劣。酸度是表征微生物和蜂蜜新鲜度的指标,蜜源种类以及蜜源地的不同会导致蜂蜜酸度的差异,已有研究表明不同蜜源的蜂蜜酸度范围为9.7~29.5 meq/kg (GEANA et al., 2020),本文成熟蜂蜜试验样品酸度为 13.67 ±1.88 meq/kg, 未成熟蜂蜜酸度为19.9±0.42 meq/kg, 这说明蜂蜜酸度很大程度上受蜂蜜成熟度的影响。羟甲基糠醛(HMF)是表征蜂蜜是否新鲜及真实的指标,高含量的 HMF 表明蜂蜜经过热处理或者蜂蜜保存不当或是糖浆掺假(WU et al., 2017)。然而,本文试验样品均未检测出 HMF,这说明我们的蜂蜜样品保存完好。糖是蜂蜜中含量最高的物质,含量高达70~80%,因收获时间、蜂蜜在蜂巢内的振翅行为、花蜜来源的不同,蜂蜜中的糖含量也不同(MICHAEL etal.,2016;张晓华,2019)。蜂蜜中占主导作用的糖类是葡萄糖和果糖,其中果糖是表征蜂蜜营养价值的糖,蜂蜜中果糖和葡萄糖含量分别为15.5~49.3%和18.2~48.0%,(WUetal.,2017),通常蜂蜜中果糖含量较葡萄糖含量丰富。蔗糖在蜂蜜中含量很少甚至不存在,因为蜂蜜中的蔗糖在蜂蜜的成熟过程中被蜜蜂分泌的酶类水解成葡萄糖、果糖和其他的单糖。般油菜蜂蜜中葡萄糖含量高于果糖含量,但是本试验中的成熟油菜蜂蜜样品中果糖含量要高于葡萄糖含量。这表明蜂蜜在蜂巢内成熟过程可能促使糖转化成更多的果糖。淀粉酶是表征蜂蜜酿造程度以及新鲜程度的指标,蜂蜜中的淀粉酶一部分来源于花蜜,一部分来源于蜜蜂分泌物,且不同的蜜源对淀粉酶含量有一定的影响,通过本研究揭示了不同的酿造时间及采收时间也会影响蜂蜜中的淀粉酶含量。本试验中成熟蜂蜜淀粉酶值高于未成熟蜂蜜,这说明蜂蜜在蜂巢中的酿造促使蜂蜜中的淀粉酶含量上升。淀粉酶可以促进人体消化吸收,具有一定的营养价值,对蜂蜜品质的影响也很大。 综上所述,相比于未成熟蜂蜜而言,成熟蜂蜜具有较低的水分含量,较高的果糖含量,较低的酸度及较高的淀粉酶值,因此成熟蜂蜜更耐保存,食用品质更佳。 表2-2MH 与IMH的理化指标 Table 2-2 Physicochemical Parameters of MH and IMH MH IMH 果糖% 36.40±0.37a 30.86±0.64 葡萄糖% 34.49±2.178 30.14±0.72a 蔗糖% 2.33±0.17a 1.11±0.73 水分% 18.31±1.52a 31.20±1.815 酸度 meq/kg 13.67±1.88a 19.9±0.42 表2-2(续) MH IMH 淀粉酶值 6.71±1.014 3.20±0.98 羟甲基糠醛 ND ND 注: “ND”表示未检出;不同字母(a,b)表示在 P<0.05水平上有显著差异 2.3.2基于UHPLC-Q-TOF/MS 的非靶标代谢物分析 利用液相质谱联用技术及代谢组学技术对蜂蜜活性富集物进行非靶标代谢物质分析。所有进入色谱柱被采集到的物质都被保留下来,经 MPP 软件共提取到3751种物质。原始数据经频度过滤筛选 (FQ>70%)后保留3060种物质,结果用 Venn 图表示(图2-1)。结果表明成熟蜂蜜共检测出2572种物质,未成熟蜂蜜共检测出2686种物质,两者相同的物质有2198种。然后通过单因素方差分析(P<0.05)以及差异倍数 (Fold change, FC)处理,分析不同组蜂蜜间的物质差异,结果用火山图进行可视化表示(FC≥2),结果见图2-2。图中每个点表示-一种物质,其中红色的点表示 MH 组对于 IMH 组明显上调的物质,蓝色点则表示明显下调的物质,灰色点表示两组无显著差异的物质。进一步通过主成分分析对两组蜂蜜进行判别分析,结果见图2-3。PC1、PC2分别解释释总变量的60.29%和7.7%,共占总变量的67.99%。主成分分析结果表明两组数据分布区域可以明显区分, IMH 组主要集中在 PC1的正半轴,而MH 组主要集中分布在 PC1 的负半轴。 近年来,代谢组学数据分析技术已广泛应用于生物样品的代谢物分析。传统的代谢组学分析主要通过色谱图中明显可见的色谱峰或者手动提取谱图进行分析,这样既耗时同时许多低表达的物质可能被忽视。本文中选用 Muss Profiler Professional (MPP)软件进行色谱数据的分析,可以更加准确、全面、快速地实现不同样品中的物质分析。基于 MPP 软件进行的代谢组数据分析已经成功地应用于药物审查和食品检验(DENERY et al.,2011;CIBOROWSKI et al., 2011; VAN DAMetal.,2018),并且在相关领域得到普遍认可,被认为是精确度高、灵敏度高的非靶标物质分析手段。本研究利用MPP 分析了来自3个蜂群的18个蜂蜜样品,利用UHPLC-Q-TOF/MS对所有采集到的化合物进行了准确的质量检测和表征,结合它们的丰度和保留时间,利用分子特征提取算法对这些化合物进行了全局性分析,并对这些物质进行了多变量统计分析以进行分类和预测。结果表明两种蜂蜜代谢物分布存在明显差异,通过主成分判别分析可以明显区分成熟油菜蜂蜜与未成熟油菜蜂蜜,经中药库 (Traditional Chinese Medicines , TCM) 信息比对后发现 IMH中含量更高的是一些植物糖苷、醇类、植物碱、有机酸等, MH 组则含有更多的酚类物质、糠醛等。本文通过对两种油菜蜂蜜代谢物的全局性分析,结果表明不同成熟度蜂蜜代谢物种类差异显著,这预示着通过非靶向代谢物分析区分成熟油菜蜂蜜和未成熟油菜蜂蜜的方法切实可行。 图2-1MH与IMH 非靶向代谢物分布 Venn 图 Figure 2-1 Venn diagram of untargeted metabolites analysis of MH and IMH 图2-2MH对 IMH非靶向代谢物分布火山图(P<0.05) Figure 2-2 A volcanic map of untargeted metabolites analysis of MH vs IMH(P<0.05) 注:图中每个点代表一个代谢物,散点颜色代表最终的筛选结果,红色表示MHvs IMH 显著上调的物质,蓝色表示 MHvs IMH 显著下调的物质,灰色表示两者间没有显著差异的物质 图2-3MH 与 IMH非靶标代谢物分布主成分分析图 Figure 2-3 PCA scores plot of untargeted metabolites analysis of MH and IMH 2.3.3 基于 UHPLC-Q-TOF/MS的靶标代谢物分析 基于两种成熟度油菜蜂蜜非靶标代谢物质的差异,本试验采用超高效液相色谱-四级杆飞行时间质谱联用技术(UHPLC-Q-TOF/MS)对封盖成熟油菜蜂蜜和未成熟油菜蜂蜜进行靶标物分析, 主要针对蜂蜜中的酚类物质进行分析。通过保留时间、负离子质量数、质谱碎片离子等信息与标准品进行匹配,结果共定性到20种物质,总离离流图见图2-4。并采用外标法对此20种物质进行相对定量,定量结果见表2-3及图2-5。与 IMH组相比,MH组中有18个显著上调的物质,其中山柰酚、芹菜素、松属素、3,4-二甲氧基肉桂酸、柯因(白杨素)、咖啡酸苯乙基酯6个物质仅在MH中被检出。有2个显著下调的物质为香草酸和丁香酸。以上结果表明,不同成熟度的油菜蜂蜜物质含量及种类均存在显著差异。 图2-4蜂蜜提取物在 HPLC-Q-TOF/MS负离子模式下的总离子流图 Figure 2-4 Total ion chromatography of honey extracts with negative scanning mode in HPLC-Q-TOF/MS 表2-3MH与IMH中主要酚类物质的 UHPLC-Q-TOF/MS分析 Table 2-3 UHPLC-Q-TOF/MS analysis of major phenolic compounds and relative occurrence in MH and IMH 0.039 纷酸类化合物 英文名 分子式 M M-H RT/min ug/100gMH pg/100gIMH LOD ug/100g R2 原儿茶酸 3,4-Dihydroxybenzoic acid C7H6O4 154.12 153.0193 4.596 7.20±0.05 3.05±0.05 0.025 0.999 绿原酸 Chlorogenic acid C16H18O9 354.31 353.0878 5.510 11.70±0.20a 4.80±0.09 0.006 0.990 咖啡酸 Caffeic acid C9H8O4 180.16 179.0350 6.035 22.86±0.88 5.37±0.05 0.023 0.992 香草酸 Vanillic acid C8H8O4 168.15 167.0350 5.950 51.17±0.58 60.10±0.25 0.250 0.995 丁香酸 Syringic acid C9H10Os 198.17 197.0455 6.169 6.81±0.04 14.68±0.12a 0.147 0.990 p-香豆酸 p-Coumaric acid C9H8O3 164.16 163.0401 6.804 9.51±0.52a 1.38±0.04 0.013 0.990 阿魏酸 Ferulic Acid C10H10O4 194.18 193.0506 6.950 19.84±1.10 4.36±0.13 0.043 0.998 短叶松素三乙酸脂 3-O-Acetylpinobanksin C17H14O6 314.00 313.0718 11.561 13.53±0.40 0.38±0.01 0.008 0.994 槲皮素 Quercetin C15H10O7 302.24 301.0354 8.743 134.16±2.41a 58.94±0.63 0.057 0.991 橙皮素 Hesperitin C16H14O6 302.28 301.0718 8.939 158.09±2.89a 76.32±0.83 0.012 0.991 短叶松素 Pinobanksin C15H12O5 272.25 271.0612 8.928 25.74±0.20° 0.84±0.01 0.027 0.993 柚皮素 Naringenin C15H12O5 272.25 271.0612 9.098 23.39±0.33a 0.88±0.01 0.027 0.993 高良姜素 Galangin C15H10O5 270.24 269.0455 9.122 8.42±0.24* 3.63±0.01 0.018 0.990 木樨草素 Luteolin C15H10O6 286.24 285.0405 9.952 67.32±1.09a 34.82±0.57 0.062 0.990 山柰酚 Kaempferol C15H10O6 286.24 285.0405 11.391 25.44±0.46 ND 0.078 0.998 芹菜素 Apigenin C15H10O5 270.24 269.0455 7.792 15.24±0.19 ND 0.039 0.993 松属素 Pinocembrin C15H12O4 256.25 255.0663 12.037 10.95±0.31 ND 0.036 0.992 3,4-二甲氧基肉桂酸 3-(3,4-Dimethoxyphenyl)- CuHi2O4 208.21 207.0663 12.184 19.60±0.23 ND 0.166 0.991 2-propenoic Acid 柯因(白杨素) Chrysin C15H10O4 254.24 253.0506 12.612 18.83±0.97 ND 0.011 0.998 表2-3(续) 酚酸类化合物 英文名 分子式 M M-H RT/min pg/100gMH ug/100gIMH LOD pg/100g R- 咖啡酸苯乙酯 Caffeic acid phenethyl ester C17H16O4 284.31 283.0976 9.793 12.89±0.26 ND 0.025 0.998 注:“ND”表示未检出;不同字母(a,b)表示在P<0.05水平上有显著差差 图2-5 MH与IMH中酚类物质的定量结果 Figure 2-5 Quantitative results of phenols in MH and IMH 注:*表示在0.01
确定













































还剩50页未读,是否继续阅读?
G.A.S.为您提供《油菜蜂蜜中成分组成及生物学活性比较研究检测方案(离子迁移谱仪)》,该方案主要用于蜂蜜中营养成分检测,参考标准--,《油菜蜂蜜中成分组成及生物学活性比较研究检测方案(离子迁移谱仪)》用到的仪器有G.A.S.FlavourSpec®气相离子迁移谱联用仪
该厂商其他方案
更多










