方案详情
文
盐胁迫对苜蓿营养品质及附着微生物群落的影响
方案详情

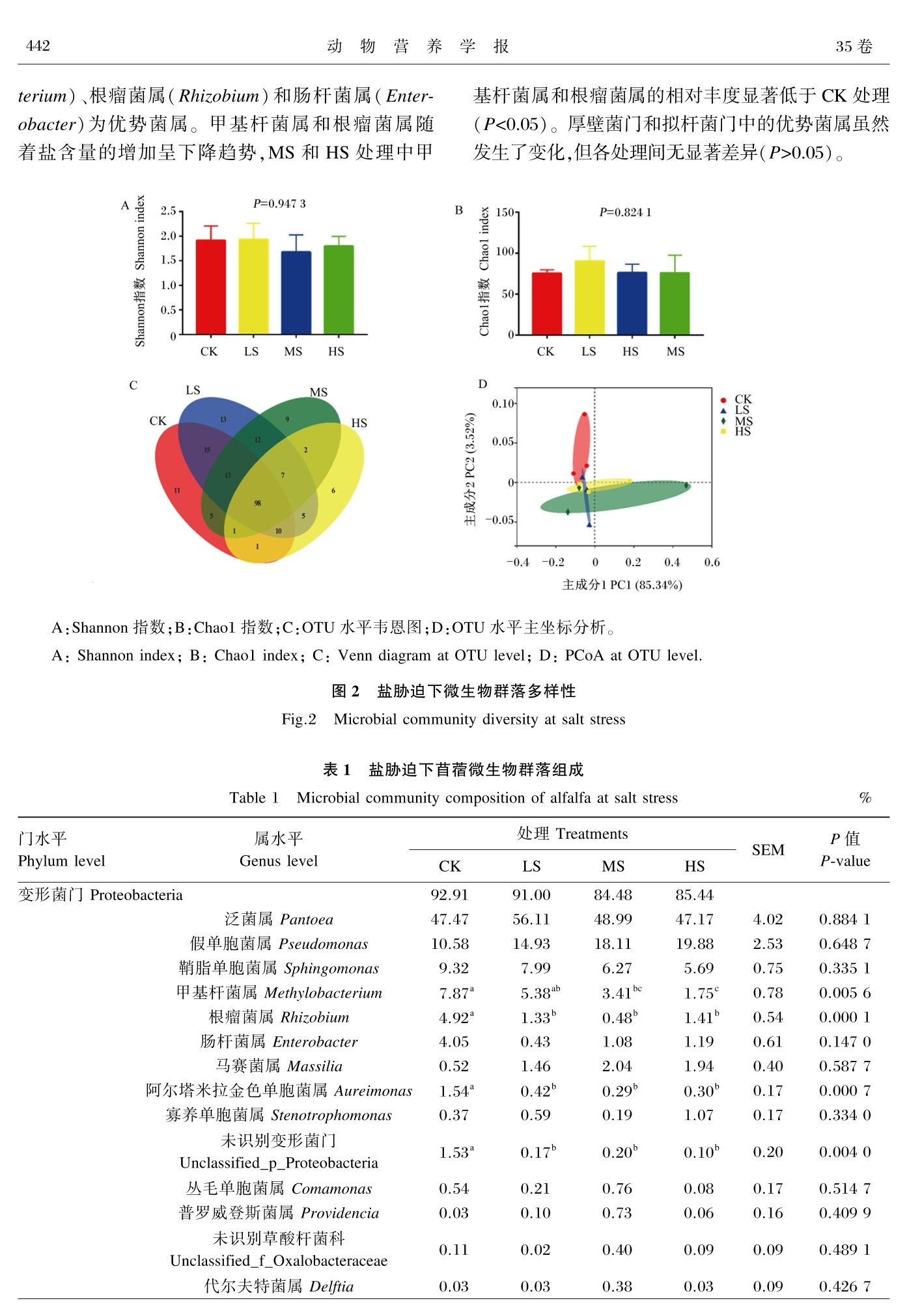
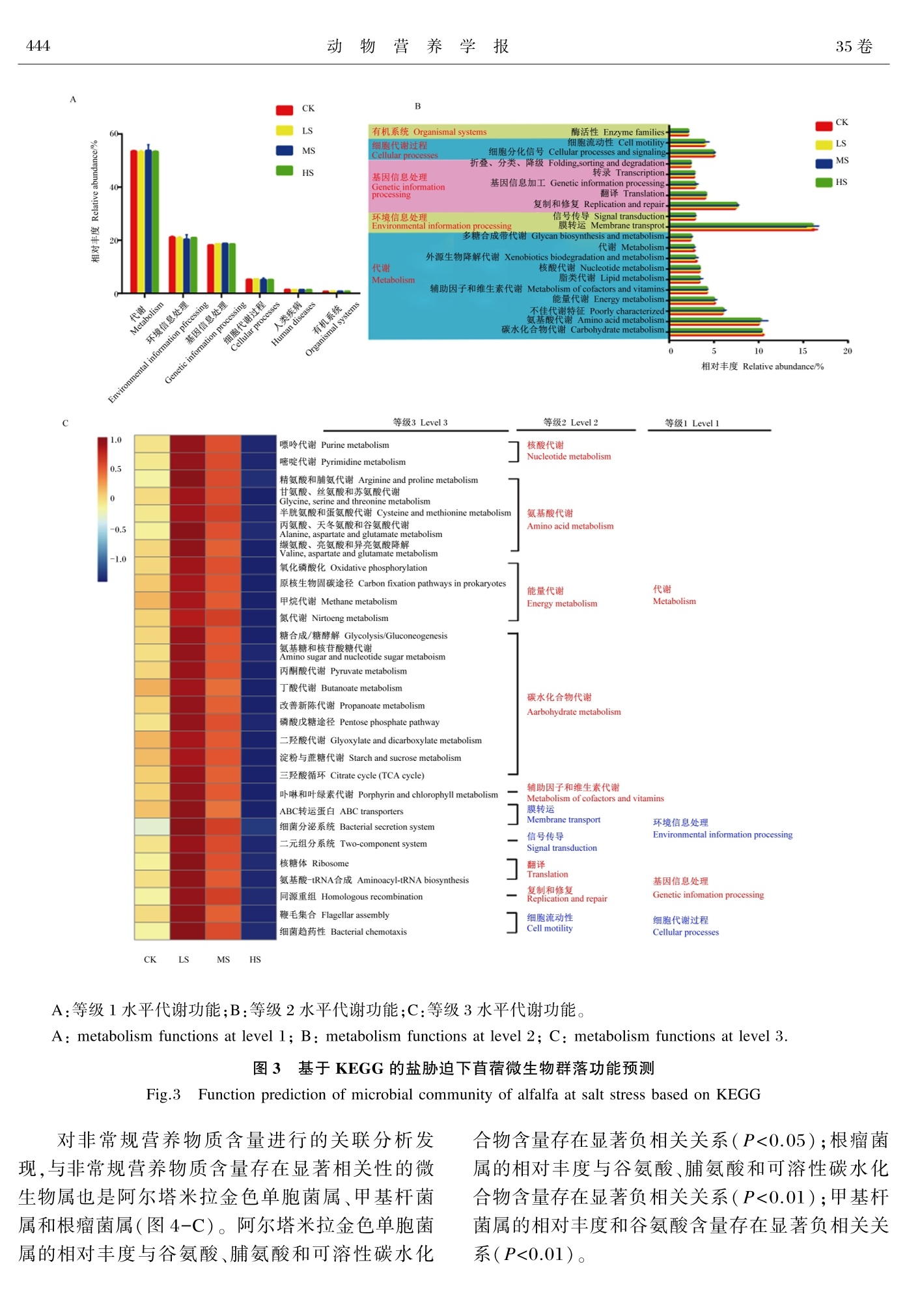
盐胁迫对苜蓿营养品质及附着微生物群落的影响动物营养学报2023,35(1):439⁃449Chinese Journal of Animal Nutritiondoi:10.3969/ j.issn.1006⁃267x.2023.01.043 动 物 营 养 学 报04435卷 盐胁迫对苜蓿营养品质及附着微生物群落的影响 常 春1,2 卢 强1 孙 林3 都 帅4 格根图1 尹 强2 贾玉山1∗ (1.内蒙古农业大学草原与资源环境学院,呼和浩特 010010;2.中国农业科学院草原研究所,呼和浩特 010010;3.内蒙古自治区农牧业科学院,呼和浩特 010010;4.浙江大学动物科学学院,杭州 310058) 摘 要:本试验旨在研究盐胁迫对苜蓿营养品质及附着微生物群落的影响。试验处理包括无 盐胁迫(盐含量<1‰,作为对照)、轻度盐胁迫(盐含量 1‰~2‰)、中度盐胁迫(盐含量 2‰~3‰)和重度盐胁迫(盐含量 3‰~4‰)。每个盐胁迫试验处理设置 3个小区,每个小区面积为 30 m2(5 m×6 m)。结果表明:中度盐胁迫下苜蓿酸性洗涤纤维和中性洗涤纤维含量显著低于其 他处理(P<0.05)。中度盐胁迫下苜蓿谷氨酸、脯氨酸、可溶性蛋白质、粗蛋白质和可溶性碳水化 合物含量与其他处理相比显著增加(P<0.05)。所有处理的 Shannon指数和 Chao1指数均无显 著差异(P>0.05)。主坐标分析(PCoA)显示盐胁迫未完全改变苜蓿表面附着微生物群落的结 构。所有处理下苜蓿门水平附着核心菌群为变形菌门(84.48%~92.91%)、放线菌门(4.30%~6.47%)、拟杆菌门(0.39%~10.59%)和厚壁菌门(0.61%~3.02%),属水平附着核心菌群为泛菌 属(47.17%~56.11%)、假单胞菌属(10.58%~19.88%)、鞘脂单胞菌属(5.69%~9.32%)、甲基 杆菌属(1.75%~7.87%)、根瘤菌属(0.48%~4.92%)和肠杆菌属(0.43%~4.05%)。随着盐胁迫 的增强,甲基杆菌属和根瘤菌属的相对丰度降低,中度盐胁迫和重度盐胁迫处理显著低于无盐 胁迫处理(P<0.05)。基于 KEGG的微生物群落功能预测表明,微生物功能主要集中在碳水化 合物代谢、氨基酸代谢、能量代谢和核酸代谢上,其中碳水化合物代谢是主要的代谢方式。相关 性分析表明,根瘤菌属的相对丰度与酸性洗涤纤维、木质素和中性洗涤纤维含量呈显著正相关 关系(P<0.001,P<0.01,P<0.05),与粗蛋白质、谷氨酸、脯氨酸和可溶性碳水化合物含量呈显著 负相关关系(P<0.01);甲基杆菌属的相对丰度与酸性洗涤纤维和木质素含量呈显著正相关关系 (P<0.01,P<0.05),与谷氨酸含量呈显著负相关关系(P<0.01);盐胁迫与鞘脂单胞菌属的相对 丰度呈显著正相关关系(P<0.05),与甲基杆菌属的相对丰度呈显著负相关关系(P<0.05)。综 上可知,中度盐胁迫(盐含量2‰~3‰)能够提高苜蓿营养品质,改善附着的微生物群落中拟杆 菌门和厚壁菌门的相对丰度。 关键词:盐胁迫;苜蓿;营养品质;微生物群落 中图分类号:S816 文献标识码:A 文章编号:1006⁃267X(2023)01⁃0439⁃11 苜蓿(Medicago sativa L.)是多年生豆科牧 草,具有适应性强和营养丰富等特点,其蛋白质含 量高,素有“牧草之王”的美誉。生物胁迫和非生 物胁迫与苜蓿的生长发育密切相关,而盐胁迫是 影响苜蓿产量和营养品质的主要非生物胁迫因 素[1-2]。联合国粮食及农业组织报告指出全球盐 收稿日期:2022-06-27 基金项目:国家重点研发计划(2017YFD0502103⁃3);国家牧草产业技术体系鄂尔多斯综合试验站(CARS⁃34);中央级公益性科研院所基本 科研业务费专项资金(1610332020016);内蒙河套地区盐碱地苜蓿加工调制技术集成与产业化示范项目(201802069);草产品加工利用关 键技术研发与产业化示范创新人才团队 作者简介:常 春(1984—),女,内蒙古呼和浩特人,助理研究员,博士研究生,从事牧草加工与利用研究。 E⁃mail: changchun@caas.cn ∗通信作者:贾玉山,教授,博士生导师,E⁃mail: jys nm@sina.com 碱地面积约为 9.55×109 hm2,而我国盐碱地面积 总计9.91×108 hm2,主要分布在我国东北、华北及 滨海等地[3]。种植苜蓿不仅能改良土壤盐渍化,还能提高土壤肥力,缓解我国优质牧草饲料短缺 和人畜争粮的问题[4-6]。因此,在盐碱地种植苜蓿 是盐渍化土壤改良、畜牧业健康发展和保障粮食 安全的必然趋势和重要研究方向。 苜蓿因较高的营养品质被广泛应用于畜牧 业,其中青贮是雨季等限制性环境下苜蓿贮藏利 用的主要方式之一[7-8]。青贮调制的机理是利用 以乳酸菌为主的微生物发酵,通过其生命代谢活 动产生有机酸,使青贮饲料得以保存[9-10],但青贮 发酵是多种微生物共同作用的过程,微生物的种 类和数量直接影响青贮品质[11]。目前,盐碱地苜 蓿微生物群落研究还鲜有报道。盐胁迫最直观的 体现是通过抑制光合作用和呼吸作用影响苜蓿产 量[1,12]。以氯化钠(NaCl)进行盐胁迫发现低浓度 盐胁迫对苜蓿生长无显著影响,而随着盐含量增 加苜蓿生长才会受到抑制,盐含量达到 400 mmol/L时苜蓿的生长发育基本停止[13]。此 外,也有研究发现轻度盐胁迫与中、高度盐胁迫相 比能够提高苜蓿产量,甚至优于无盐胁迫处理[14]。目前,有关苜蓿种子盐胁迫萌发条件的筛选、耐盐 基因的筛选与表达、盐胁迫对苜蓿生长发育的影 响已进行了诸多研究。也有研究发现,在盐碱环 境下,植物内生真菌与植物生长和内分泌密切相 关[15],例如,经假单胞菌处理后能增加植物体内脯 氨酸含量,增强植物抗氧化应激能力[16]。但盐胁 迫对苜蓿营养品质和微生物群落结构影响的研究 还存在空白。因此,本试验拟开展盐胁迫对苜蓿 营养品质及其附着微生物群落结构影响的研究,从营养物质组成和微生物群落角度探讨苜蓿适应 盐胁迫的规律,为盐渍化地区苜蓿种植和青贮利 用提供理论依据和技术支撑。 1 材料与方法 1.1 试验地概况 试验地位于包头市鑫泰农业试验基地,地处 内蒙古包头市九原区哈林格尔镇,位于黄河“几字 弯”,东经 110° 27″ ~ 110° 37″,北纬 40° 05″ ~40°17″,属典型盐渍化区域,该区域土壤盐含量呈 梯度分布(<1‰、1‰ ~ 2‰、2‰ ~ 3‰和 3‰ ~4‰)。盐含量大于 1‰的土壤 pH为 8.44~8.73, 无明显差异。试验区气候为北温带大陆气候,雨 热同期,年平均气温为 6.8 ℃,年平均降雨量约为 330 mm,多集中在6~9月。 1.2 试验材料与试验设计 本研究以“中苜 3号”苜蓿为试验材料,苜蓿 种子由中国农业科学院北京畜牧兽医研究所提 供。紫花苜蓿于2020年 5月播种,播种方式为条 播,行距10 cm。试验地盐含量分别为<1‰(无盐 胁迫,CK处理)、1‰~ 2‰(轻度盐胁迫,LS处 理)、2‰~3‰(中度盐胁迫,MS处理)和3‰~4‰(重度盐胁迫,HS处理)。每个盐胁迫处理设置 3个小区,每个小区面积为30 m2(5 m×6 m)。所用 试验材料为2021年第 1茬初花期刈割苜蓿,来源 于不同盐含量试验地,留茬高度为5~8 cm。 1.3 测定指标及方法 1.3.1 营养指标测定 新鲜苜蓿刈割后取样品 500 g于 105 ℃杀青 15 min,在65 ℃下烘至恒重,计算干物质(dry mat⁃ter,DM)含量,粉碎后保存备测。粗蛋白质( crude protein,CP)含量使用杜马斯燃烧法测定[17]。中性 洗涤纤维(neutral detergent fiber,NDF)和酸性洗 涤纤维( acid detergent fiber,ADF)含量使用 Van Soest等[18]的方法测定。可溶性碳水化合物(wa⁃ter⁃soluble carbohydrates,WSC)含量使用蒽酮-硫 酸比色法[19]测定。可溶性蛋白质( soluble protein,SP)含量采用三氯乙酸法[20]进行测定。采用 GB/T 18246—2000《饲料中氨基酸的测定》方法 测定脯氨酸和谷氨酸含量。 1.3.2 微生物多样性分析 取5 g苜蓿样品与 45 mL无菌蒸馏水于拍打 袋,无菌匀质器 12次 / s拍打 2 min,转移至无菌 50 mL离心管,每个样品 3个重复,-80 ℃保存备 用。根据 E.Z.N.A.®soil DNA kit说明书进行微 生物群落总 DNA提取。使用1%的琼脂糖凝胶电 泳检测提取的 DNA的质量,使用 NanoDrop 2000测定 DNA浓度和纯度。对 16S rRNA基因 V3~V4可变区进行 PCR扩增,扩增产物4 ℃保存。使 用引物 338F (5′ - ACTCCTACGGGAGGCAGC AG-3′)和 806R (5′ - GGACTACHVGG GT⁃WTCTAAT-3′)对16S rRNA基因V3~V4可变区 进行 PCR扩增,PCR扩增引物由上海美吉生物医 药科技有限公司合成。 PCR反应体系包括:5×TransStartFastPfu缓冲液 4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L) 0.8 μL,下游引物 (5 μmol/L) 0.8 μL,TransStartFastPfu DNA聚合 酶0.4 μL,模板DNA 10 ng,超纯水补足至20 μL。每个样本3个重复。 PCR扩增程序为:95 ℃预变 性3 min,95 ℃变性 30 s,55 ℃退火 30 s,72 ℃延 伸30 s,72 ℃稳定延伸 10 min,27个循环。使用 2%琼脂糖凝胶回收 PCR产物,并用 AxyPrep DNA Gel Extraction Kit进行纯化。使用2%琼脂糖凝胶 电泳进行检测,并用 QuantusTM Fluorometer对回收 产物进行检测定量。使用 NEXTFLEX® Rapid DNA⁃Seq Kit进行建库,利用Illumina公司的 MiSeq PE300平台进行测序。 1.4 数据处理与分析 使用 Fastq对原始测序序列进行质控,并使用 Flash进行拼接;使用 Uparse以97%的相似度阈值 对序列进行操作分类单元(OTU)聚类,同时剔除 嵌合体;基于 Silva 16S rRNA数据库(v138),利用 RDP对 OTU代表序列进行物种分类学注释并得 到结果;通过距离量化分析样本间群落结构差异,计算样本间距离获得距离矩阵,使用主坐标分析 (PCoA)结合ANOSIM进行组间差异检验,评估群 落结构的差异性;基于物种注释结果,使用韦恩图 对各处理中微生物物种组成进行解析,单因素方 差分析获得优势微生物组成信息;使用 R version 3.6.3对盐胁迫、微生物及营养指标进行斯皮尔曼 相关性计算,并绘制相关性热图。使用 Excel 2007对试验数据进行初步整理和前期处理。使用 Sig⁃maPlot 12.5进行相关图表的绘制。使用 Adobe Il⁃lustrator CS6进行相关图片的整理。使用 SAS 9.0进行方差分析。 2 结果与分析 2.1 盐胁迫对苜蓿营养物质组成的影响 苜蓿营养物质组成在盐胁迫下表现出复杂的 变化规律。从图 1可以看出,根据盐含量聚类分 析出现了3种聚类方式,即CK、LS处理和HS、MS 处理;按营养物质划分为 2类,即纤维类和其他类 营养物质。 MS处理酸性洗涤纤维和中性洗涤纤 维含量显著低于其他处理(P<0.05);MS处理木 质素含量显著低于 CK处理(P<0.05),与 LS和 HS处理无显著差异(P>0.05)。 MS处理谷氨酸、脯氨酸、可溶性蛋白质、粗蛋白质和可溶性碳水化 合物含量与其他处理相比显著增加(P<0.05),且 均以 CK处理最低。各处理脂肪酸含量无显著差 异(P>0.05)。 1.0 0.5 -0.5 -1.0 同行数据框标注不同字母表示在 0.05水平差异显著 (P<0.05)。 Data frame in the same row with different lowercaselet⁃tersindicate significant difference at 0.05 level (P<0.05) . 图1 盐胁迫下苜蓿营养物质组成 Fig.1 Nutritive substance composition of alfalfa at salt stress 2.2 盐胁迫苜蓿微生物群落多样性分析 盐胁迫下苜蓿表面附着的微生物群落多样性 如图2所示。所有处理的微生物群落多样性指数 (Shannon指数,图 2-A)和丰富度指数(Chao1指 数,图 2-B)均无显著差异(P>0.05)。韦恩图 (图2-C)显示 CK、LS、MS和 HS处理共有的 OTU有98个,特有的 OTU数分别为 11、13、9和 6个,表明不同程度盐胁迫改变了苜蓿表面附着的 微生物群落结构。为深入研究各处理微生物群落 的差异进行 PCoA,PCoA图显示盐胁迫未完全改 变其微生物群落结构。 2.3 盐胁迫微生物群落组成分析 物种分类信息的差异说明了微生物群落结构 的变化对盐胁迫的响应。由表 1可知,在门水平 上,主要为变形菌门(Proteobacteria)、放线菌门 (Actinobacteria)、厚壁菌门(Firmicutes)和拟杆菌 门(Bacteroidetes)。变形菌门为所有处理中的优 势菌门,相对丰度均超过了 80%,其次是放线菌 门、厚壁菌门和拟杆菌门,有趣的是厚壁菌门的相 对丰度在 MS和 HS处理增加。在属水平上,泛菌 属(Pantoea)、假单胞菌属(Pseudomonas)、鞘脂单 胞菌属(Sphingomonas)、甲基杆菌属(Methylobac⁃ terium)、根瘤菌属(Rhizobium)和肠杆菌属(Enter⁃obacter)为优势菌属。甲基杆菌属和根瘤菌属随 着盐含量的增加呈下降趋势,MS和 HS处理中甲 基杆菌属和根瘤菌属的相对丰度显著低于CK处理 (P<0.05)。厚壁菌门和拟杆菌门中的优势菌属虽然 发生了变化,但各处理间无显著差异(P>0.05)。 主成分1 PC1 (85.34%) A:Shannon指数;B:Chao1指数;C:OTU水平韦恩图;D:OTU水平主坐标分析。 A: Shannon index; B: Chao1 index; C: Venn diagram at OTU level; D: PCoA at OTU level. 图2 盐胁迫下微生物群落多样性 Fig.2 Microbial community diversity at salt stress 表1 盐胁迫下苜蓿微生物群落组成 Table 1 Microbial community composition of alfalfaat salt stress % 门水平 Phylum level 属水平 Genus level 处理 Treatments SEM P值 P⁃value CK LS MS HS 变形菌门 Proteobacteria 92.91 91.00 84.48 85.44 泛菌属 Pantoea 47.47 56.11 48.99 47.17 4.02 0.884 1 假单胞菌属 Pseudomonas 10.58 14.93 18.11 19.88 2.53 0.648 7 鞘脂单胞菌属 Sphingomonas 9.32 7.99 6.27 5.69 0.75 0.335 1 甲基杆菌属 Methylobacterium 7.87a 5.38ab 3.41bc 1.75c 0.78 0.005 6 根瘤菌属 Rhizobium 4.92a 1.33b 0.48b 1.41b 0.54 0.000 1 肠杆菌属 Enterobacter 4.05 0.43 1.08 1.19 0.61 0.147 0 马赛菌属 Massilia 0.52 1.46 2.04 1.94 0.40 0.587 7 阿尔塔米拉金色单胞菌属 Aureimonas 1.54a 0.42b 0.29b 0.30b 0.17 0.000 7 寡养单胞菌属 Stenotrophomonas 0.37 0.59 0.19 1.07 0.17 0.334 0 未识别变形菌门 1.53a 0.17b 0.20b 0.10b 0.20 0.004 0 Unclassified p Proteobacteria 0.21 0.76 0.17 0.514 7 丛毛单胞菌属 Comamonas 0.54 0.10 0.73 0.08 0.16 0.409 9 未识别草酸杆菌科 Unclassified f Oxalobacteraceae 0.11 0.02 0.40 0.09 0.09 0.489 1 代尔夫特菌属 Delftia 0.03 0.03 0.38 0.03 0.09 0.426 7 续表1 门水平 属水平 处理 Treatments SEM P值 Phylum level Genus level CK LS MS HS P⁃value 拟杆菌门 Bacteroidetes 0.39 0.67 10.59 6.12 金黄色杆菌属 Chryseobacterium 0.23 0.12 9.27 0.03 2.29 0.442 8 网络鞘氨醇杆菌属 Sphingobacterium 0.06 0.27 1.28 2.65 0.47 0.187 2 厚壁菌门 Firmicutes 黄杆菌属 Flavobacterium 0.05 0.17 0.03 3.29 0.79 0.419 5 0.74 1.84 0.61 3.02 微小杆菌属 Exiguobacterium 0.57 1.07 0.09 1.26 0.28 0.495 3 芽孢杆菌属 Bacillus 0.01 0.18 0.03 1.34 0.31 0.411 3 放线菌门 Actinobacteria 5.94 6.47 4.30 5.34 短小杆菌属 Curtobacterium 1.35b 3.22a 1.97ab 1.36b 0.32 0.007 9 微杆菌属 Microbacterium 1.87 0.96 0.95 1.97 0.24 0.255 1 其他 Others 其他 Others 6.96a 4.80ab 2.74b 4.97ab 0.53 0.013 3 同行数据肩标不同小写字母表示0.05水平差异显著(P<0.05)。 Values in the same row with different lowercaselettersindicate significant difference at 0.05 level (P<0.05) . 2.4 盐胁迫苜蓿附着微生物群落功能分析 基于 KEGG的微生物群落结构变化进行 PICRUSt功能预测分析,结果如图 3所示。在等 级1水平代谢功能分为 6类,包括代谢、环境信息 处理、基因信息处理、细胞代谢过程、人类疾病和 有机系统(图 3-A)。在此基础上对功能进行细 化,如图3-B所示,代谢主要富集在碳水化合物代 谢和氨基酸代谢,环境信息处理集中在膜转运,基 因信息处理集中在复制和修复。为深入了解微生 物参与的代谢功能,在等级 2水平上继续细化,在 等级3水平上排名前 30的代谢功能如图 3-C所 示,代谢主要富集在核酸代谢、氨基酸代谢、能量 代谢和碳水化合物代谢。排名前 30的代谢功能 所占代谢途径达22条,碳水化合物代谢仍是代谢 的主要方式。从图 3-C中可以发现,代谢能力从 CK处理到 LS处理呈升高的趋势,随着盐含量继 续增加,代谢能力呈现持续下降的变化趋势,在轻 度盐胁迫(LS处理)时代谢能力达到峰值。 2.5 盐胁迫苜蓿附着微生物与多重营养指标关联 分析 盐胁迫与微生物组成密切相关,关联分析显 示盐含量与鞘脂单胞菌属的相对丰度呈显著正相 关关系(P<0.05),与甲基杆菌属、阿尔塔米拉金色 单胞菌属、丛毛单胞菌属和金黄色杆菌属的相对 丰度呈显著负相关关系(P<0.001,P<0.01)(图4-A)。 微生物群落结构与营养品质的形成密切相 关[21],本试验基于斯皮尔曼相关性分析揭示了盐 胁迫下主要微生物属的相对丰度(前25)与营养物 质含量的相关关系。常规营养物质含量与微生物 属相对丰度的相关关系如图 4-B所示(图中只显 示存在显著相关性的微生物属),阿尔塔米拉金色 单胞菌属、甲基杆菌属、微杆菌属和根瘤菌属的相 对丰度均与干物质含量无显著相关关系(P>0.05);阿尔塔米拉金色单胞菌属的相对丰度与酸 性洗涤纤维和木质素含量呈显著正相关关系(P<0.001,P<0.05),与粗蛋白质含量呈显著负相关关 系(P<0.05);甲基杆菌属的相对丰度只与酸性洗 涤纤维和木质素含量呈显著正相关关系(P<0.01,P<0.05);而微杆菌属的相对丰度与木质素含量呈 显著正相关关系(P<0.05),与粗蛋白质含量呈显 著负相关关系(P<0.05);根瘤菌属的相对丰度与 酸性洗涤纤维、木质素和中性洗涤纤维含量呈显 著正相关关系(P<0.001,P<0.01,P<0.05),与粗 蛋白质含量呈显著负相关关系(P<0.01)。 C A:等级l水平代谢功能;B:等级2水平代谢功能;C:等级3水平代谢功能。 A: metabolism functions at level 1; B: metabolism functions at level 2; C: metabolism functions at level 3.图3 基于 KEGG 的盐胁迫下苜蓿微生物群落功能预测 Fig.3 Function prediction of microbial community of alfalfa at salt stress based on KEGG 对非常规营养物质含量进行的关联分析发 现,与非常规营养物质含量存在显著相关性的微 生物属也是阿尔塔米拉金色单胞菌属、甲基杆菌 属和根瘤菌属(图4-C)。阿尔塔米拉金色单胞菌 属的相对丰度与谷氨酸、脯氨酸和可溶性碳水化 合物含量存在显著负相关关系(P<0.05);根瘤菌 属的相对丰度与谷氨酸、脯氨酸和可溶性碳水化 合物含量存在显著负相关关系(P<0.01);甲基杆 菌属的相对丰度和谷氨酸含量存在显著负相关关 系(P<0.0l)。 0.5 0 -0.5 A:盐胁迫和前25个微生物属的相关性;B:前25个微生物属与常规营养物质的相关性;C:前25个微生物属与非常规 营养物质的相关性。图中只显示存在显著相关性的微生物属。 ∗:P<0.05;∗∗:P<0.01;∗∗∗:P<0.001。 A: correlation between salt stress and microbial genus ( top 25); B: correlation between microbial genus ( top 25) and con⁃ventional nutritive substances; C: correlation between microbial genus ( top 25) and unconventional nutritive substances. Only with significant difference of the genera were noted. ∗: P<0.05; ∗∗: P<0.01; ∗∗∗: P<0.001. 图4 盐胁迫下关联分析 Fig.4 Correlation analysis at salt stress 3 讨 论 植物光合作用与其生长发育紧密相关,而盐 胁迫会限制光合作用直接影响其生长发育[12]。盐 胁迫的增强使土壤水势下降,导致植物生理干旱,引起渗透胁迫[22]。植物为应对盐胁迫引起的渗透 胁迫做出防御,体内脯氨酸和可溶性碳水化合物 的含量增加[23],降低植物体内束缚水和自由水的 比例,保证体内水分的转运[24]。此外,脯氨酸和谷 氨酸含量的增加有利于缓解植物的氧化应激,增 强对盐胁迫环境的适应能力[25-26]。氨基酸的增加 促进了蛋白质和可溶性蛋白质的积累,但盐胁迫 超过植物可以承受的阈值时则会出现负效应。因 此,在本研究中,随着盐含量的增加,脯氨酸、谷氨 酸、可溶性碳水化合物、蛋白质和可溶性蛋白质的 含量呈梯度变化,且在中度盐胁迫下达到最大值。 有研究发现,苜蓿中纤维类物质含量与盐胁迫没 有显著相关性[27]。本研究与上述研究结果存在差 异,盐胁迫与纤维类物质(酸性洗涤纤维、中性洗 涤纤维和木质素)含量密切相关。盐胁迫限制光 合作用影响糖类物质合成进而影响细胞的分化和 细胞壁组成可能是导致该结果的原因之一。 微生物群落结构的组成与宿主生长发育、健 康状况和免疫防御密切相关。在本研究中,在不 同盐胁迫条件下微生物群落的多样性和丰富度均 无显著差异,且韦恩图显示共有的和特有的 OTU 变化较小,PCoA表明盐胁迫未完全改变其微生物 群落结构。为深入了解微生物群落结构和组成的 变化,本研究在门水平和属水平对主要微生物群 落组成进行了分析。变形菌门是苜蓿中最主要的 菌门,所有处理该菌门的相对丰度均超过了 80%,其次是厚壁菌门、拟杆菌门和放线菌门。在属水 平上各种微生物属所占比例虽然发生了变化,但 起主导作用的微生物属,如泛菌属和假单胞菌属,在不同盐胁迫条件下微生物群落的多样性和丰富 度无显著差异。本研究结果显示,随着盐含量的 增加,甲基杆菌属和根瘤菌属的相对丰度呈降低 趋势,这可能是由于甲基杆菌属对盐胁迫敏 感[28-29],且盐胁迫能够抑制根瘤菌属的生命代谢 活动[30]。 微生物群落结构的变化常导致其代谢功能发 生改变。在等级 1水平的主要代谢功能是代谢、环境信息处理和基因信息处理。代谢功能在等 级2水平主要表现在碳水化合物代谢和氨基酸代 谢,碳水化合物代谢和氨基酸代谢所对应的代谢 通路在等级 3水平上表现出明显的差异,进一步 表明蛋白质、氨基酸、可溶性碳水化合物和纤维类 物质的差异。另外,环境信息处理主要集中在膜 转运所对应的代谢通路,可能影响细胞壁的合成,导致纤维类物质出现差异。脂肪酸能够有效抵御 非生物胁迫对植物带来的不良影响[31],而本研究 中脂肪酸含量在不同程度盐胁迫下均无显著差 异,微生物群落功能的变化未导致脂肪酸相关代 谢出现变化可能是导致该结果的主要原因。在上 述基础上对主要营养物质和差异微生物进行了关 联分析,发现差异微生物与营养品质密切相关。甲基杆菌属和根瘤菌属的相对丰度与纤维类物质 含量表现出强正相关关系,但还未见甲基杆菌属 和根瘤菌属与纤维类物质互作的报道。根瘤菌属 的相对丰度与谷氨酸、脯氨酸和粗蛋白质含量呈 显著负相关关系,根瘤菌可利用周围氮素进行固 氮,促进自身生长繁殖[32],这可能是导致该结果的 主要原因。 4 结 论 本研究将苜蓿常规营养指标与高通量测序技 术相结合探讨盐胁迫对苜蓿营养品质及其附着微 生物群落结构的影响,发现盐胁迫未完全改变苜 蓿的营养品质和附着的微生物群落结构;盐胁迫 与鞘脂单胞菌属的相对丰度呈显著正相关关系,与甲基杆菌属的相对丰度呈显著负相关关系;中 度盐胁迫(盐含量2‰~3‰)能够提高苜蓿营养品 质,改善附着的微生物群落中拟杆菌门和厚壁菌 门的相对丰度。 参考文献: [ 1] 马亚珺,杨国柱,童永尚,等.干旱和盐胁迫对紫花苜 蓿生理特性及品质的影响[ J] .饲料研究,2021,44(23):106-109.MA Y J,YANG G Z,TONG Y S, et al. Effect of drought and salt stress on endogenous osmotic sub⁃stances of alfalfa[ J] .Feed Research,2021,44(23):106-109.( in Chinese) [ 2] RAJENDRAN K,TESTER M,ROY S J.Quantifying the three main components of salinity tolerance in ce⁃reals[ J] .Plant Cell and Environment,2009,32(3):237-249. [ 3] 欧阳竹,王竑晟,来剑斌,等.黄河三角洲农业高质量 发展新模式[ J] .中国科学院院刊,2020,35(2):145-153. OUYANG Z,WANG H S,LAI J B, et al.New ap⁃proach of high⁃quality agricultural development in the yellow river delta[ J] .Bulletin of the Chinese Acade⁃my of Sciences,2020,35(2):145-153.( in Chinese) [ 4] 郑敏娜,梁秀芝,李荫藩,等.晋北盐碱区不同种植年 限人工紫花苜蓿草地土壤质量的评价[ J] .草地学 报,2017,25(4):888-892. ZHENG M N,LIANG X Z,LI Y F,etal.Assessment of soil quality of alfalfa field with different growing years in the saline alkali area of northern Shanxi Prov⁃ince[ J] .Acta Agrestia Sinica,2017,25(4):888-892. ( in Chinese) [ 5] 王彦龙,俞旸,张春平,等.种植紫花苜蓿对柴达木盆 地高寒荒漠区弃耕地盐碱土壤的改良作用[ J] .青 海畜牧兽医杂志,2020,50(5):22-26. WANG Y L,YU Y,ZHANG C P,et al.Effect of al⁃falfa on amendment of saline⁃alkaline soil on aban⁃doned farmland in Qaidam Basin[ J] .Chinese Qinghai Journal of Animal and Veterinary Sciences,2020,50(5):22-26.( in Chinese) [ 6] 朱寒冰,金璟.粮食安全视角下苜蓿饲草产业发展实 证分析[ J] .畜牧与饲料科学,2022,43(4):73-79. ZHU H B,JIN J.An empirical analysis on the devel⁃opment of alfalfaforage industry from the perspective of grain security[ J] .Animal Husbandry and Feed Sci⁃ence,2022,43(4):73-79.( in Chinese) [ 7] YOU S H,DU S,GE G T,et al.Microbial community and fermentation characteristics of native grass pre⁃pared without or with isolated lactic acid bacteria on the Mongolian Plateau[ J] .Frontiersin Microbiology,2021,12:731770. [ 8] 张欢,牟怡晓,张桂杰.添加枸杞副产物对紫花苜蓿 青贮发酵品质及微生物多样性的影响[ J] .草业学 报,2022,31(4):136-144. ZHANG H,MU Y X,ZHANG G J.Effects of Lycium barbarum by⁃products on fermentation quality and mi⁃crobial diversity of alfalfa silage[ J] .Acta Pratacultu⁃rae Sinica,2022,31(4):136-144.( in Chinese) [ 9] GOLLOP N,ZAKIN V,WEINBERG Z G.Antibacte⁃rialactivity of lactic acid bacteria included in inocu⁃lants for silage and in silages treated with these inocu⁃lants[ J] . Journal of Applied Microbiology,2005,98(3):662-666. [10] BAAH J,MCALLISTER T A,BOS L,et al.Effect of Lactobacillus buchneri 40788 and buffered propionic acid on preservation and nutritive value of alfalfaand timothy high⁃moisture hay [ J] . Asian⁃Australasian Journal of Animal Sciences,2005,18(5):649-660. [11] 杨云贵,张越利,杜欣,等.2种玉米青贮饲料青贮过 程中主要微生物的变化规律研究[ J] .畜牧兽医学 报,2012,43(3):397-403. YANG Y G,ZHANG Y L,DU X,etal.Study on the major microorganism changes during the silage pro⁃cessing of two kinds of corn silage[ J] .Acta Veterinar⁃ia et Zootechnica Sinica,2012,43(3):397-403.( in Chinese) [12] 刘铎,白爽,杨庆山,等.紫花苜蓿 (Medicago sativa L.)耐盐碱研究进展[ J] .生物学杂志,2021,38(1):98-101,105. LIU D,BAI S,YANG Q S,et al.A review on the sa⁃line⁃alkaline tolerance of alfalfa (Medicago sativa L.) [ J] .Journal of Biology,2021,38(1):98-101,105.( in Chinese) [13] LAN G Y,WU Z X,CHEN B Q,etal.Species diver⁃sity in a naturally managed rubber plantation in Hain⁃an Island,south China[ J] .Tropical Conservation Sci⁃ence,2017,10:1-7. [14] 于浩然,贾玉山,贾鹏飞,等.不同盐碱度对紫花苜蓿 产量及品质的影响[ J] .中国草地学报,2019,41(4):143-149.YU H R,JIA Y S,JIA P F,et al.Comprehensive eval⁃uation of growth,yield and quality of alfalfain differ⁃ent saline⁃alkali soil[ J] . Chinese Journal of Grass⁃land,2019,41(4):143-149.( in Chinese) [15] DÍAZ F J,GRATTAN S R,REYES J A,et al.Using saline soil and marginal quality water to produce alfal⁃fa in arid climates[ J] . Agricultural Water Manage⁃ment,2018,199:11-21. [16] PANDEY P K,YADAV S K,SINGH A,etal.Cross⁃species alleviation of biotic and abiotic stresses by the endophyte Pseudomonas aeruginosa PW09[ J] . Jour⁃nal of Phytopathology,2012,160(10):532-539. [17] AOAC.Official methods of analysis[M] .15th ed.Ar⁃tington:Association of Official Analytical Chemists,1990. [18] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutri⁃tion[ J] . Journal of Dairy Science,1991,74(10):3583-3597. [19] MURPHY R P.A method for the extraction of plant samples and the determination of total soluble carbo⁃hydrates[ J] .Journal of the Science of Food and Agri⁃culture,1958,9(11):714-717. [20] 杨胜.饲料分析及饲料质量检测技术[M] .北京:北 京农业大学出版社,1993.YANG S. Feed analysis and feed quality detection technology[M] .Beijing:Beijing Agricultural Univer⁃sity Press,1993.( in Chinese) [21] 撒多文.盐碱地紫花苜蓿刈割后营养品质变化特征 与真菌群落结构研究[D] .博士学位论文.呼和浩 特:内蒙古农业大学,2021:128. SA D W. Study on the characteristics of nutritional quality changes and fungal community structure of al⁃falfaafter cutting in saline⁃alkali soil[D] .Ph.D.The⁃sis. Hohhot: Inner Mongolia Agricultural University,2021:128.( in Chinese) [22] KATUWAL K B,XIAO B, JESPERSEN D.Physio⁃ logical responses and tolerance mechanisms of sea⁃shore paspalum and centipedegrass exposed to osmotic and iso⁃osmotic salt stresses[ J] .Journal of Plant Phys⁃iology,2020,248:153154. [23] 李源,刘贵波,高洪文,等.紫花苜蓿种质耐盐性综合 评价及盐胁迫下的生理反应[ J] .草业学报,2010,19(4):79-86. LI Y,LIU G B,GAO H W,et al.A comprehensive e⁃valuation of salt⁃tolerance and the physiological re⁃sponse of Medicago sativa at the seedling stage[ J] .Acta Prataculturae Sinica,2010,19(4):79-86.( in Chinese) [24] 张永锋,梁正伟,隋丽,等.盐碱胁迫对苗期紫花苜蓿 生理特性的影响[ J] .草业学报,2009,18(4):230-235. ZHANG Y F,LIANG Z W,SUI L, et al. Effect on physiological characteristic of Medicago sativa under saline⁃alkali stressatseeding stage[ J] .Acta Pratacul⁃turae Sinica,2009,18(4):230-235.( in Chinese) [25] DAS K,ROYCHOUDHURY A.Reactive oxygen spe⁃cies (ROS) and response of antioxidants as ROS⁃scavengers during environmental stress in plants[ J] .Frontiers in Environmental Science,2014,2:53. [26] SHARMA E,SHARMA R,BORAH P,et al.Emerging roles of auxin in abiotic stress responses[M] / / PAN⁃DEY G K. Elucidation of abiotic stress signaling in plants.New York:Springer,2015:299-328. [27] 桂枝,高建明,袁庆华.盐胁迫对紫花苜蓿品质的影 响[ J] .天津农学院学报,2008,15(2):7-10.GUI Z,GAO J M,YUAN Q H.Study on quality char⁃ acters of several alfalfa varietiesin different saltstres⁃ses[ J] . Journal of Tianjin Agricultural College,2008,15(2):7-10.( in Chinese) [28] LEE Y,KRISHNAMOORTHY R,SELVAKUMAR G,et al.Alleviation of salt stress in maize plant by co⁃inoculation of arbuscular mycorrhizal fungi and Methy⁃lobacterium oryzae CBMB20[ J] .Journal of the Kore⁃an Society for Applied Biological Chemistry,2015,58(4):533-540. [29] MUNNS R,TESTER M.Mechanisms of salinity toler⁃ance[ J] .Annual Review of Plant Biology,2008,59:651-681. [30] AHMAD M,ZAHIR Z A,KHALID M,etal.Efficacy of rhizobium and pseudomonas strains to improve physiology, ionic balance and quality of mung bean under salt⁃affected conditions on farmer’ s fields[ J] .Plant Physiology and Biochemistry,2013,63:170-176. [31] CONSTANTINO N N,MASTOURI F,DAMARWI⁃NASIS R,et al.Root⁃expressed maize lipoxygenase 3negatively regulates induced systemic resistance to Colletotrichum graminicola in shoots[ J] .Frontiers in Plant Science,2013,4:510. [32] 孟捷.接种不同根瘤菌对苜蓿生长和种子产量的影 响[D] .硕士学位论文.乌鲁木齐:新疆农业大学,2021:1-4.MENG J.The effects of inoculating different rhizobia on alfalfa growth and seed yield[D] .Master’ s Thesis.Urumqi:Xinjiang Agricultural University,2021:1-4.( in Chinese) Effects of Salt Stress on Nutritional Quality and Attached Microbial Community of Alfalfa CHANG Chun1,2 LU Qiang1 SUN Lin3 DU Shuai4 GE Gentu1 YIN Qiang2 JIA Yushan1∗ (1. College of Grassland, Resources and Environment,Inner Mongolia Agricultural University, Hohhot 010010, China; 2. Institute of Grassland Research, Chinese Academy of Agriculture Sciences, Hohhot 010010, China; 3. Inner Mongolia Academy of Agricultural &Animal Husbandry Sciences, Hohhot 010010, China;4. College of Animal Science, Zhejiang University, Hangzhou 310058, China) Abstract: The present study aimed to investigate the effects of salt stress on nutritional quality and attached mi⁃crobial community of alfalfa. The experimentaltreatments included no salt stress ( salt content<1‰, as con⁃trol), mild salt stress ( salt content 1‰ to 2‰), moderate salt stress ( salt content 2‰ to 3‰) and severe salt stress ( salt content 3‰ to 4‰) . Three plots were set up for each salt stress treatment, and the area of each plot was 30 m2(5 m×6 m) . The results showed that the acid detergent fiber and neutral detergent fiber contents of alfalfa under moderate salt stress were significantly lower than those of alfalfa under other treatments (P<0.05),and mild salt stress could significantly increase the contents of glutamic acid, proline, soluble protein,crude protein and soluble carbohydrate of alfalfa compared with other treatments (P<0.05) . No significant differences were observed on Shannon index and Chao1 index among treatments (P>0.05) . The results of principal coordinate analysis (PCoA)showed that salt stress did not completely change the microbial communi⁃ty structure attached to the surface of alfalfa. Under all treatments, the phylum⁃core⁃microbiome were Pro⁃teobacteria (84.48% to 92.91%), Actinobacteria (4.30% to 6.47%), Bacteroidetes (0.39% to 10.59%)and Firmicutes (0.61% to 3. 02%), and the genus⁃predominant⁃microbiome were Pantoea (47. 17% to 56.11%), Pseudomonas (10.58% to 19.88%), Sphingomonas (5.69% to 9. 32%), Methylobacterium (1.75% to 7.87%), Rhizobium (0.48% to 4.92%) and Enterobacter (0.43% to 4.05%) . With the increase of saltstress, the relative abundances of Methylobacterium and Rhizobium decreased, which under moderate salt stressand severe salt stress were significantly lower than no salt stress (P<0.05) . Prediction of microbial community functions based on KEGG showed that microbial functions were mainly concentrated in carbohy⁃drate metabolism,amino acid metabolism, energy metabolism and nucleic acid metabolism, of which carbohy⁃drate metabolism was the main metabolic mode. Correlation analysis showed that the relative abundance of Rhi⁃zobium was significantly positively correlated with acid detergent fiber,lignin and neutral detergent fiber con⁃tent (P<0.001, P<0.01, P<0.05),and there was asignificant negative correlation between Rhizobiumrela⁃tive abundance and crude protein, glutamate, proline and soluble carbohydrate contents (P<0.01); the relative abundance of Methylobacterium was significantly positively correlated with acid detergent fiber and lignin con⁃tent (P<0.01, P<0.05), and there was a significant negative correlation between Methylobacterium relative a⁃bundance and glutamate content (P<0.01);there was a significant positive correlation between salt stress and Sphingomonas relative abundance (P<0.05), and a significant negative correlation with Methylobacterium rel⁃ative abundance (P<0.01) . In conclusion, moderate salt stress ( salt content 2‰ to 3‰) can improve the nu⁃tritional quality and the relative abundances of Bacteroidetes and Firmicutes in attached microbial community of alfalfa.[Chinese Journal of Animal Nutrition, 2023, 35(1):439⁃449] Key words:salt stress;alfalfa; nutritional quality; microbial community (责任编辑 菅景颖)
确定









还剩9页未读,是否继续阅读?
中国格哈特为您提供《“中苜3号”苜蓿中蛋白质中性洗涤纤维、酸性洗涤纤维、可溶性蛋白质的检测》,该方案主要用于饲料中营养成分检测,参考标准--,《“中苜3号”苜蓿中蛋白质中性洗涤纤维、酸性洗涤纤维、可溶性蛋白质的检测》用到的仪器有格哈特杜马斯定氮仪DT N Pro、格哈特快速干燥仪STL56、格哈特全自动型纤维分析仪FT12、格哈特强力高重现振荡器LS500/RO500、德国移液器MM
相关方案
更多
该厂商其他方案
更多














