
方案详情
文
近期,约翰霍普金斯大学医学院的研究人员在Science期刊发表研究成果[1]。他们发现了靶向TP53突变的新抗原,筛选出一种抗体片段(H2-scFv)特异性识别灭活的肿瘤抑制基因的蛋白质产物,通过实时监测T细胞杀伤效应,证实了该抗体片段的有效性,开创了靶向疗法的新领域。此研究中,Incucyte®被选择并应用于免疫细胞肿瘤杀伤活性的实时动态分析。
方案详情

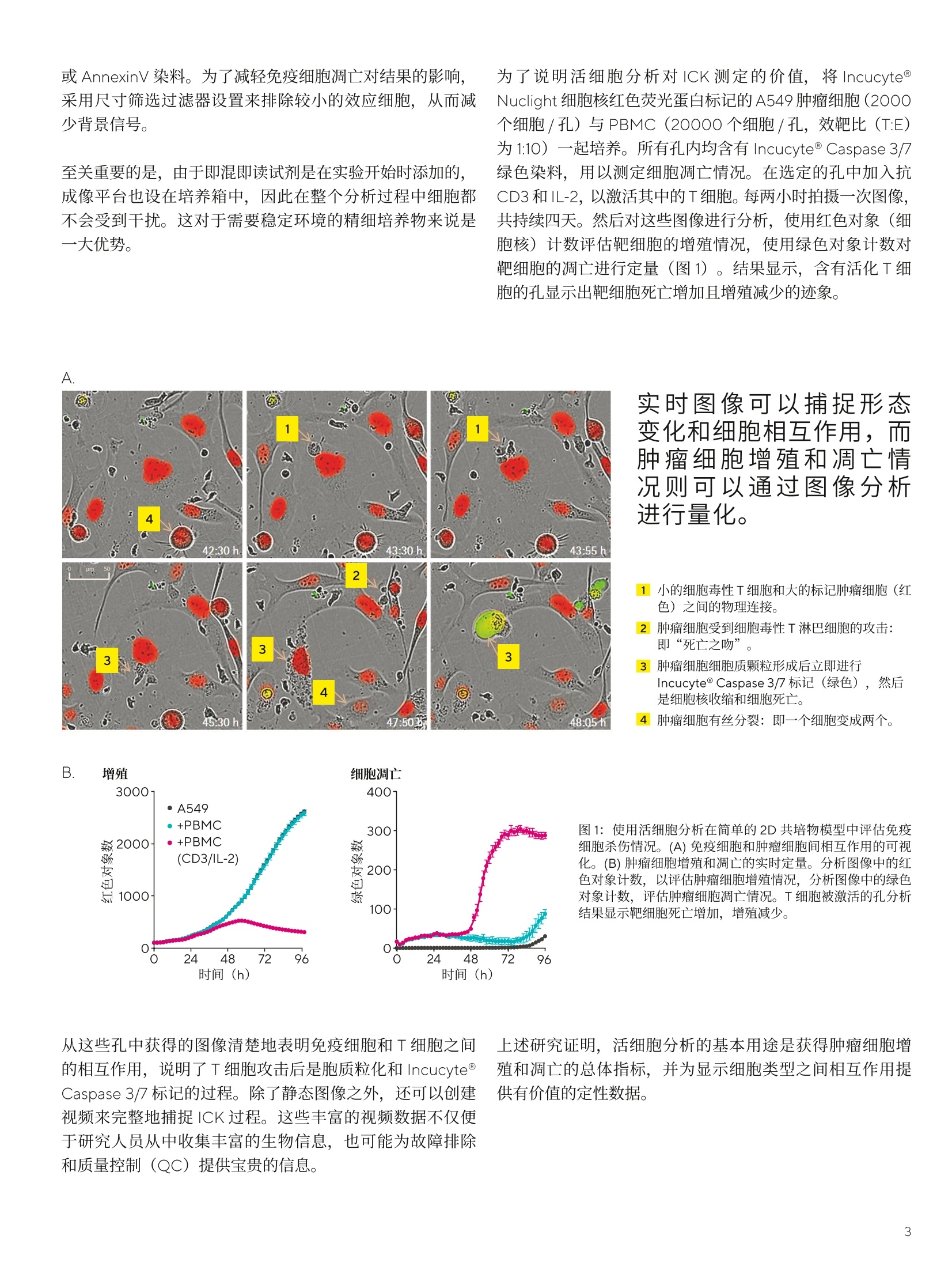
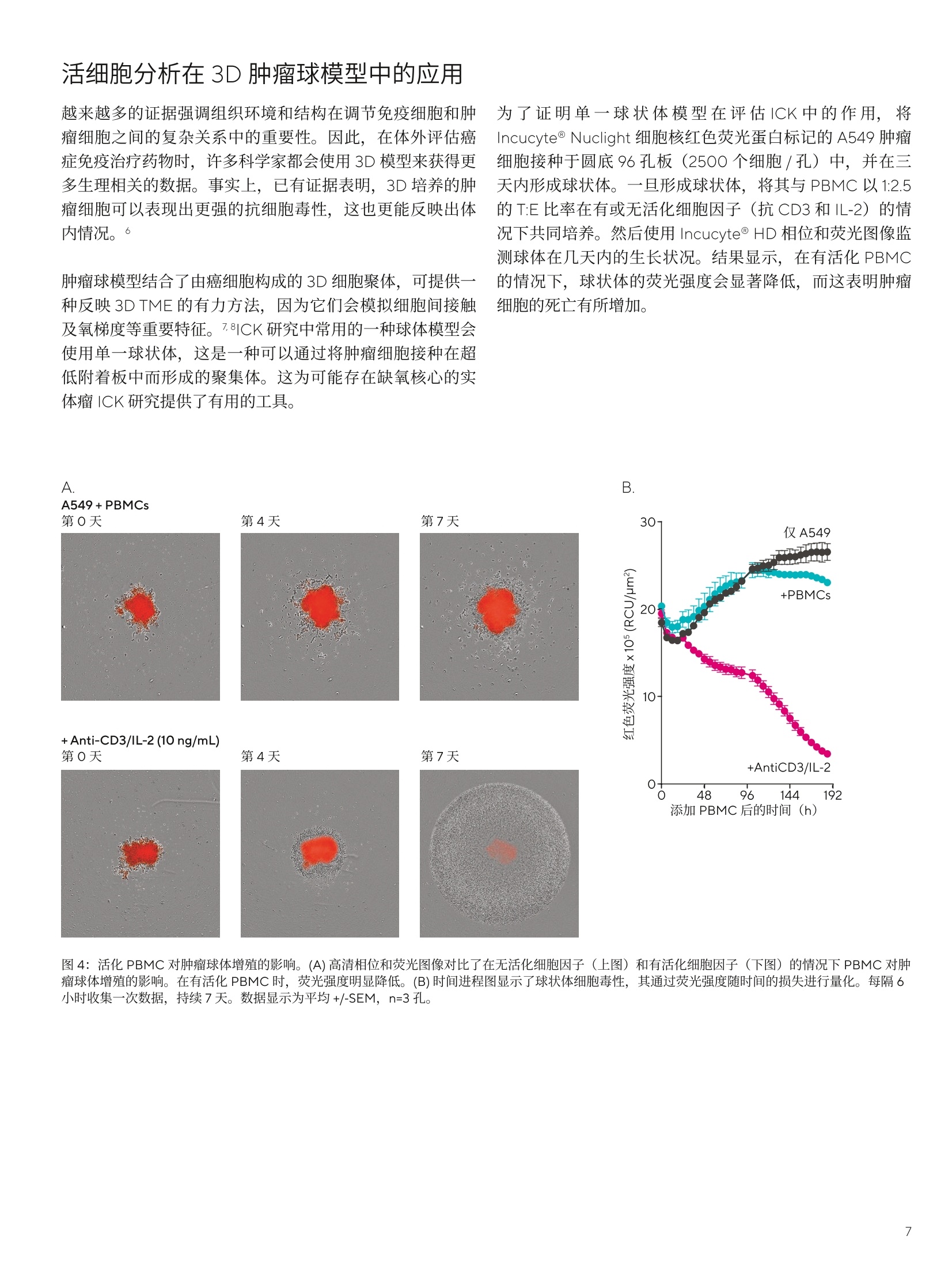
SARTORIUS 评估癌症研究中的免疫细胞杀伤:关键挑战 关键词或短语: 活细胞分析、细胞毒性T细胞、自然杀伤细胞、免疫细胞杀伤、3D肿瘤免疫细胞杀伤、抗体依赖性细胞毒性 实时活细胞分析开启免疫细胞杀伤实验新格局增强式数据分析和转化模型为您提供新的生物学见解 引言 在理解癌症并开发新治疗策略的持续不断的研究中,研究人员正在探索患者的自身免疫系统在抵御肿瘤时发挥的作用。这种抗癌反应的一个关键组成部分是某些免疫细胞(如细胞毒性T细胞和自然杀伤细胞)通过免疫细胞杀伤(ICK)过程诱导恶性细胞死亡的能力。因此,体外模拟 ICK 至关重要。 传统上有多种用于评估 ICK 的技术,如流式细胞术及生化读数。虽然这些都是有效的手段,但它们只能从单个时间点的分析中得出测量结果,并不能对动态细胞相互作用进行表征,从而限制了可获得的生物学见解。因此,为了更全面地了解 ICK,研究人员正在寻找能够提供额外信息的新型分析方法,以补充当前的工作流程。 科学家们非常需要一些能够捕捉、可视化并量化 ICK 相关动态变化的方法。此外,随着转化模型的应用越来越广泛,研究人员需要一些可应用于3D肿瘤球体以及贴壁和非贴壁2D 共培养物的灵活 ICK 分析方法。本白皮书展示了实时活细胞分析技术如何发展,以满足免疫肿瘤学研究不断变化的需求。 鉴于 ICK的复杂性,研究人员在体外模拟这个流程时也会面临许多挑战。一个主要的难点是,在全方位测定中,无法在共培养模型中测定细胞特异性细胞毒性信号。例如,使用酶每放测定技术(如 LDH 和 GAPDH 释放检测)时,无法确定信号是否来自共培养模型中的肿瘤细胞或免疫细胞的死亡。为了克服这个问题,i可使用51 Cr 释放法来分离细胞特异性信号。然而,背景信号仍然会限制从该分析中得出的结论,因为许多癌细胞无法有效地吸收或保留铬标记。 1、2 即使对肿瘤细胞的细胞毒性进行最可靠的分析,这种细胞死亡的总体指标也无法反映 ICK 中复杂细胞相互作用的微妙之处。举个例子,不同的T细胞亚群在诱导肿瘤细胞死亡时可能会发挥不同的功能作用。3探索这些行为差异的研究人员就需要研究激活的免疫细胞的形态特征以及其与癌细胞的空间关系。然而,用于评估 ICK 的传统方法并不是基于影像的,通常需要取出细胞。因此,科学家需要采用补充性技术,以便在这一动态过程中对表型和空间有深入的了解。 除了难以获得可靠且全面的数据外,传统的分析方法还缺乏充分表征ICK 过程所需要的时间分辨率。由于大多数方法是在预先确定的终点进行参数评估,因此无法深入了解生物学中的动态变化。4另外一个问题是收集数据时细胞成熟度和健康状况的可变性,这可能会限制结果的质量和可靠性。 活细胞分析:满足新需求的灵活解决方案 活细胞分析可利用实时成像来实时捕捉活细胞的行为。将培养物保存在培养箱内的成像平台上,以在整个实验过程中实时观察生物事件和行为的动态变化。因此,科学家可以在最合适的时候持续评估培养物并安排操作及测定。这种灵活性对研究人员来说是一个关键的优势,因为他们要应对不同培养物之间的生物差异,尤其是需要最大限度地利用从珍贵材料中获得的数据量时。 此外,当发现问题时,排除问题以确定问题原因可能会涉及反复的实验运行,这会消耗宝贵的材料,并可能要花费大量的时间。 对灵活性和多用途的需求在日益增长 随着细胞培养模型变得越来越复杂,与ICK测定相关的挑战也变得更加难以克服。这是免疫肿瘤学研究中亟待解决的一个问题,因为科学家们经常需要从简单的2D培养系统转向更具生理相关性的先进3D模型。例如,越来越多的瘤球体模型被用于揭示肿瘤微环境(TME) 如何影响癌症和免疫应答之间的相互作用。!5、6作为获得更多转化见解的进一步策略,,许多研究人员现在正在将活检组织或嵌合抗原受体 (CAR)T细胞等患者来源的材料纳入ICK模型,这可能有助于释放个体化用药的全部潜力。在这种不断扩大的转化细胞研究领域,科学家们也在不断寻求可适应一系列不同培养模型的灵活 ICK 分析方法。 这些转化模型所涉及的复杂培养物也越来越精细。因此,它们更容易受到环境条件变化的影响,进而使其在技术上很难获得可靠的结果。但是,由于这些脆弱的培养物比细胞系珍贵得多,充分利用每次的检测就显得至关重要。因此,研究人员认识到需要新的 ICK 方法来更好地监测细胞,并提供多用途功能,以便从尽可能少的材料中提取最多的信息。对于希望满足这些要求的科学家来说,活细胞分析是一种相当不错的选择。 活细胞分析技术可用于测定包括2D 和3D培养物在内的各种体外模型的 ICK。在最简单的2D应用中,肿瘤细胞与所选免疫细胞(如T细胞或人类外周血单核细胞(PBMC))维持在基本共培物中,这些免疫细胞均被可溶性细胞因子、抗体或磁珠激活。更常见的是,肿瘤细胞将用可作为增殖标记物定量的核限制荧光蛋白标记,而细胞凋亡将在第二个荧光通道中用试剂来测定,例如 Incucyte@ Caspase3/7 或 AnnexinV 染料。为了减轻免疫细胞凋亡对结果的影响,采用尺寸筛选过滤器设置来排除较小的效应细胞,从而减少背景信号。 至关重要的是,由于即混即读试剂是在实验开始时添加的,成像平台也设在培养箱中,因此在整个分析过程中细胞都不会受到干扰。这对于需要稳定环境的精细培养物来说是一大优势。 为了说明活细胞分析对ICK测定的价值,,1将Incucyte@Nuclight 细胞核红色荧光蛋白标记的A549 肿瘤细胞(2000个细胞/孔)与PBMC (20000个细胞/孔,效靶比 (T:E)为1:10)一起培养。所有孔内均含有 Incucyte@ Caspase 3/7绿色染料,用以测定细胞凋亡情况。在选定的孔中加入抗CD3和IL-2,以激活其中的T细胞。每两小时拍摄一次图像,共持续四天。然后对这些图像进行分析,使用红色对象(细胞核)计数评估靶细胞的增殖情况,使用绿色对象计数对靶细胞的凋亡进行定量(图1)。结果显示,,含有活化T细胞的孔显示出靶细胞死亡增加且增殖减少的迹象。 B 实时图像可以捕捉形态变化和细胞相互作用,而肿瘤细胞增殖和凋亡情况则可以通过图像分析进行量化。 1小的细胞毒性T细胞和大的标记肿瘤细胞(红色)之间的物理连接。 2肿瘤细胞受到细胞毒性T淋巴细胞的攻击:即“死亡之吻”。 3肿瘤细胞细胞质颗粒形成后立即进行 Incucyte@ Caspase 3/7标记(绿色),然后是细胞核收缩和细胞死亡。 4肿瘤细胞有丝分裂:即一个细胞变成两个。 从这些孔中获得的图像清楚地表明免疫细胞和T细胞之间的相互作用,说明了T细胞攻击后是胞质粒化和 Incucyte@Caspase 3/7标记的过程。除了静态图像之外,还可以创建视频来完整地捕捉ICK 过程。这些丰富的视频数据不仅便于研究人员从中收集丰富的生物信息,也可能为故障排除和质量控制(QC)提供宝贵的信息。 上述研究证明,活细胞分析的基本用途是获得肿瘤细胞增殖和凋亡的总体指标,并为显示细胞类型之间相互作用提供有价值的定性数据。 随着活细胞分析能力的进步,科学家们获得了新的技能来阐明 ICK。取得突破的关键一步是开发出了先进的图像处理算法来定义单个细胞。因此,科学家现在可以使用细胞圈描软件(如 Incucyte@Cell-by-Cell Analysis) 来识别图像中的所有细胞,而不是简单地使用红色对象计数来量化肿瘤细胞。由于肿瘤细胞用RFP标记,因此可以根据是否存在红色荧光标记将细胞分为效应细胞群和靶细胞群。 这种用于区分不同细胞类型的技能也有几个优势。首先,研究人员可以在不使用标记物的情况下就识别出效应细胞。其次,科学家可以在涉及非贴壁靶细胞的研究中优化细胞分类。这些肿瘤细胞可能看起来与免疫细胞非常相似,因此很难通过标准分析中使用的尺寸筛选法从干扰的效应细胞信号中分离出靶细胞凋亡信息。 为了说明细胞圈描软件在非贴壁培养中的使用,将Incucyte@Nuclight 细胞核红色荧光蛋白标记的 Ramos 细胞(10000个细胞/孔)与越来越多的预活化或非活化的PBMC混合,并加入 Incucyte@Annexin V绿色染料作为凋亡标记物(图2)。使用 Incucyte@ Cell-by-Cell Analysis 软件模块内的高级图像处理算法来圈描单个细胞,然后根据是否存在红色荧光将其分为靶细胞群和效应细胞群。随着效应细胞数量的增加,靶细胞群(红色)的增殖减少,凋亡增加。相比之下,效应细胞群(非红色)随着时间的推移显示出现增殖,但此现象仅限于活化的细胞。 图像分析软件的进步也让科学家得以可视化并量化免疫细胞和肿瘤细胞之间的相互作用。例如,通过对两个细胞圈描的重合或重叠进行定量,即可以评估免疫和靶细胞的相互作用。为了证明这一点,,在加入Incucyte@Fabfluor-488-a-CD45 和 Incucyte@ Opti Green 的情况下,将 Incucyte@ Cytolight 细胞质红色荧光蛋白标记的 A549 肿瘤细胞(5000个细胞/孔)与预活化或未活化的 PBMC(25000个细胞/孔, T:E 比率为 1:5) 一起培养,用以标记总淋巴细胞群(图3)。加入 PBMC两个小时后,使用图像处理软件圈描细胞,彳以便对靶细胞和效应细胞的空间信息定量。与预期一致,结果显示活化的 PBMC与靶细胞具有更大的相互作用,这与 ICK 增加结果一致。 A. 效应细胞(黄色圈描)靶细胞(蓝色圈描) Nuclight Red Ramos+活化 PBMC 利用最新的图像分析软件,可以轻松将非贴壁靶细胞和效应细胞划分为不同的细胞群。 B 细胞分群 Nuclight Red Ramos +非活化 PBMC 红色平均荧光强度(RCU) C. 效应细胞增殖 +ve Red Pop 15· +1:5 10· 5+1:3 5 +1:1活化 PBMC +非活化 PBMC 0- 24 48 72 时间(h) 图2:使用 Incucyte@ Cell-by-Cell Analysis 软件模块来增强图像量化。(A)图像显示了通过 Cell-by-Cell Analysis 软件对整个群体进行单个细胞圈描。基于红色荧光区分靶细胞(蓝色)和效应细胞(黄色)亚群。(B)根据红色和绿色荧光对亚群进行分类。(C) 对不同时间的增殖和凋亡情况进行量化。随着效应细胞数量的增加,靶细胞群(阳性红细胞)的增殖减少,凋亡增加(红细胞的百分比也是绿色的)。效应细胞群在活化(非红色细胞)时显示有增殖。数据显示为平均+/-SEM, n=4孔。 CD45, 非活化 PBMC CD45, 预活化 PBMC 未活化活化 使用图像处理算法来确定细胞重合性,进而对细胞相互作用进行量化和分析。 图3:免疫和肿瘤细胞相互作用的可视化和量化。(A)加入 PBMC两小时后的图像显示CD45+细胞(绿色)和A549田胞(红色)之间的相互作用。两种细胞类型之间的叠加显示为黄色圈描。(B)叠加部分的量化显示,与未活化的效应细胞相比,活化的效应细胞的相互作用明显更高。 科学家可通过测定和量化细胞间的相互作用,1,以获得更多的形态学和空间见解,从而更好地表征ICK 过程。最终,这些信息可为新型候选疗法的鉴别提供支持。例如,评估细胞相互作用的持续时间可能对药物研发项目非常有价值,因为免疫细胞和癌细胞之间接触时间的延长可能与ICK的增加有关。 增强式图像处理的另一个应用是使用特定于表面标记物的特异性抗体来独立评估不同的效应细胞亚型。这种亚型分析与相互作用评估结合在一起,便于科学家确定与靶细胞相互作用的免疫细胞群。因此,这种方法可以将对小部分细胞的强治疗效果及对所有细胞的较差治疗效果区分开来。由于不同效应细胞类型之间的异质性是免疫肿瘤学药物发现中的主要复杂因素,所以,这些新功能与基于整合所有细胞信息的整体测量分析相比,具有显著的优势。 活细胞分析在3D肿瘤球模型中的应用 越来越多的证据强调组织环境和结构在调节免疫细胞和肿瘤细胞之间的复杂关系中的重要性。因此,在体外评估癌症免疫治疗药物时,许多科学家都会使用3D模型来获得更多生理相关的数据。事实上,已有证据表明,3D培养的肿瘤细胞可以表现出更强的抗细胞毒性,这也更能反映出体内情况。6 肿瘤球模型结合了由癌细胞构成的3D细胞聚体,可提供一种反映 3D TME的有力方法,因为它们会模拟细胞间接触及氧梯度等重要特征。7.8|CK研究中常用的一种球体模型会使用单一球状体,这是一种可以通过将肿瘤细胞接种在超低附着板中而形成的聚集体。这为可能存在缺氧核心的实体瘤 ICK研究提供了有用的工具。 为了证明单一球状体模型在评估ICK中的作用,将Incucyte@ Nuclight 细胞核红色荧光蛋白标记的A549肿瘤细胞接种于圆底96孔板(2500个细胞/孔)中,并在三天内形成球状体。一旦形成球状体,将其与 PBMC 以1:2.5的T:E比率在有或无活化细胞胞子(抗CD3和IL-2)的情况下共同培养。然后使用 Incucyte@ HD 相位和荧光图像监测球体在几天内的生长状况。结果显示,在有活化 PBMC的情况下,球状体的荧光强度会显著降低,而这表明肿瘤细胞的死亡有所增加。 图4:活化 PBMC对肿瘤球体增殖的影响。(A)高清相位和荧光图像对比了在无活化细胞因子(上图)和有活化细胞因子(下图)的情况下 PBMC 对肿瘤球体增殖的影响。在有活化 PBMC时,荧光强度明显降低。(B)时间进程图显示了球状体细胞毒性,其通过荧光强度随时间的损失进行量化。每隔6小时收集一次数据,持续7天。数据显示为平均+/-SEM, n=3孔。 培养三天以形成多球体,然后在有或无 PBMC (5000个细胞/孔,T:E 比为1:5)的情况下添加赫赛汀。在接下来的七天里,使用明场和荧光图像来监测球状体。结果表明,只有在 Her2 阳性的 BT-474细胞中存在赫赛汀的情况下,荧光出现浓度依赖性丢失,而在Her2阴性的 MCF-7细胞中没有出现这种现象。在加入活化T细胞群(抗CD3和IL-2)处理物后,这两种细胞类型的荧光强度都出现下降。 活细胞分析可以很容易地用来测量这些多球体内的 ICK。图5为此类研究的示例。该分析评估了赫赛汀对 Her2 阳性细胞的抗体依赖性细胞毒性(ADCC)。将稳定表达RFP的Her2 阴性 MCF-7细胞 (Incucyte@ Nuclight 细胞核红色荧光蛋白标记的MCF-7)或稳定表达细胞质绿色荧光蛋白的Her2 阳性 BT-474细胞 (Incucyte@ Cytolight 细胞质绿色荧光蛋白标记的 BT-474)接种在平底96孔板(1000个细胞/孔)中的 Matrigel@基底上。 A 在单球体和多球体模型中,都可以轻松对 ICK 进行量化。 赫赛汀(1pg/mL) 赫赛赛(1pg/mL) +PBMCs 明场圈描为黄色 B.Incucyte@ Cytolight Green BT-474 图5:赫赛汀诱导的 PBMC 对多球体增殖的影响。(A)七天内 (Incucyte@ Nuclight Red MCF-7) 或十天内 (Incucyte@ Cytolight Green BT-474) 拍摄 的Incucyte@明场和荧光图像显示了在无(上图)和有(下图) PBMC的情况下,赫赛汀对球体增殖的影响。明场轮廓圈描以黄色显示。(B)时间进程显示多球体的死亡,其通过球体对象明场内荧光强度的损失进行量化。加入活化T细胞群(抗CD3和IL-2)的处理物后,细胞毒性有所增加。每隔六小时收集一次数据,共持续十天。数据显示为平均+/-SEM, n=4孔。 为了更好地理解 ICK过程,科学家们正在通过更复杂的转化模型来寻求更深入的生物学见解。到目前为止,我们提供的证据表明,活细胞分析可以很容易地用于这项研究。随着免疫学研究领域的不断发展,这项技术也有可能应用于更新的模型。 多重培养:活细胞分析可用于涉及三种或三种以上细胞类型的多重培养。鉴于越来越多的证据表明基质细胞相互作用在肿瘤发生中发挥着重要的作用,这种模型可能会被越来越多地用于免疫肿瘤学研究。?对于需要在这些复杂模型中评估ICK的科学家来说,活细胞分析是个理想的解决方案,因为该技术可以灵活地适应复杂的培养模型。 另一个关键的转化方法是将活检组织或 CAR-T 细胞等来源于患者的材料纳入 ICK分析。同样,活细胞分析也可轻松用于此类研究。 结论 在这篇白皮书中,我们阐述了活细胞分析如何进行演变,来应对免疫肿瘤学研究中日益严峻的挑战。增强式数据分析的引入,加上该方法在更具转化性的3D培养模型中的验证,使活细胞分析成了一种可满足该领域当前和未来需求的灵活解决方案。 基本上,这种方法的独特价值在于它能够最大化从每种培养物中获得的数据量。这主要有两个原因:第一,通过实时监测,永远不会错过感兴趣的信号,这样就不会浪费培养物;其次,科学家现在可以使用新的指标和分析来增加从每个样本中收集的信息的深度。这样,研究人员无需花费额外的时间或材料,即可更深入地了解 ICK。这种资源效率对于转化模型至关重要,因为转化模型通常包含更珍贵且精细的培养物。 事实上,这种方法已经成功地用于开发和测试新型 CAR-T细胞结构,并评估其体外活性10、11,而且它还能用于对批次之间的扩增和活性进行比较(出于质控目的)。到目前为止,活细胞分析在 CAR-T 细胞治疗中的应用仅限于临床前阶段,但随着技术和仪器的进步,也有可能会应用于临床。 免疫细胞浸润:这些试验的进一步用途可能是评估免疫细胞对3D结构的入侵。这是免疫肿瘤学的一个热点问题,因为T淋巴细胞对实体瘤的浸润与临床结果相关。12然而,肿瘤有许多防御机制,其可限制免疫细胞的迁移。因此,对于研究新型疗法的科学家来说,免疫入侵过程是一个正在不断发展的研究领域。事实上,随着最近研究免疫细胞归巢的新型3D 高通量分析技术的发展,该领域也在迅速扩大。ó鉴于活细胞分析在3D模型适应方面的灵活性,这种方法很可能会在这一热门研究领域发挥关键的作用。 为了从每个实验中获得更大的价值,也可以将活细胞分析与其他技术结合起来使用。由于细胞在整个实验过程中不受干扰,所以,,研究人员可以移除上清液样本,或者在分析后取出细胞,并用流式细胞术等方法对其进行分析。而这样,科学家就可以最大化从珍贵培养中获得的生物学信息。 总体而言,活细胞分析的灵活性和多用途能力使该方法成为补充传统 ICK 工作流程的有效解决方案,为推进免疫肿瘤学研究和疗法发现带来了巨大的潜力。 ( 参考文献 ) ( 1. Z aritskaya L, Shurin MR, Sayers T J , and Malyguine AM. New flow cytometric assays for monitoring cell- mediated cytotoxicity. Expert Rev Vaccines, Jun;9(6);601-16(2010) ) ( 2. Nelson DL , Kurman CC, and Serbousek DE. 51 Cr Release Assay of Antibody-Dependent Cell-Mediated Cytotoxicity (ADCC). Current Protocols in Immunology, 8(1);7.27.1-7.27.8(2001) ) ( 3. Golubovskaya V and Wu L. Different Subsets of T Cells, Memory, Effector Functions,and CAR-T Immunotherapy. Cancers (Basel), Mar 15;8(3);36 (2016) ) ( 4. Cerignoli F, et al. In vitro immunotherapy potency assays using real-time cell analysis. PLoS One, Mar;13(3);e0193498(2018) ) ( 5 . V erjans E T, Doijen J, Luyten W, Landuyt B , and Schoofs L. Three-dimensional cell culture models for anticancer drug screening: Worth the effort?J Cell Physiol, Apr;233(4);2993-3003(2018) ) ( 6. S herman H, Gitschier HJ,and Rossi AE,A Novel Three- Dimensional Immune Oncology Model for High- Throughput Testing of Tumoricidal Activity. Front Immunol, 9;857 (2018) ) ( 7. Daster S, et al . Induction of hypoxia and necrosis inmulticellular tumor spheroids is associated withresistance to chemotherapy treatment. Oncotarget, Jan;8(1);1725-1736(2017) ) 8.RFiffle S and Hegde RS. Modeling tumor cell adaptationsto hypoxia in multicellular tumor spheroids. J. Exp. ClinCancer Res, Dec;36(1);102(2017) 9.Radisky D, Hagios C, and Bissell MJ. Tumors are uniqueorgans defined by abnormal signaling and context.Semin Cancer Biol,Apr;11(2);87-95(2001) 10.Foster AE, et al. Regulated Expansion and Survival ofChimeric Antigen Receptor-Modified T Cells UsingSmall Molecule-Dependent Inducible MyD88/CD40.Mol Ther, Sept;25(9);2176-2188(2017) 11. Li H, et al.Antitumor activity of EGFR-specific CAR-Tcells against non-small-cell lung cancer cells in vitroand in mice. Cell Death Dis, Fed;9(2);177 (2018) 12. Fridman WH, Pages F, Sautes-Fridman C,and Galon J.The immune contexture in human tumours: impact onclinical outcome. Nat Rev Cancer,Apr;12(4);298-306(2012) 销售与服务联系方式 服务热线 400 920 9889|800 820 9889邮箱 lab.cn@sartorius.com 更多联系信息,请访问www.sartorius.com.cn 赛多利斯(上海)贸易有限公司上海市浦东新区盛荣路 388 弄百佳通产业园3号楼,7-11层, 200120电话+86 21 6066 6100 技木规格如有变更,恕不另行通知。赛多利斯保留最终解释权和修改权。版本04|2022 了解更多: www.sartorius.com/incucyte 免疫细胞可识别并杀伤有害的靶细胞(如突发性肿瘤细胞),是人体宿主防御机制的一个重要组成部分。抗体依赖性细胞介导的细胞毒性 (ADCC) 和 T 细胞杀伤是细胞介导的免疫应答的两种机制,其中的每个过程都涉及刺激免疫细胞亚群(例如,自然杀伤 (NK) 细胞或细胞毒性 T 淋巴细胞 (CTL)),使它们主动裂解靶细胞。近期,约翰霍普金斯大学医学院的研究人员在Science期刊发表研究成果[1]。他们发现了靶向TP53突变的新抗原,筛选出一种抗体片段(H2-scFv)特异性识别灭活的肿瘤抑制基因的蛋白质产物,通过实时监测T细胞杀伤效应,证实了该抗体片段的有效性,开创了靶向疗法的新领域。此研究中,Incucyte®被选择并应用于免疫细胞肿瘤杀伤活性的实时动态分析。Incucyte® 实时活细胞分析系统Incucyte®有什么优势呢?免疫细胞肿瘤杀伤活性的体外评价过程涉及到免疫细胞和肿瘤细胞两种细胞存在,因此不能采用传统的细胞增殖活性检测手段(如MTT、ATP等方法)直接进行检测。目前常用的免疫细胞杀伤研究方法包括 51铬释放试验、流式细胞术、 ELISpot、3H 胸腺嘧啶和 ATP 检测。这些方法步骤繁琐,耗费时间和人力,很难实现对效应细胞和靶细胞之间相互作用的研究。Incucyte® 位于细胞培养箱内,可以长时程自动采集相差和荧光图片,实时观察并全自动分析肿瘤细胞杀伤和免疫细胞与肿瘤细胞之间的相互作用,配合Cell-By-Cell软件模块可以自动地完成图片的定量分析,直接测定肿瘤细胞的死亡及活力。双特异性单链双抗体(H2-scDb)的鉴定通过筛选一个展示 scFv 的噬菌体文库,针对包含 p53R175H 肽的 HLA-A*02:01 pHLA 单体的阳性选择与针对包含 p53WT 和无关肽的 pHLA 单体的阴性选择相结合。实验中评估了几种双特异性抗体形式(例如双特异性 T 细胞接合剂 (BiTE)、双亲和重新靶向抗体 (DART) 和双抗体)后,选择了scDb 形式。根据不同生物学实验验证,筛选出特异性较高的克隆H2-scDb。H2-scDb 特异性识别表达 p53R175H 新抗原的癌细胞H2-scDb 识别表达不同量 HLA-A*02:01 并具有不同 p53 突变状态的癌细胞系的能力,即使H2-scDb的浓度非常低,对T细胞的激活功能也是非常明显的,T 细胞反应导致靶细胞的有效杀伤,并且是多功能的,如细胞毒性颗粒蛋白颗粒酶 B 和穿孔素的释放以及细胞因子 IFN-γ、肿瘤坏死因子 α (TNF-α)、白细胞介素2 (IL-2) 等(图 2A)。肿瘤细胞周围的 T 细胞聚集,导致它们在 H2-scDb 存在下裂解,也通过Incucyte® 实时活细胞成像进行可视化(图 2B)。图 2.(A)细胞毒性颗粒蛋白颗粒酶B和穿孔素的释放以及细胞因子IFN-γ、肿瘤坏死因子α(TNF-α)、白细胞介素-2(IL-2)等曲线;(B)绿色荧光蛋白(GFP)标记的TYK-nu与T细胞共培养,E:T比为5:1,有或没有H2-scDb在Incucyte®系统中连续监测,显示24小时和96小时拍摄的相位和绿色荧光图像。研究人员基于 CRISPR 的技术对携带内源性 HLA-A*02:01 和 p53R175H 的 KMS26、KLE 和 TYK-nu 癌细胞系中的 TP53 进行了基因破坏。H2-scDb 介导的细胞毒性通过破坏这些细胞中的 TP53 类似地减轻,通过Incucyte® 连续检测超过120h,呈现动态的定量化杀伤效果(图3)。图 3. TP53野生型(左)或突变型(右)的绿色荧光蛋白(GFP)标记的TYK-nu细胞中加入不同浓度的H2-scDb和T细胞以E:T为2:1的比例进行共培养。实时活细胞成像检测TYK-nu细胞的生长。文章讨论了该抗体片段(H2-scFv),可以特异性识别灭活的肿瘤抑制基因的蛋白质产物,而不识别完整细胞中的 WT 形式,且对蛋白质的突变形式具有特异性。H2 (H2-scDb) 构建的双特异性抗体可以激活 T 细胞,诱导多功能 T 细胞效应反应,包括细胞毒活性和多种细胞因子的产生,更好的诠释了T细胞对肿瘤杀伤的效果。因此,可以将该双特异性抗体作为新型抗体疗法的突破口。 总结 在观察免疫杀伤时,往往需要通过长时间的药物处理,比如ADCC和ADCP效应,细胞因子释放,逐渐达到治疗效果。不仅需要观察细胞形态,同时需要监测细胞因子的产生速率以及杀伤效率,传统的检测手段很容易错失最佳检测时机。Incucyte®可直接安装在细胞培养箱内,对细胞自动连续(数天、数周或数月)拍照获取活细胞的明场和荧光图像,实时观察并全自动分析肿瘤细胞杀伤和免疫细胞与肿瘤细胞之间的相互作用,即混即读的 96/384 孔检测非常适用于筛选试验,为加速临床前的药物筛选和开发提供了令人兴奋的机会。 Download 下载白皮书《实时活细胞分析开启免疫细胞杀伤实验新格局》,了解更多免疫细胞杀伤的实时动态分析策略点击下载 获取全文-参考文献-Emily Han-Chung Hsiue#1,2,3, Katharine M. Wright#2,4,5, Jacqueline Douglass#1,2,3, Michael S. Hwang. Targeting a neoantigen derived from a common TP53 mutation. Science. 2021 March 05; 371(6533): . doi:10.1126/science.abc8697.
确定








还剩8页未读,是否继续阅读?
德国赛多利斯集团为您提供《活细胞中实时分析检测方案(高内涵成像)》,该方案主要用于其他中荧光成像检测,参考标准--,《活细胞中实时分析检测方案(高内涵成像)》用到的仪器有赛多利斯 Incucyte® S3 活细胞分析仪、赛多利斯 Incucyte® SX5 活细胞分析仪
相关方案
更多
该厂商其他方案
更多










