方案详情
文
本应用介绍了用于宿主细胞蛋白质高灵敏度定量分析的工作流程,包括用于样品自动前处理的 AssayMAP Bravo 平台、用于样品分离的 Agilent 1290 Infinity II 液相色谱系统、用于数据采集的 Agilent 6495B 三重四极杆系统、用于 MRM 方法开发的 Skyline 软件中的安捷伦自动化工具、用于数据分析的 Skyline 和 Agilent MassHunter 定量分析软件的结合。
使用基于多反应监测 (MRM) 的同位素稀释方法,结果显示可准确定量低至亚 ppm(ng/mg) 浓度的 HCP。
方案详情

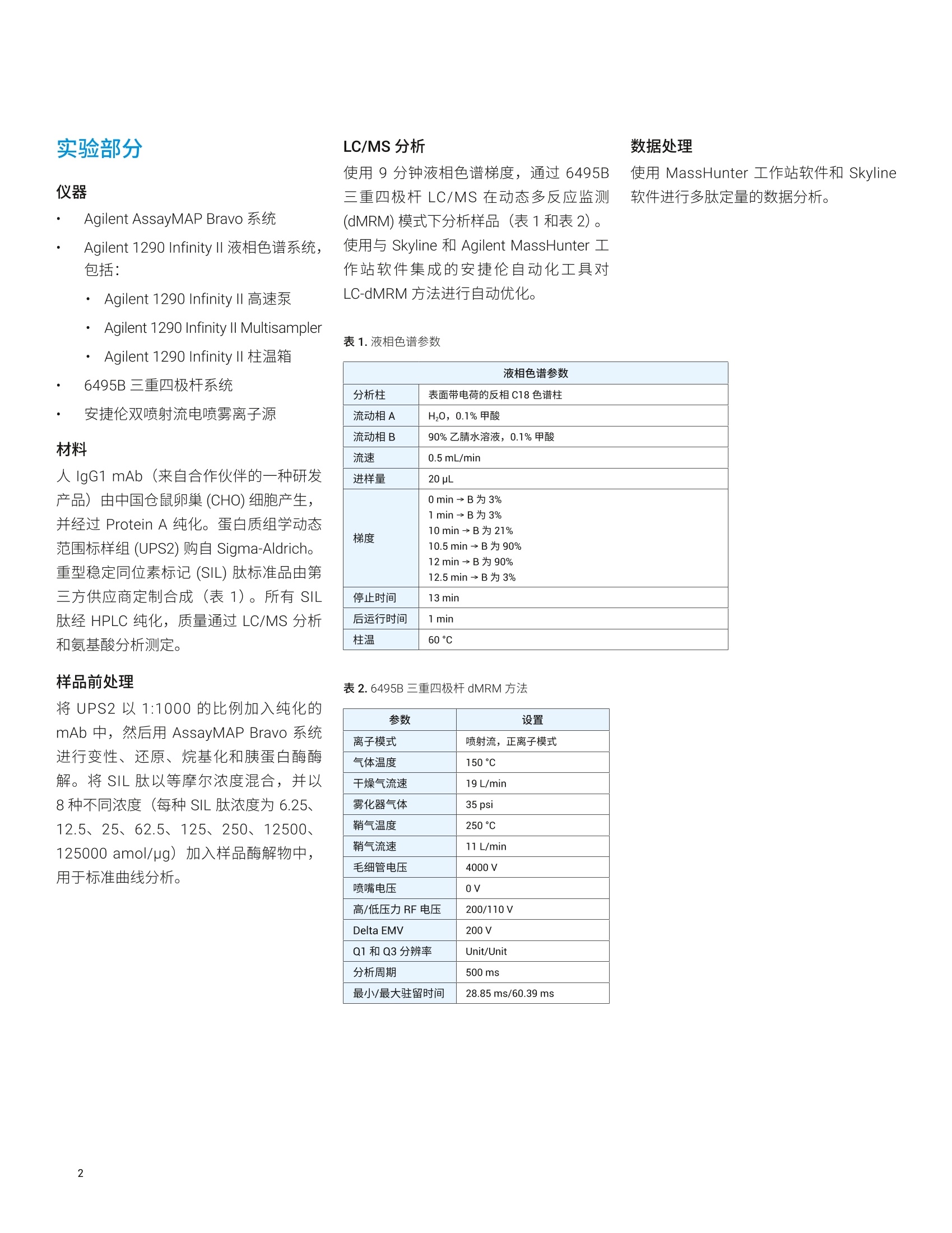
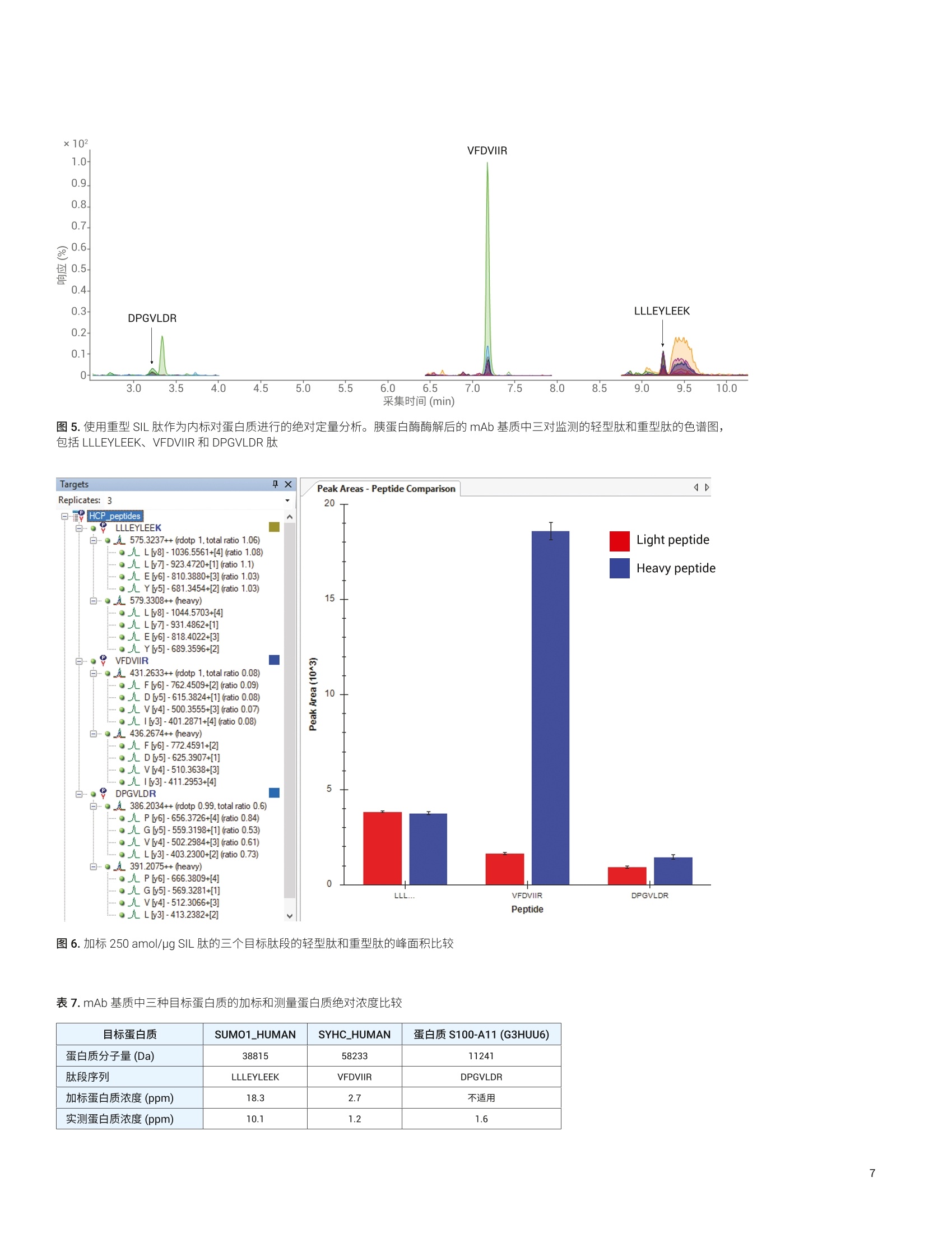
Linfeng Wu 和 Yanan Yang 安捷伦科技有限公司 采用 Agilent 1290 Infinity ll液相色谱仪与6495B三重四极杆液质联用系统定量分析宿主细胞蛋白质杂质 宿主细胞蛋白(HCP) 杂质是生物药物中低浓度的产物相关及工艺相关蛋白质杂质,来源于生产过程中的宿主生物。由于它们可能影响产品安全性和功效,因此根据法规要求必须对药品中的 HCP 进行监测和控制。传统上,酶联免疫吸附测定法(ELISA)是定量分析蛋白质治疗药物中 HCP 的标准方法。然而, ELISA 的特异性和覆盖率不足以鉴定并定量分析各种 HCP。因此, LC/MS 技术成为 HCP 分析的另一选择。在 HCP 的 LC/MS定量分析过程中,主要挑战在于低丰度 HCP 肽段与高丰度药品肽段的共洗脱。因此需要在药品基质的高背景下对低丰度肽进行灵敏而可重现的定量分析。 本应用简报介绍了用于宿主细胞蛋白质高灵敏度定量分析的工作流程,包括: 用于样品自动前处理的 AssayMAP Bravo 平台 用于样品分离的 Agilent 1290 Infinity II液相色谱系统 用于数据采集的 Agilent 6495B 三重四极杆系统 用于 MRM 方法开发的 Skyline 软件中的安捷伦自动化工具 用于数据分析的 Skyline 和 Agilent MassHunter 定量分析软件的结合 使用基于多反应监测(MRM) 的同位素稀释方法,结果显示可准确定量低至亚 ppm(ng/mg) 浓度的 HCP。 实验部分 仪器 Agilent AssayMAP Bravo 系统 Agilent 1290 Infinity ⅡI液相色谱系统,包括: · Agilent 1290 Infinity ll高速泵·AAgilent 1290 Infinity II Multisampler Agilent 1290 Infinity ⅡI柱温箱 6495B三重四极杆系统 安捷伦双喷射流电喷雾离子源 材料 人 IgG1 mAb (来自合作伙伴的一种研发产品)由中国仓鼠卵巢 (CHO) 细胞产生,并经过 Protein A 纯化。蛋白质组学动态范围标样组 (UPS2) 购自 Sigma-Aldrich.重型稳定同位素标记 (SIL)肽标准品由第三方供应商定制合成(表1)。所有SIL肽经 HPLC纯化,质量通过LC/MS分析和氨基酸分析测定。 样品前处理 将 UPS2以1:1000 的比例加入纯化的mAb 中,然后用 AssayMAP Bravo 系统进行变性、还原、烷基化和胰蛋白酶酶解。将 SIL 肽以等摩尔浓度混合,并以8种不同浓度(每种 SIL 肽浓度为 6.25、12.5、25、62.5、125、250、12500、125000 amol/pg)加入样品酶解物中,用于标准曲线分析。 LC/MS分析 使用9分钟液相色谱梯度,通过6495B三重四极杆LC/MS 在动态多反应监测(dMRM) 模式下分析样品(表1和表2)。使用与 Skyline 和 Agilent MassHunter 工作站软件集成的安捷伦自动化工具对LC-dMRM 方法进行自动优化。 表1.液相色谱参数 液相色谱参数 分析柱 表面带电荷的反相 C18色谱柱 流动相A H,0,0.1%甲酸 流动相B 90%乙腈水溶液,0.1%甲酸 流速 0.5mL/min 进样量 20 pL 梯度 0min→ B 为3% 1min→B为3% 10 min→B为21% 10.5 min→B 为90% 12 min → B 为 90% 12.5min→ B为3% 停止时间 13 min 后运行时间 1 min 柱温 60°℃ 表2.6495B三重四极杆 dMRM 方法 参数 设置 离子模式 喷射流,正离子模式 气体温度 150°C 干燥气流速 19 L/min 雾化器气体 35 psi 鞘气温度 250°C 鞘气流速 11 L/min 毛细管电压 4000V 喷嘴电压 OV 高/低压力RF 电压 200/110V Delta EMV 200 V Q1和Q3分辨率 Unit/Unit 分析周期 500 ms 最小/最大驻留时间 28.85 ms/60.39 ms 使用 MassHunter 工作站软件和 Skyline软件进行多肽定量的数据分析。 LC-dMRM 方法开发 为评估 HCP 分析的定量分析性能,在酶解之前按 1:1000 (w/w) 的比例将 UPS2蛋白质标准品加入纯化的 mAb 中,使蛋白质浓度介于 0.0004-313 ppm (ng/mg)之间。然后使用 AssayMAP Bravo自动化系统对样品进行变性、还原、烷基化和胰蛋白酶酶解。将该酶解样品在以下实验中用作 mAb 背景基质。根据之前相同加标样品中的 HCP 发现研究,选择三种肽用于目标定量分析,包括与两种 UPS2蛋白质 (SUM01 和 SYHC) 匹配的两种肽,以及一种与内源CHO HCP 蛋白质S100-A11匹配的肽(表3)。对于所有肽, SIL 肽标准品的纯度大于95%。在包含带电荷表面的反相 C18色谱柱上进行9分钟的液相色谱分离。使用MassHunter 和 Skyline 自动化工作流程优化 LC-dMRM 方法(图1)。在此工作流程中,首先在 Skyline 软件中创建目标肽段和离子对。使用安捷伦自动化工具自动创建和执行 MRM 方法和任务列表,以确定多肽保留时间,优化碰撞能量,分析数据并导出最终 LC/MS方法。 目标蛋白质 蛋白质来源 蛋白质浓度(ng/mg) 目标肽段序列 SIL 肽质量(%) 监测离子对(m/z) SUM01_HUMAN UPS2 蛋白质标准品 18.3 LLLEYLEEK 98.2 575.3→1036.6 575.3→923.5 575.3→810.4 575.3→681.3 579.3→1044.6579.3→931.5 579.3→818.4 579.3→689.4 SYHC_HUMAN UPS2蛋白质标准品 2.7 VFDVIIR 96.2 431.3→762.5 431.3→615.4 431.3→500.4 431.3→401.3 436.3→772.5 436.3→625.4436.3→510.4 436.3→411.3 蛋白质 S100-A11(G3HUU6) CHO细胞 无 DPGVLDR 95.1 386.2→656.4 386.2→559.3 386.2→502.3 386.2→403.2 391.2→666.4 391.2→569.3391.2→512.3 391.2→413.2 使用 Agilent Automation 工具通过三个简单步骤自动运行 MRM分析 mAb 基质中 SIL 肽标准品的定量分析在 mAb 背景基质中评估用于定量分析三种 SIL 肽标准品的灵敏度性能。空白进样建立系统清洁度后,对所有浓度进行重复进样(n=7),浓度范围为 6.25 amol/ug 至125 fmol/ug, 每次进样的载样量为 8 pg(表4至表6)。所有目标蛋白质的标准曲线范围从低至亚 ppm 到超过1000 ppm,涵盖了与 HCP 分析相关的较宽范围。确定所有样品(n=56)的保留时间(RT)重现性,以及每种浓度的峰面积重现性和定量分析准确度: 所测试的浓度具有出色的线性,LLLEYLEEK的R²=0.9996, VFDVIIR的R²=0.9983, DPGVLDR的R²=0.9996(图2B至图4B) 所有浓度均表现出出色的精度和准确度,包括定量下限(LLOQ)(表4至表6) 全部三种蛋白质在低浓度下具有高灵敏度, LLOQ低至亚 ppm级(图2A至图4A和表4至表6, SUM01_HUMAN为 0.24 ppm, SYHC_HUMAN 为0.7 ppm, CHO 蛋白质 S100-A11为0.13 ppm) 请注意, SIL 肽 DPGVLDR的背景基质存在一些干扰;即便如此,目标 CHO蛋白质 S100-A11仍获得了0.065 ppm白检测限(LOD) 和 0.13 ppm 的 LLOQ(图4A) 所有56次进样均具有出色的 RT 重现性 (LLLEYLEEK 的 RSD = 0.06%,VFDVIIR 的 RSD=0.07%, DPGVLDR的 RSD=0.32%) 请注意,本实验所用色谱柱的载样量大于8pg²4。因此,如有需要,可柱上进样更高载样量来实现更低的 LLOQ。 表 4. mAb 基质中 SIL 肽 LLLEYLEEK 的精度和准确度 目标蛋白质 SUM01_HUMAN 蛋白质分子量 38815 Da 肽段序列 LLLEYLEEK SIL 肽浓度(amol/pg) %RSD (n=7) %准确度 蛋白质浓度*(ppm) 6.25 17.0 110.3 0.24 12.5 17.3 107.1 0.48 25 10.7 96.8 0.95 62.5 10.5 91.6 2.38 125 5.7 93.8 4.77 250 3.3 91.7 9.53 12500 2.8 100.9 476.45 125000 2.1 99.9 4764.54 *采用 SIL 多肽纯度调整 表 5.mAb 基质中 SIL 肽 VFDVIIR 的精度和准确度 目标蛋白质 SYHC_HUMAN 蛋白质分子量 58233 Da 肽段序列 VFDVIIR SIL 肽浓度 (amol/pg) %RSD (n=7) %准确度 蛋白质浓度*(ppm) 12.5 14.1 98.2 0.70 25 9.9 100.3 1.40 62.5 7.5 83.4 3.50 125 3.3 85.4 7.00 250 4.5 82.4 14.01 12500 2.8 93.7 700.25 125000 3.8 100.7 7002.52 *采用 SIL 多肽纯度调整 表6.mAb 基质中 SIL 肽 DPGVLDR 的精度和准确度 目标蛋白质 蛋白质 S100-A11 (G3HUU6) 蛋白质分子量 11241Da 肽段序列 DPGVLDR SIL 肽浓度 (amol/pg) %RSD(n=7) %准确度 蛋白质浓度*(ppm) 12.5 8.3 106.9 0.13 25 10.8 112.3 0.27 62.5 10.3 102.9 0.67 125 8.7 89.0 1.34 250 7.4 93.2 2.67 12500 1.2 95.3 133.63 125000 0.9 100.5 1336.27 *采用 SIL 多肽纯度调整 ×10? 采集时间 (min) 图2.胰蛋白酶酶解后的 mAb 基质中重型肽标准品 LLLEYLEEK 的定量分析结果。A) 显示出LLOQ的叠加提取离子色谱图。B)标准曲线,插图为 6.25-125 amol/pg的放大图 图3.胰蛋白酶酶解后的 mAb 基质中重型肽标准品 VFDVIIR 的定量分析结果。A)显示出 LOD 和 LLOQ的叠加提取离子色谱图。B)标准曲线,插图为12.5-125 amol/pg的放大图 ×103 图4.胰蛋白酶酶解后的 mAb 基质中重型肽标准品 DPGVLDR 的定量分析结果。 A) 显示出 LOD 和 LLOQ的叠加提取离子色谱图。B)标准曲线,插图为12.5-125amol/ug的放大图 对蛋白质进行绝对定量分析 在生物药物生产过程中监测和调节 HCP杂质浓度。在此过程中,测量目标 HCP的绝对浓度十分重要。只要有合适的参比标样,基于质谱的分析对该应用具有极高的特异性和准确性。采用质谱对蛋白质进行绝对定量的金标准,是在样品处理早期阶段在样品中添加目标蛋白质的 SIL 形式。然而, SIL 蛋白质常常尚未商品化,定制合成可能非常昂贵。含有胰蛋白酶 裂解肽段的氨基酸序列的 SIL 肽已作为替代选择用于蛋白质绝对定量分析。在 SIL肽方法中,选择替代多肽用于蛋白质定量分析。通常在蛋白质酶解后将具有匹配序列的 SIL 肽添加到样品中。该方法不允许对样品前处理过程中可能发生的蛋白质损失进行浓度校正,也不考虑蛋白酶酶解步骤的产率。因此,通过 SIL 肽方法计算的蛋白质浓度通常低于实际蛋白质浓度。 本研究使用 SIL 肽对三种目标蛋白质进行了绝对定量分析。通过与金标准进行比较来评估两种加标蛋白质 SUM01 和 SYHC绝对定量分析的准确度,方法是在样品酶解之前在 mAb 中添加 UPS2 蛋白质标准品。图5显示了mAb 基质中三对轻型肽和重型肽的色谱图,包括 LLLEYLEEK、VFDVIIR 和 DPGVLDR。图6显示加标250 amol/ug 重型 SIL 肽的三对肽中,轻型肽和重型肽的峰面积比较。 图5.使用重型 SIL 肽作为内标对蛋白质进行的绝对定量分析。胰蛋白酶酶解后的 mAb基质中三对监测的轻型肽和重型肽的色谱图,包括 LLLEYLEEK、VFDVIIR 和 DPGVLDR肽 图6.加标250 amol/pg SIL 肽的三个目标肽段的轻型肽和重型肽的峰面积比较 表7. mAb 基质中三种目标蛋白质的加标和测量蛋白质绝对浓度比较 目标蛋白质 SUM01_HUMAN SYHC_HUMAN 蛋白质 S100-A11 (G3HUU6) 蛋白质分子量(Da) 38815 58233 11241 肽段序列 LLLEYLEEK VFDVIIR DPGVLDR 加标蛋白质浓度(ppm) 18.3 2.7 不适用 实测蛋白质浓度(ppm) 10.1 1.2 1.6 表7显示了 mAb 基质中三种目标蛋白质的加标和测量蛋白质绝对浓度比较。在本实验中,内源性 CHO HCP(蛋白质 S100-A11)计算浓度为1.6 ppm;SUM01和 SYHC 蛋白质标准品的加标浓度分别为18.3和2.7 ppm, 其实测蛋白质浓度分别为10.1和1.2 ppm。正如预期,结果证明采用SIL 肽方法测得的蛋白质浓度比实际值偏低(约50%),这与其他报道一致。上述结果表明,当使用SIL 肽方法进行绝对蛋白质定量分析时,为实现准确的绝对定量分析,需要评估蛋白质酶解中目标肽段的回收率。此外,在实验室中保持可重现的样品前处理步骤,对不同样品和不同实验间的绝对蛋白质浓度比较十分重要。用于 LC/MS 样品前处理的 AssayMAP Bravo 及其工具套件可帮助实现这一目标89。 ( 本文展示了用于 HCP 定量分析的安捷伦工作流程解决方案的性能。该解决方案包括: ) ( · 用于样品自动前处理的 AssayMAP Bravo 平台 ) ( 用于多肽分离的1290 Infinity Ⅱ液相色谱系统 ) ( 用于数据采集的6495B三重四极杆系统 ) ( 用于 MRM 方法开发的 Skyline 软件中的自动化工具 ) 用于数据分析的 Skyline 和MassHunter 软件的结合 www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 ( C安捷伦科技(中国)有限公司,2018 ) ( 采用以任务为中心的自动化方案的AssayMAP Bravo 平台为样品前处理自动化带来了前所未有的重现性、可扩展性、灵活性和简便易用性 ) ( Agilent 1290 Infin i ty I液相色谱系统 是新一代超高效液相色谱系统,具有更出色的色谱分离度和保留时间精度 ) ( Skyline 软件和 MassHunter 软件无 缝集成,结合使用安捷伦自动化工具为优化 LC-dMRM 方法提供了简单的解决方案 ) ( 使用 6495B 三重四极杆 LC/MS 证明 了亚 ppm 级浓度 HCP的准确定量 分析 ) ( Skyline 和 MassHun t er 软件的结合 已证明是靶向数据分析的强大工具 ) ( 1. I CH Q6B Specifications: TestProcedures and Acceptance Criteriafor Biotechnological/Biological Products ) ( H ost Cell Protein Analysis UsingAgilent AssayMAP Bravo and 6545XTAdvanceBio LC/Q-TOF (使用 Agilent AssayMAP Bravo 和 6545XT AdvanceBio LC/Q-TOF 分析宿主细胞蛋白质),安捷伦科技公司,出版号5991-9300EN ) ( A gilent Triple Quadrupole LC/MSPeptide Quantitation w ith Skyline (利用 Skyline 进行安捷伦三重四极杆 LC/MS肽定量分析),安捷伦科技公司,出版号5990-9887EN ) ( 4. Separation of Peptide StandardsUsing Formic Acid as a M obile P hase Additive(使用甲酸作为流动相添加 剂分离肽标准品),安捷伦科技公司, 出版号5991-8597EN ) ( 5. Gerber, S. A.; e t al. Absolutequantification of proteins andphosphoproteins from cell lysatesby tandem MS. Proc. Natl. Acad. Sci. USA. 2003 ) ( 6. Oeckl, P .; Steinacker,P.; Otto, M.Comparison o f Internal StandardApproaches for SRM Analysis ofAlpha-Synuclein in Cerebrospinal Fluid. J . Proteome Res. 2018 ) ( 7. Brun, V .; et al . Isotope-labeled protein standards: toward absolute quantitative proteomics. Mol. C ell Proteomics2007 ) ( 8. 自动化液质联用样品前处理:通过 Agilent AssayMAP Bravo 平台实现高 通量溶液内酶解和多肽纯化,安捷伦科技公司,出版号5991-2957CHCN ) ( 9. Automation of Sample Preparation for Accurate and S calableQuantification and Characterization of Biotherapeutic Proteins Using theAgilent AssayMAP Bravo Platform(利用 Agilent AssayMAP Bravo 平台, 通过自动化样品前处理实现生物治 疗蛋白质准确而可扩展的定量和表 征分析),安捷伦科技公司,出版号 5991-4872EN ) 宿主细胞蛋白 (HCP) 杂质是生物药物中低浓度的产物相关及工艺相关蛋白质杂质,来源于生产过程中的宿主生物。由于它们可能影响产品安全性和功效,因此根据法规要求必须对药品中的 HCP 进行监测和控制。传统上,酶联免疫吸附测定法(ELISA) 是定量分析蛋白质治疗药物中 HCP 的标准方法。然而,ELISA 的特异性和覆盖率不足以鉴定并定量分析各种 HCP。因此,LC/MS 技术成为 HCP 分析的另一选择。在 HCP 的 LC/MS 定量分析过程中,主要挑战在于低丰度 HCP 肽段与高丰度药品肽段的共洗脱。因此需要在药品基质的高背景下对低丰度肽进行灵敏而可重现的定量分析。本应用介绍了用于宿主细胞蛋白质高灵敏度定量分析的工作流程,包括用于样品自动前处理的 AssayMAP Bravo 平台、用于样品分离的 Agilent 1290 Infinity II 液相色谱系统、用于数据采集的 Agilent 6495B 三重四极杆系统、用于 MRM 方法开发的 Skyline 软件中的安捷伦自动化工具、用于数据分析的 Skyline 和 Agilent MassHunter 定量分析软件的结合。使用基于多反应监测 (MRM) 的同位素稀释方法,结果显示可准确定量低至亚 ppm(ng/mg) 浓度的 HCP。
确定






还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《生物药物中宿主细胞蛋白质杂质检测方案(移液工作站)》,该方案主要用于治疗类生物药品中理化性质检测,参考标准--,《生物药物中宿主细胞蛋白质杂质检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1290 Infinity II 液相色谱系统、Agilent 6495B 三重四极杆液质联用系统
相关方案
更多
该厂商其他方案
更多