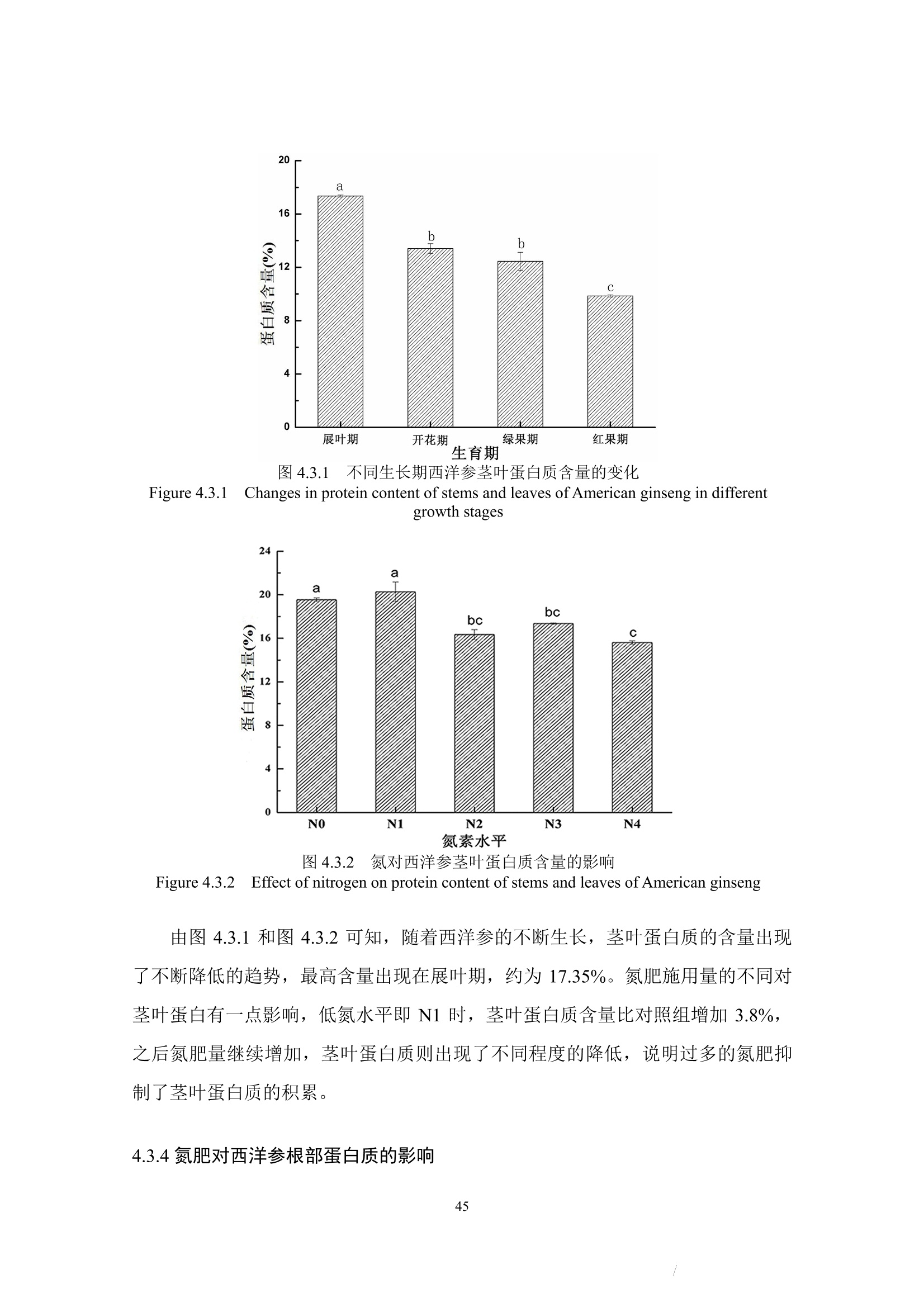
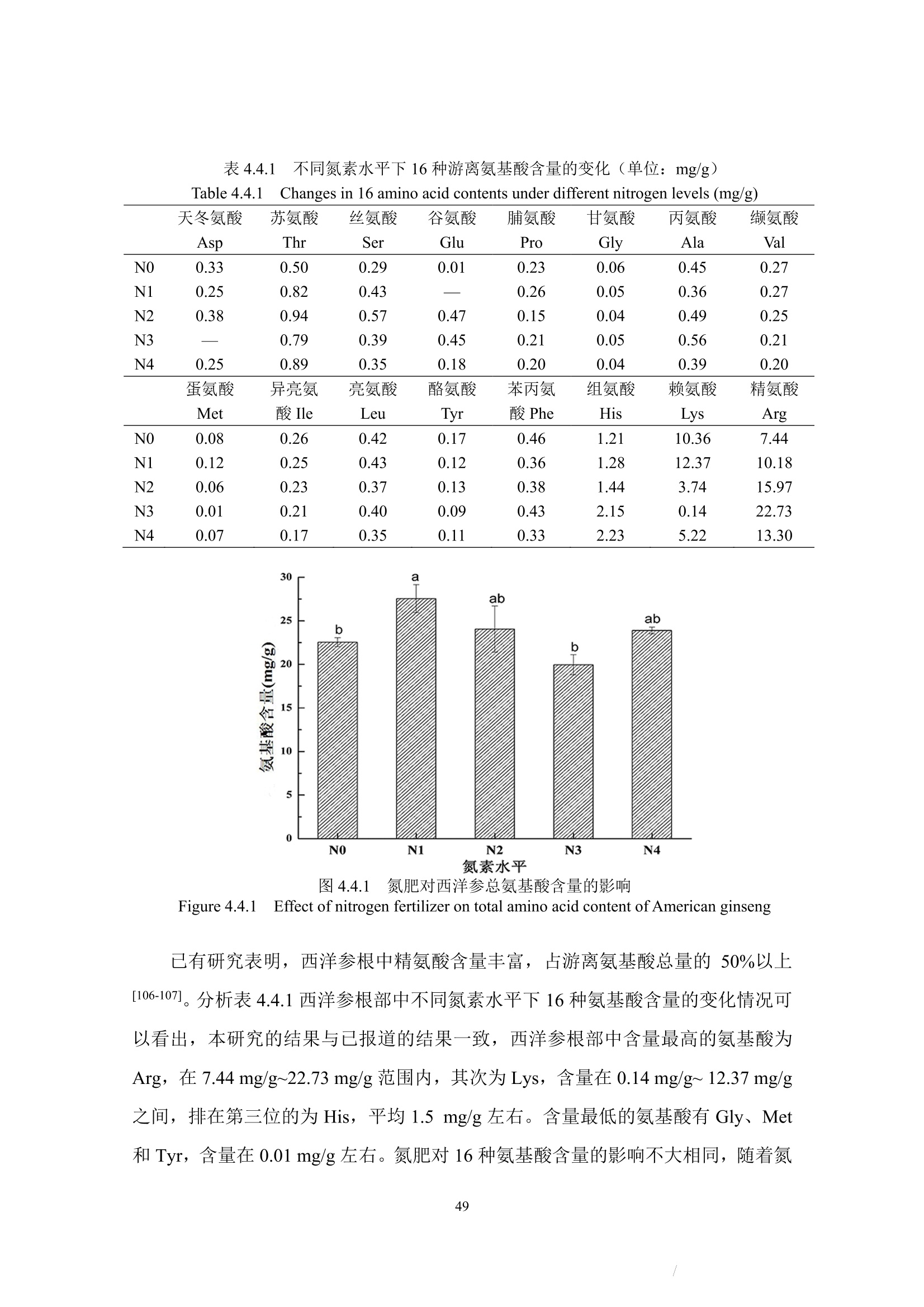
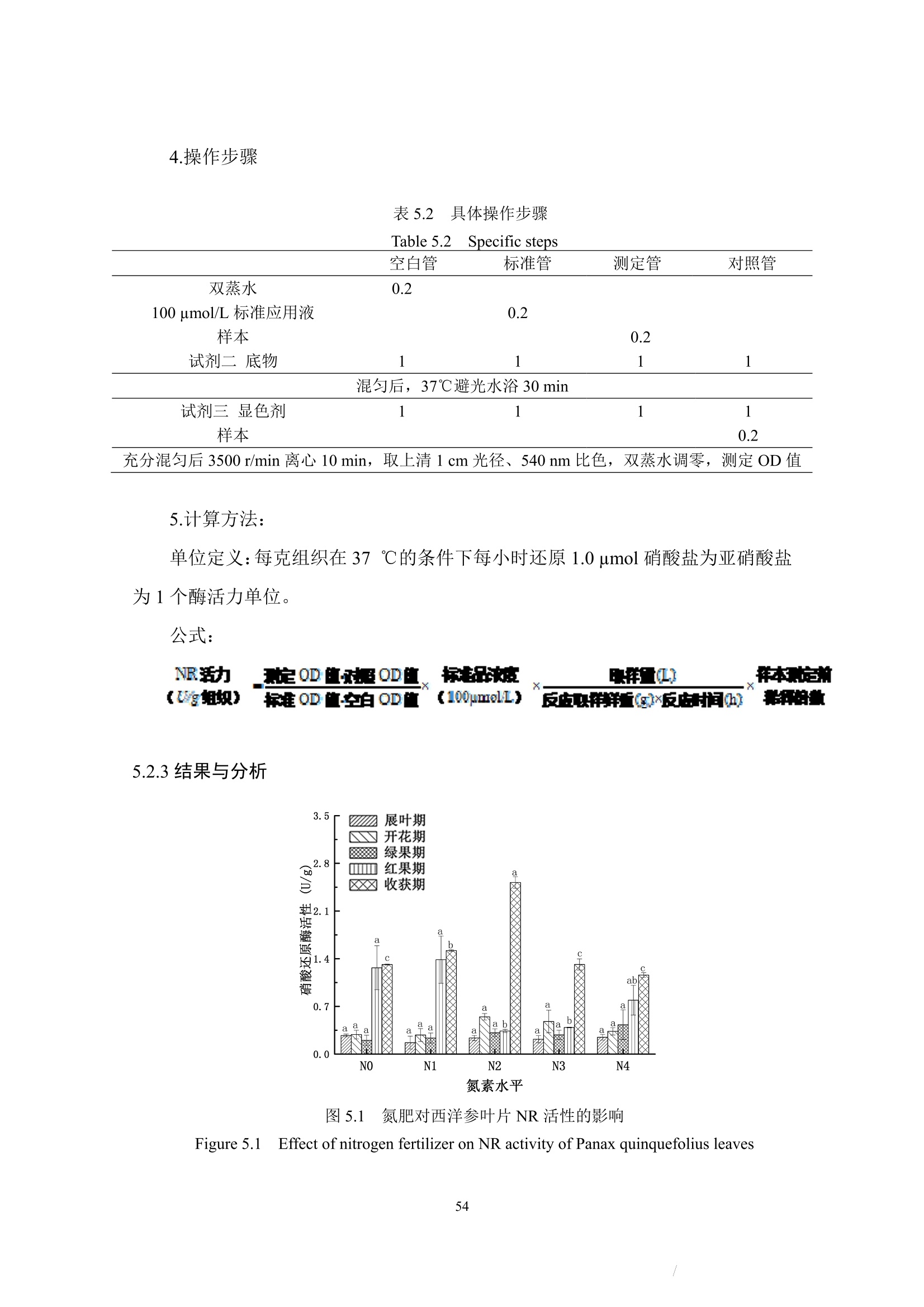
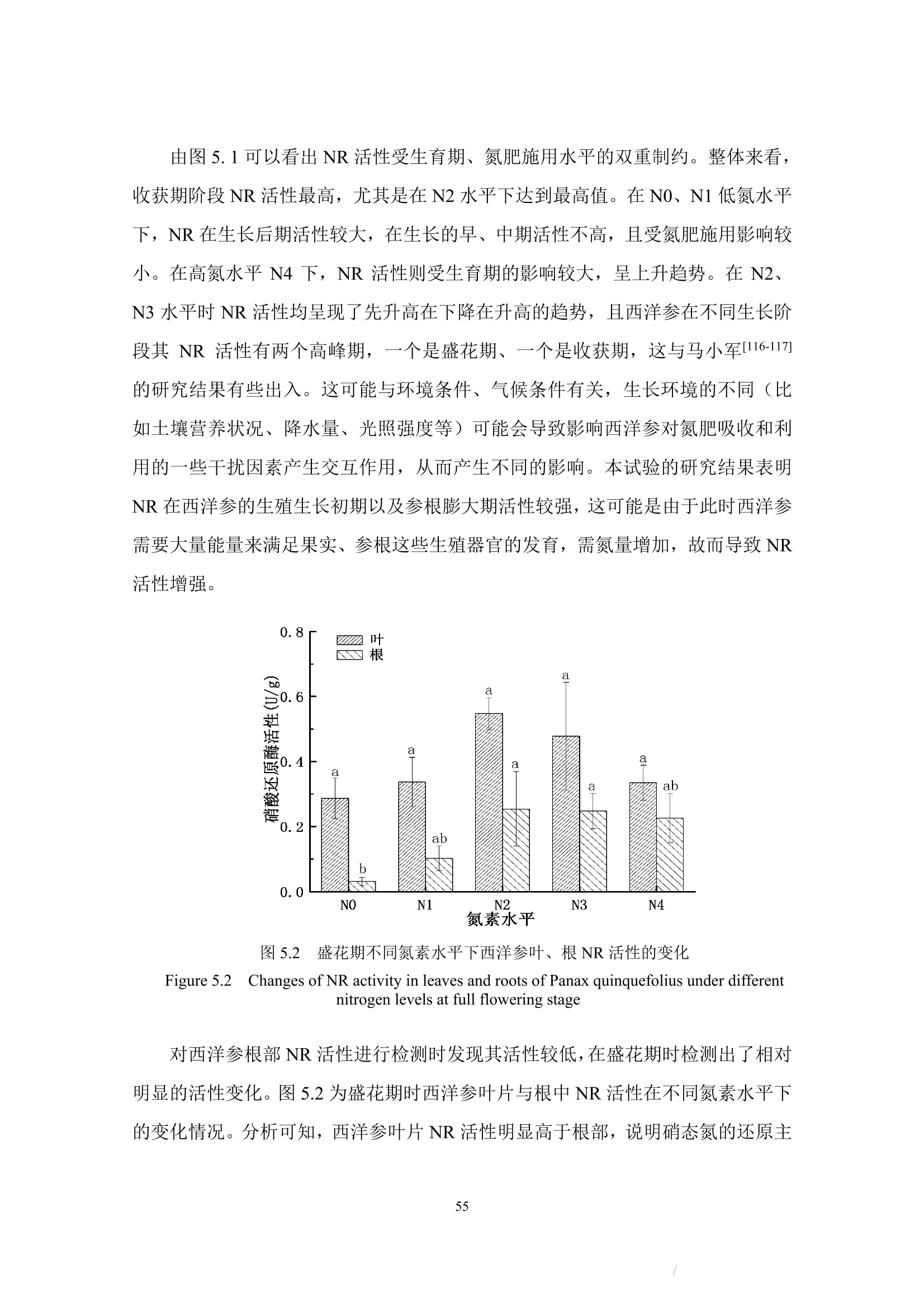
本节着重讨论了氮肥施用量对西洋参展叶期及收获期的蛋白质含量影响,及植株体内蛋白质含量受生长期时期的影响。
方案详情

学校代码:10205 研究生学号:2016000024 分类号::Q94 密 级:公开 寿師範大学 硕士学位论:文 氮肥对西洋参生长及硝酸盐积累的影响 Effects of Nitrogen Fertilizer on Growth and Nitrate Accumulationof American Ginseng 学科专业:生物学 研究方向:功能分子生物学 学位类型:学术硕士 作者姓名:曹欣欣 指导教师:李刚教授立义卢丞文副教授 培养单位:生命科学学院 二○一九年六月 独 创 性声 明 本人郑重声明::所提交的学位论文是本人在导师指导下独立进行研究工作所取得的成果。据我所知,除了特别加以标注和致谢的地方外,论文中不包含其他人已经发表或撰写过的研究成果。对本人的研究做出重要贡献的个人和集体,均已在文中作了明确的说明。本声明的法律结果由本人承担。 学位论文作者签名:营 日期:20196.14 学位论文使用授权书 本学位论文作者完全了解长春师范大学有关保留、使用学位论文的规定,即:长春师范大学有权保留并向国家有关部门或机构送交学位论文的复印件和电子版,允许论文被查阅和借阅。本人授权长春师范大学可以将学位论文的全部或部分内容编入有关数据库进行检索,可以采用影印、缩印或其它复制手段保存、汇编本学位论文。 (保密的学位论文在解密后适用本授权书) 作者签名:曹食导师签名:2文日 期:219.6.4日 期:2n9.6.14 学校代代:10205研究生学号:2016000024分类类:Q94密 级:公开 氮肥对西洋参生长及硝酸盐积累的影响 Effects of Nitrogen Fertilizer on Growth and Nitrate Accumulationof American Ginseng 学科专业:生物学 研究方向:功能分子生物学 学生类别:学术硕士 作者姓名:曹欣欣 指导教师:李 刚 教 授卢丞文 副教授 培养单位:生命科学学院 答辩日期:2019年6月5日 摘 要 氮素是植物生长必需的大量营养元素之一,缺乏时会严重影响植物的正常生长,但氮肥施用过多也会给作物乃至土壤、水源环境等带来一定的危害。近年来随着人们生活水平的提高,西洋参的需求量不断增加,为了有效提高西洋参产量,合理施用氮肥成为西洋参的农田栽培的必要措施之一。同时氮素也是植物体内硝酸盐积累的主要因素之一,硝酸盐的过度积累会给植物的食用安全性带来潜在的风险。为了探讨西洋参是否也存在硝酸盐污染的情况,对不同氮肥施用量下西洋参体内硝酸盐的积累情况进行研究也十分必要。本研究选用两年生的西洋参幼苗为材料进行田间栽培试验,氮肥施用量设置了5个梯度水平,以期探讨不同氮肥水平对西洋参农艺性状、产量、有效成分的影响,了解西洋参的需氮规律,确定适宜施氮量,为农田栽参合理科学施肥提供依据。还通过研究氮肥对西洋参体内硝酸盐积累的影响,了解氮肥用量与硝酸盐积累的关系,确定西洋参体内硝酸盐含量的积累情况,为西洋参食用药用安全性评价提供更多理论依据。本研究主要取得以下研究结果: 1..确确定两年生西洋参洋适宜施氮量为 N2 水平即10 g/m², 此时西洋参产量达107.58 g/m²,两年生西洋参收获期时可溶性总糖含量为 15.12%,果糖、葡萄糖、蔗糖、麦芽糖的含量分别达到0.3%、0.59%、7.16%、2.70%,9种皂苷总量达 3.80%,蛋白质含量为8.65%,16种主要氨基酸含量为 2.40%,硝酸盐含量为 14.74 mg/kg。 2..两年生西洋参各个生育期的叶面积、叶重、茎高、茎重、根长、根径、根重以及 SPAD、光合速率,随氮素水平的提高呈现先升后降的变化规律,在N2水平时出现最高峰,,且达到显著性差异(P<0.05)。 3..两年生西洋参收获期茎叶中,有效成分含量随氮肥用量的增加呈现先升高后降低的趋势,,可溶性总糖在N1 时有最大值13.49%,上比对照组增加31.40%,差异显著;总皂苷含量在N1 水平时达到峰值,为10.35%。 4.两年生西洋参收获期参根中,可溶性总糖在N1、N2水平的含量较高,分 别比对照组NO 显著增加 25.40%和 24.24%,持续增加氮素含量则会明显降低可溶性总糖的积累;总皂苷在N2 时出现最大值,含量为4.34%,比对照组增长18.29%,但差异不显著;蛋白质含量在较低氮素浓度时含量变化不明显,含量在 9g/100g 左右,在 N4 高氮水平下积累量显著降低;随氮素水平的提高,氨基酸含量出现不同程度的增加,其中N1水平增加量最多,比对照组显著增加22.19%。 5.两年生西洋参收获期体内硝酸盐的积累随氮素水平的提高出现不同程度的增加,硝酸盐含量变化范围为 14.37mg/kg-32.92 mg/kg,,亚硝酸盐含量变化范围为 0.94 mg/kg-1.47mg/kg. 16..根据波兰农产品中农药残留风险评估方法对三年生西洋参中硝酸盐残留进行慢性暴露评估,发现西洋参中硝酸盐、亚硝酸盐的HQ分别为 0.04%和0.06%,远远低于100%,说明西洋参中硝酸盐、亚硝酸盐不存在慢性健康风险,具有食用安全性。 关键词:西洋参;氮;有效成分;硝酸盐 Abstract Nitrogen is one of the essential nutrients elements for plant growth, and nitrogendeficiency can seriously affect the normal growth of plants. However, excessiveapplication of nitrogen fertilizer can bring certain harm to crops, soil and water sourceenvironment. In recent years, with the continuous improvement of people s living, thedemand of American ginseng has been increasing. To increase the yield of Americanginseng effectively, the rational application of nitrogen fertilizer is one of the effectmeasures to improve the yield and quality of American ginseng farmland cultivation.At the same time, nitrogen is also one of the main factors for nitrate accumulation inplants, and excessive accumulation of nitrate may bring potential risks to food safety.In order to investigate whether there is nitrate pollution in American ginseng, it isnecessary to study the accumulation of nitrate in American ginseng under differentnitrogen application levels. In this work, two year American ginseng seeding have beenchoose for the field test, and five nitrogen levels were set to explore the influence ofnitrogen fertilizer rates for agronomic traits, yields and active ingredients. And thiswork was used for understanding the nitrogen requirement law of American ginseng todeterminate the optimal nitrogen application amount, and providing the basis forscientific fertilization of American ginseng cultivation. Moreover, the effect of nitrogenfertilizer on the accumulation of nitrate in American ginseng was studied to understandthe relationship between the nitrogen fertilizer amount and the nitrate accumulation, toprovide more theoretical basis for the safety evaluation of American ginseng in foodand medicine fields. This work mainly achieved the following research results: 1. N2 level of 10 g/m’was determined to be the optimal nitrogen level with theyield about 107.58 g/m² for the two-year-old American ginseng. The total solublesugar content was 15.12%, and the fruit, grape, cane and maltose was 0.3%, 0.59%, 7.16% and 2.70%, respectively. The total content of 9 saponins was 3.80%, the proteincontent was 8.65%, the content of 16 main amino acids was 2.40%, and the nitratecontent was 14.74 mg/kg. 2. The leaf area, leaf weight, stem height, stem weight, root length, root diameter,root weight, SPAD and photosynthetic rate of the two-year-old American ginseng atdifferent growth stages showed the tendency to rise first and then fall with the increaseof nitrogen level, and they reached the peak at N2 level, the difference was significantat the level of P<0.05. 3. The content of active constituents in the stems and leaves of the two-year-oldAmerican ginseng during the two-year-old harvest increased first and then decreasedwith the increase of nitrogen fertilizer dosage. The total soluble sugar had a maximumof 13.49% at N1 level, which was 31.40% higher than the control group, and thedifference was significant. The total saponin content peaked at the N1 level, which was10.35%. 4. In the two-year-old American ginseng root, the content of soluble total sugarwas significantly increased by 25.40% of N1 and 24.24% of N2 compared with N0,but significantly decreased by increased nitrogen levels; The total saponins reached amaximum content at N2 about 4.34% increased by 18.29% compared with NO, butwith no significant difference; The protein content reached about 9g/100g with slightchanges at a low nitrogen level, but the accumulation was significantly reduced at ahigh nitrogen level of N4; The different increased degrees of amino acids were presentwith the increase of nitrogen level, and the highest increase value shown at N1 by22.19% compared with the control level N0. 5. The accumulation of nitrate in two-year-old American ginseng increased todifferent degrees with the increase of nitrogen levels. The variation range of nitratecontent was14.37-32.92 mg/kg, and the variation range of nitrite contentwas 0.94-1.47 mg/kg. 6. According to the risk assessment method of pesticide residues in Polishagricultural products, the chronic exposure of nitrate residues in three-year-oldAmerican ginseng was assessed. It was found that the HQ of nitrate and nitrite inAmerican ginseng was 0.07% and 0.11% respectively, which was far less than 100%.This indicated that there was no chronic health risk of nitrate and nitrite in Americanginseng and it was safe to eat. Key Words: American Ginseng; Nitrogen Fertilizer; Active Ingredient; Nitrate 目 录 摘 要 Abstract .... 第1章文献综述.... 1.1西洋参简述. 1 1.2氮对药用植物的影响 2 1.3硝酸盐...... 3 .第2章课题研究背景、意义及内容. 7 .2.1研究背景..... .7 2.2研究目的与意义 .8 2.3研究内容......· 9 第3章氮肥对西洋参生长的影响 12 3.1材料及方法... 13 3.2结果与分析. .114 .3.3小结与讨论. 20 .第4章氮肥对西洋参质量的影响].. 22 .4.1氮肥对西洋参糖含量的影响. 22 .4.2氮肥对西洋参皂苷含量的影响. .333 4.3氮肥对西洋参蛋白质含量的影响l... .44 4.4氮肥对西洋参游离氨基酸含量的影响 48 第5章氮肥对西洋参硝酸盐积累的影响........ .51 5.1氮肥对西洋参硝酸盐含量的影响... .551 .5.2氮肥对西洋参硝酸还原酶活性的影响 53 5.3硝酸还原酶与硝酸盐的关系.... 56 5.4小结与讨论...... 56 结论与展望. 59 参考文献. .62 附录A色谱图..... 69 在学期间公开发表论文及著作情况... .771 致 谢...... .72 第1章文献综述 1.11西洋参简述 西洋参(Panax quinquefolium)又称为洋参、花旗参、广东人参、美国人参等,收载于《中国药典》当中,2015版药典定义西洋参为五加科植物西洋参的干燥根。西洋参作为我国传统进口大宗药材,原产于加拿大和美国[1-2],约分布于北纬30°~48°,东经67~125°的针阔叶混交林下[3-5]。西洋参是宿根植物,忌地性很强,不能重茬连作,需光但怕强光,需水但怕大水,需温但怕高温,喜欢湿润温和的气候条件6],此生长习性与原产于我国的人参极为相似。 西洋参由于其较高的药用价值被誉为“绿色黄金”,最早收录于清康熙三十三年(1694年)汪昂所著《补图本草备要》的增补项中,在我国己经拥有近300年的药用历史[7-8]。为了满足日益增长的消费需求,有效地避免进口依依,我国从1975年开始对西洋参进行大规模的引种,截至目前西洋参在我国的种植区域已覆盖了吉林、黑龙江、辽宁、北京、山东等地。我国成为了继加拿大、美国之后的第三大西洋参产区I9-10],更是世界上最大的西洋参消费市场。其中位于吉林省的靖宇县是我国东北地区最大的西洋参种植基地,1,享有“西洋参之乡”的美誉。 西洋参具有很高的药用价值和保健价值,很多医书文献都对其功效进行了较为详细的论述,譬如吴仪洛在《本草从新》中记载:“补肺降火,生津液,除烦倦。虚而有火者相宜。”张锡纯所书的《医学表中参西录》记载:“西洋参性凉而补,凡欲用人参而不受人参之温补者,皆可以此代之。”此外在《本草纲目拾遗》《本草再新》《医方集解》 《药性考》等著作中也均有记述。西洋参与我国原产的人参同科同属不同种,具有很近的亲缘关系, 者在功能上虽有相似但还存在一些差异。西洋参性凉、味苦、微甘、入肺胃二经,功能补阴、生津、安神、止渴。而人参属温补,凡需人参但不适于温补者均可用西洋参代替。西洋参作为补药之上品,其优点在于补气养阴、润养五脏的同时,无温燥上火之弊,即补而不燥、 扶正祛邪、攻补并施[11]。 现代药理分析表明西洋参中的有效成分比较复杂,含有皂苷类、氨基基类、挥发油类、糖类、有机酸及酯类等[4,12-13]多种活性成分,无论药用还是保健都具有非常高的潜在价值。已有临床实验证明西洋参能提高人体的智力与体力,能够降低人体疲劳度,调节中枢神经系统功能;能增强机体免疫力,具有抗肿瘤、抗辐射的作用,可减轻癌症患者放射治疗和化学治疗引起的副作用;能够清除自由基,具有抗衰老、抗氧化的作用[2,13-14]。 随着有效成分及药理作用的不断挖掘,西洋参越来越受到人们的青睐,现已广泛应用于药品、保健、临床医疗以及食品、饮品当中。需求量的不断增加让西洋参的研究重点转移到科学栽培上,利用科学合理的种植管理技术来提高西洋参的产量与质量,解决当前西洋参需求量日益增加、质量要求日益严格的问题。 1.2氮对药用植物的影响 氮是植株生长发育所需的大量营养元素之一,是构成核酸、蛋白质、酶、叶绿素、某些维生素、生物碱及激素的重要组成成分,因此植株对氮素的需求量远远高于其他的元素[15]。其中核酸作为植物生长发育基础物质,氮含量高达15%~16%。在细胞中蛋白质与核酸结合形成核蛋白,核酸与核蛋白在植物的生长及遗传变异中有重要作用。蛋白质是生命存在的物质基础,平均含氮16%左右,蛋白氮占植株全氮的80~85%。植物生长过程中的细胞增长分裂以及新细胞的形成都需要蛋白质的参与,因此蛋白质还被称为“生命元素”。植物干重的20%~30%为叶绿体,其作为植物进行光合作用的场所,含蛋白质量为45%~60%。叶绿素直接影响光合作用速率和光合产物的形成,对植物的生长具有及其重要的作用。酶类作为一种特殊的蛋白质是植物体内生化作用和代谢过程中的生物催化剂,参与植物体内多种生物化学反应,并对反应的方向和速度有主导作用。氮素还是某些维生素如 B1、B2等的重要组分[16]。 氮素作为植物体的必需组成元素,在氮素缺乏时,植物体内含氮有机物的合 成受阻,细胞的伸长和分裂受到抑制,从而导致:蛋白质合成受阻,植物矮小,生长缓慢;叶绿素含量下降,出现叶片黄化;光合作用减弱,致使光合产物减少,严重影响生长发育并降低作物产量。氮肥施用量过多时则会抑制植物的生长或造成烧苗现象。因此,氮素在植物的生命活动中占有首要的地位,是植物生长、产量形成的首要限制因素,同时制约着农产品的质量[17]。 我国是世界上药用植物资源最丰富的国家之一。目前,由中国中医科学院中药资源中心作为技术支撑单位的第四次全国中药资源普查工作正在紧锣密鼓地全面开展[18-19]。据第三次全国中药资源普查的结果统计,我国拥有的各类药用植物资源占中药总资源的87%,共11146种[20-22]。近年来,随着人民生活水平的不断提高和中医药产业的快速发展,中药资源消耗剧增,药用植物的需求量在不断增加,药用植物资源的科学开发和利用已经成为农业、医药、食品等行业发展的重中之重。我国中药资源种类虽然丰富,但野生中药资源依然短缺,高达80%的中药材依然靠着采挖野生资源来满足市场需求[21]。大部分野生药用植物资源经过长时间的掠夺性采挖,资源在不断缩减,甚至出现了枯竭[23]。因此药用植物的栽培是实现药用植物资源可持续利用的有效途径之一,而目前我国大约仅有40%的药材供应是依靠栽培品种[24]。施肥作为栽培管理的核心,是提高药用植物产量与质量的有效措施之一。氮代谢是一切生命活动的物质基础,因此合理施用氮肥对提高药用植物的产量质量十分重要[25]。 近几年来,大量学者研究了不同供氮水平对多种药用植物如天门冬[26-27]、广藿香[28]、长春花[29-30]、车前草[31]、药菊[32]、三七[33]等的生长及产质量的影响,结果显示,氮素水平对药用植物生长及品质的形成具有显著影响。还有学者从氮素形态角度出发,研究了氮的不同形态对药用植物的影响[16,27,34-36],也充分的证明了氮在药用植物栽培中所发挥的重要作用。 1.3硝酸盐 氮在自然界中广泛存在于空气,水和土壤这三种基本生物系统中。硝酸盐是 一种通过氧化氮所形成的无机阴离子,是水和土壤中氮素循环的重要组成部分,在空气中它的浓度却较小。硝酸盐是植物生长发育过程中的主要无机氮源,是一种植物必需营养元素,,它最终被植物代谢形成植物蛋白。每当空气,水和土壤这些生物系统中的任何一个被扰乱时,硝酸盐就会在水,土壤或者植物当中积聚。硝酸盐在环境中的积累造成了潜在的公共卫生危害和环境污染。 1.3.1硝酸盐危害 动物的硝酸盐毒性主要来源于摄入饲料和水中的硝酸盐,1895年堪萨斯州的梅奥报告的动物硝酸盐毒性案例通常被认为是硝酸盐毒性最早的真实和详细的说明[371。1945年,爱荷华州的 Comly 首次记录了人类的硝酸盐中毒情况[38]。据研究,硝酸盐本身对人体无害或者危害性极低,但摄入体内的硝酸盐在胃和肠道内可被硝酸还原菌还原为具有毒副作用的亚硝酸,从而危害人体健康[39]。正常情况下,人的胃液pH 值为1~3,强酸性环境能够有效地抑制硝酸还原细菌生成,避免了体内硝酸盐到亚硝酸盐的转化。但是当食物中硝酸盐的含量超过安全标准或者胃酸缺乏时,胃液的酸性减弱,硝酸还原细菌数量增加,活性也增强,便可将大量的硝酸盐还原成对人体有害的亚硝酸盐。亚硝酸盐对人体的危害主要包括以下几个方面:(1)直接毒性很强,摄入0.3 g~0.5 g的亚硝酸盐便可引起人体中毒,食入量超过3g便可直接导致中毒死亡;(2)强氧化性,亚硝酸盐进入血液后能将亚铁血红蛋白氧化生成高铁血红蛋白,使其失去输送O2的功能,造成人体缺氧,从而出现高铁血红蛋白症;;(3)胃中形成的亚硝酸盐在酸性条件下转化为亚硝酸,从而与人体次生代谢产生的仲胺或酰胺发生亚硝化反应,生成N-亚硝基化合物亚硝胺或亚硝酰胺,这些化合物在体内累积从而诱发消化系统癌症[40-41],(4)亚硝酸盐具有抗甲状腺素的功能;可使平滑肌松弛,造成血管扩张,从而导致血压下降;(5)会干扰机体对维生素A 的利用,出现VA缺乏症;可导致血脂下降,心跳过速;(6)会影响淋巴细胞活性和抗体的分泌,从而抑制体液和细胞的免疫功能等。在临床中一些常见疾病,如脑膜炎、败血症等,亚硝酸盐的浓度可作为生物标志来确定患者的健康状况[39]。 1.3.2硝酸盐积累机理 植物积累硝酸盐是其生长过程中的自然现象。NO3~和 NH4*是能被植物利用的最主要氮源。植物体内硝酸盐积累量则主要取决于硝酸盐在植物体内的吸收、转运和同化还原的生理过程。 土壤中的 NH4*部分在土壤微生物的硝化作用下转化为硝态氮,大部分被植物根系通过截获和扩散两种方式被动吸收。其吸收同化所需能量要小于硝态氮同化吸收所需能量。土壤中 NH4*被植物根吸收,并在根细胞中快速同化为氨基酸,最后运输到向地上部分供应植物生长需要。这其中 GS/GOGAT循环(谷氨酰胺合成酶, GS;谷氨酸合成酶, GOGAT)是植物体内NH4*同化的主要途径, GS 对 NH4*具有很高的亲和力,能够显著影响植物对硝酸盐的同化速率。 植物可主动吸收土壤中存在的 NO3,此过程需要能量与 ATP 酶的参与。NO3通过表皮进入皮层共质体后,小部分被同化为植物生长所需要的的基酸、蛋白质;而大部分则以 KNO3形式由木质部运输到植物的地上部分,参与各种生理代谢;过量的 NO3则在液泡中积累或者重新分配,有研究表明液泡是植物积累 NO3的主要场所。NO3不能直接被植物利用,需要在植物体中进一步转化成铵态氮,供植物同化利用,该过程需经过 NO3 还原和氨同化两个步骤。第一步,在细胞质中发生硝酸还原酶酶促反应: NO3在硝酸还原酶(NR)作用下还原成 NO2; 第二步,在叶片的叶绿体或根的质体中发生亚硝酸还原酶酶促反应: NO2在亚硝酸还原酶(NiR)的作用下转化为 NH4*。而后产生的氨与呼吸作用生成的α-酮酸在 GS 和 GOGAT作用下生成谷氨酰胺和谷氨酸,并经过进一步的生化反应生成多种氨基酸,用于核酸、蛋白质等高分子氮化物的合成。硝酸还原酶是整个NO3 同化过程的的第一个酶,也是限速酶,它催化 NO3 转化为 NO2 。有研究认为较高的硝酸还原酶活性有利于硝酸盐的还原,并降低硝酸盐积累水平。然而硝酸还原酶活性和NO3的吸收会受到细胞内 NO3与NO2的诱导、调节,同时也遭到 NH4*与氨基酸的抑制作用。 1.3.3氮对硝酸盐积累的影响 造成硝酸盐积累的因素有许多,其中施肥是最主要的外源因素之一。以往关于硝酸盐积累的研究主要集中于蔬菜当中,已有实验表明人体内摄入的硝酸盐70%~80%来自于蔬菜[42],蔬菜中硝酸盐的含量与化学氮肥施用量呈正相关。王朝辉[43]等人利用盆栽试验研究施氮量对蔬菜中硝酸盐积累的影响,其结果显示,蔬菜中硝态氮含量随氮肥施用量的增加而增加,并且其增长量远高于蔬菜生长量的提高。陆正松[44]等人总结了不同区域中芹菜、大白菜、青菜三种蔬菜中硝酸盐含量与施肥的关系,证明了蔬菜中 NO3 含量随氮肥施用量增加而增加的正相关关系。在氮肥用量相同时,氮的不同形态也可导致植物体内硝酸盐积累量的不同。卢凤刚[45]等人研究指出,韭菜内硝酸盐的积累随着硝铵比溶液铵态氮的增加而不断减少。贾长青[46]等人也发现,总氮源供应相同条件下,不同氮素形态及配比对红花芽菜中硝酸盐的积累存在差异。 1.3.4硝酸盐的限量标准 植物体内硝酸盐的含量与人体的健康有着极为密切的关系。世界卫生组织(WHO)与联合国粮农组织(FAO)1973年规定人体硝酸盐日允许摄入量为 3.6mg/kg,亚硝酸盐的日允许摄入量为 0.13 mg/kg[42,47]。在此基础上,食品中污染物限量国家标准(GB 2762-2012)[48]中规定亚硝酸盐(以 NaNO2计)限量为蔬菜及其制品≤4mg/kg,腌渍蔬菜≤20 mg/kg, 乳及乳制品≤2 mg/kg, 粮食≤3 mg/kg,矿泉水≤0.1mg/L等;硝酸盐(以 NaNO3计)限量为:矿泉水≤4 mg/L, 特殊膳食食品中婴儿配方食品≤100 mg/kg, 婴幼儿灌装辅助食品≤200 mg/kg。对于中药材中硝酸盐及亚硝酸盐的报道比较少见,且目前还未对中药材中硝酸盐及亚硝酸盐限量标准进行制定。 第2章课题研究背景、意义及内容 2.1研究背景 中药鲜食在我国拥有着悠久的历史,早在《神农本草经》就有著录,鲜药为传统中医药的一大特色。许多医家都对鲜药特殊而确切的药理作用给出了中肯的评价[49-50]。鲜药保持了药材的天然药性,比传统的干品中药活性成份更加齐全[51]、药效高而且见效快;;另一方面,鲜药比西药毒副作用低、不易伤脾胃、抗药性小且不易反复,对疑难杂症、危急重症的治疗有着特殊作用。大量鲜药的临床应用形成了“中药鲜用”的观点[52-55]。随着现代临床的发展,鲜药用于疾病治疗的种类越来越多,鲜药的特殊功效也逐渐被人们所知晓[56],中药鲜用已经成为了一种临床趋势。西洋参作为传统中药的代表,由于其明显的医药保健效果,很早便有“鲜用”的案例[57]。由于鲜西洋参没有经过加工,保留了西洋参本身的天然成分,有效的避免了以往加工过程中挥发油和生物酶等活性物质的流失,减少了由加工诱发的西洋参蛋白质的变性和水解[58]。张建逵[59]等人对此进行了实验分析与验证,他比较了鲜品和干品两种西洋参中的维生素C、维生素 E、蛋白质、超氧化物歧化酶(SOD)、挥发油几种物质的含量差异,结果表明,鲜品西洋参中的含量明显高于干品。在中医临床试验中的研究表明,!鲜食西洋参可有效地克服睡眠障碍、改善亚健康状态、有效降低“三高”,还有助于调理脾胃[51]。目前,由于保鲜技术不成熟,西洋参鲜食仍旧面临很大的难题,鲜参也只能在每年的收获期短期供应,现今市场上销售的西洋参仍以干品为主[60]。西洋参鲜参的产量与品质、食用安全性等问题愈发受到人们的关注。 自1998年国务院制定并实施了退耕还林政策,并明令禁止随意伐林栽参以来,我国西洋参的种植主要采取农田栽培的方式。施肥则是提高西洋参产量与质量的最直接有效的措施之一。氮是除碳、氢、氧外在植株体内含量较多的生命元素之-,是构成核酸、蛋白质等活性成分的重要组成元素,也是生命活动中催化、调 节、供能等活动的主要成分,可有效提高作物的生物产量。近年来,随着西洋参需求量不断增加,为提高产量,一些参户在种植过程中出现了盲目施肥的现象,特别是氮肥施用存在着不合理性。氮肥施用过多不仅会影响西洋参的产量以及质量,还会改变土壤有效成分含量,影响地下水,使其硝酸盐含量升高,从而影响人畜用水安全。因此,研究科学有效的西洋参施肥方案十分重要。合理科学的施氮量不仅可以有效增加西洋参的产量,还能大大提高西洋参的质量,为参农节约了成本的同时还带来巨大的经济效益,此外对资源与环境也起到了一定的保护作用。 此外,氮肥施用也是植物积累硝酸盐的主要原因之一。硝酸盐本身对人体毒害性相对较低,但其在人体中经过代谢产生亚硝酸盐,N-亚硝基化合物会严重危害人体健康。且有研究表明经常食用亚硝酸盐和硝酸盐含量较高的食品会使人们患肠胃癌、高铁血红蛋白症等疾病的概率上升。为有效避免亚硝酸盐危害,世界各国都建立了关于食品中亚硝酸盐含量的限量标准。目前关于食品中对硝酸盐及亚硝酸盐的含量变化研究主要集中于叶类蔬菜中,对中药材中硝酸盐和亚硝酸盐的含量变化规律的研究报道较少。庞小存[61]等测定了黄芩、金银花等中药材中的硝酸盐与亚硝酸盐的含量。此外她[62]还利用离子色谱法分析了不同产地、不同品种、连作后中药丹参中亚硝酸盐和硝酸盐含量,并对影响丹参中亚硝酸盐和硝酸盐积累的因素进行了探讨。作为大宗中药材的西洋参,施氮是否会带来硝酸盐及亚硝酸盐的污染残留不得而知。出于对鲜食西洋参的食用安全性考虑,对西洋参中硝酸盐含量积累的研究很有必要。 2.2研究目的与意义 本课题通过研究不同氮肥水平对西洋参农艺性状、产量、有效成分的影响,了解西洋参的需氮规律,确定适宜施氮量,为农田栽参合理科学施肥提供依据,不仅能够有效提高西洋参的产量,同时也使其质量得到保障。合理的施肥一方面能为参户创收,让有限的土地资源发挥巨大的经济利用价值;另一方面减少了氮 肥滥施的现象,降低了生产成本也保护了环境、土地资源。 另外本课题还通过研究氮肥对西洋参体内硝酸盐积累的影响,了解氮肥用量与硝酸盐积累的关系,确定西洋参体内硝酸盐含量的积累情况,为西洋参食用药用安全性评价提供更多理论依据。 2.3研究内容 2.3.1试验地概况及试验设计 (1)试验场地与材料 试验安排在参王植保有限公司的抚松参厂,土壤肥力状况见表2.1。 表2.1 供试土壤的肥力状况 Table 2.1 Fertility status of the tested soil 全氮(g/kg) 水解性氮(mg/kg) 有效磷(mg/kg) 速效钾(mg/kg) 有机质(g/kg) 碳氮比 2.86 301.9 45.98 202 59.11 22.29 试验参地前期配套处理措施:深翻地一次,按床宽1.7 m,长15m顺山坡作床,床高30 cm,共5串。菌肥用量:每五平米2斤恩地有机肥+5斤益生元菌肥+2斤苏子饼+10%辛硫磷颗粒。菌肥施用时与适量的土混在一起洒在土地上。 供试样品为两年生西洋参,购于参王植保有限公司,经吉林省农业科学院李刚教师鉴定为西洋参。供试氮肥为尿素(含N46%),磷肥为重过磷酸钙(含P2O546%),钾肥为硫酸钾(含K2O50%)。 (2)试验设计 田间试验采用随机区组设计,小区面积5m²,固定磷、钾用量(重过磷酸钙100 g/m²,含P量为 46%;硫酸钾 50 g/m²,含K量按50%计算),设5个施氮水平,分别为0、5、10、20、40 g/m², 用N0、N1、N2、N3、N4表示,每个水平设5次重复,/小区分布图见表2.2,各处理施肥量见表2.3。在4月末栽参前施肥,施肥方式为表面撒施,将肥料拌细土混匀后施用,其他田间管理与当地生产 相同。西洋参种植采用棚下栽参的方法,故施肥后开始架设棚架,采用拱形透光棚,拱形棚拱顶距床面高110 cm~120 cm, 在化冻前搭好棚架,然后上好蓝色棚膜。斜栽不存在土壤表面径流的现象,为保证实验的准确性各小区间用20 cm宽的塑料薄膜进行阻隔。 表2.2 试验分布图 Table 2.2 Test distribution map 床1 床2 床3 床4 床5 N4-3 N3-3 N1-4 N2-5 N4-1 N3-1 N4-5 N2-3 N1-3 N0-4 N1-1 N0-5 N3-5 N4-4 N2-2 N0-2 N2-1 N4-2 N0-3 N3-4 N2-4 N1-2 N0-1 N3-2 N1-5 注: Na-b指的是第a个N水平的第b次重复。 表2.3 试验各处理施肥量 Table 2.3 Tests for each treatment 处理 施肥量(g/m²) N P K N0 46 25 N1 46 25 N2 10 46 25 N3 20 46 25 N4 40 46 25 2.3.2测定指标与方法 样品采集与处理:分别于展叶期、开花期、绿果期、红果期以及收获期进行SPAD 测定与样品采集,每小区随机选取5棵参样,,小铲深挖,用手将参根取出。洗净晾干后对根重、根长、根径、茎高以及叶片的长宽进行测量。其中3/5参样分 为茎叶、根,105℃下杀青 30 min 后,在65℃烘箱内烘干至恒重,用微型粉碎机分别粉碎过100目筛,作为待测样品,以备后续有效成分的检测。剩余2/5的样品冻于-80℃的冰箱中,以备后续硝酸盐含量的检测。 生长指标:根长、茎高以及叶片的大小使用直尺测量;根径使用游标卡尺测定:单株根重、茎重以及叶重采用电子天平测定。 光合指标:叶绿素值用 SPAD 仪测定;光合速率用光合速率仪测定。 有效成分:氨基酸采用氨基酸自动分析仪进行检测; 可溶性总糖采用苯酚-浓硫酸比色法测定,,/小分子糖(果糖、葡萄糖、蔗糖、麦芽糖)采用高效液相色谱检测;皂苷(Rg1、Re、Rb1、Ro、Rc、Rb2、Rb3、Rd、F11)前八种采用超高效液相色谱, F11采用高效液相色谱检测;;蛋白质采用杜马斯定氮仪检测。 硝酸盐与亚硝酸盐采用流动分析仪测定。 硝酸还原酶现取现测,使用南京建成的硝酸还原酶试剂盒完成检测。 2.3.3统计分析 所有试验数据均采用 Excel2003、 SPSS 22.0、Origion 等软件进行统计、方差分析、显著性检验及图表绘制。 第3章氮肥对西洋参生长的影响 施肥是调控作物生长发育的一项基本措施,通过改变植物生长所需的土壤微环境来影响植株体内的生理代谢。氮素是植物生长发育所需的主要大量营养元素之一-,是植株生长和产物生成的主要驱动力。氮作为含氮有机物核酸、蛋白质、叶绿素等的重要组成成分对植物各营养器官生长、根冠发育、叶绿素含量、光合效率以及叶绿素荧光参数等具有重要的影响[27,63-65]。 在植物的生长发育过程中,缺氮阻碍细胞生长及分裂,影响含氮有机物的合成,,从而抑制其生长发育和体内活性成分合成,是造成作物产量和品质下降的重要原因。氮素过多同样也会抑制植物的生长,严重时会造成烧苗等生理性病害,同样影响植物的产质量。因此,合理施肥才可以在维持植物正常生长的同时也提高植物的品质。西洋参引种成功后,人们在西洋参对氮素的吸收机制、存在形态及对植物生长发育的影响方面进行一些相关的研究。陈光、李向高[66]通过15N-示踪微区试验,研究了西洋参氮素营养特性。结果表明15N-尿素在西洋参各器官均有分布,,参株从肥料中吸收氮素(NDFF%)含量地上部各器官高于地下部。施氮肥与未施氮肥处理的收获参根干重为 28.89%和21.82%;施氮肥增加了参根蛋白氮和非蛋白氮的含量,并约有80%15N分配到参根蛋白白中。赵扬景[67]等通过在土培和水培实验研究了西洋参对 NH4*和 NO3 的吸收利用及其在体内的分布特点。结果表明,在水培条件下西洋参从芽苞萌动到叶片展开即可吸收肥料N, 并表现出喜铵现象。两种栽培条件下,植株对NH4*的吸收量比对 NO3的吸收可高出1倍以上,并且肥料N在茎叶中的分布高于在根中的分布;在根生长时期,植株对两种形态的肥料 N 均能很好地吸收利用,此时肥料在根中的分布高于在茎叶中的分布。土培西洋参植株当年吸收的总 N量80%以上来自于土壤,5%左右来自肥料,其余由母根供给。因此,培肥土壤和培育壮根是提高西洋参产量和质量的重要途径。孙贺5]通过测定不同年生、不同时期西洋参根及其根际土壤中大量元素和含量变化情况,为西洋参在实际田间生产上提供了施肥的理论依据。结果显示,西洋参生长 过程中应重视低年生施肥;不同年生西洋参应在出苗展叶期至开花期前期施肥,N、P、K按1:0.67:2配施;各年生西洋参萌动后体内N、P、K含量迅速下降,在枯萎期达到含量的第二个高峰;在西洋参生长的整个期间里,不同参龄西洋参每千克干物质所含N、P、K 的量随着参龄的增加而递减。杜静[68]等进行了水培实验,研究了氮、磷、钾元素缺乏对西洋参根系分泌物中具有自毒作用的酚酸类化合物的影响,得出结论氮、磷、钾的缺乏可导到西洋参根系分泌物中的酚酸发生不同变化。 然而近年来,随着西洋参需求量不断增加,为提高产量在生产上出现了肥料滥施、偏施现象,特别是氮肥施用存在着不合理性。氮肥的滥用不仅会影响西洋参的产量以及质量,还会改变土壤有效成分含量,影响地下水,使其硝酸盐含量升高,从而影响人畜用水安全。因此,研究科学有效的西洋参施肥方案仍然十分重要。本课题通过研究不同氮肥水平对西洋参生长、叶绿素含量的影响,探索西洋参农田栽培的合理施氮量,为西洋参优质高产提供理论依据和技术参考。 3.1材料及方法 3.1.1试验材料与设备 供试样品:全生育期采集的新鲜西洋参 仪器:游标卡尺、直尺、电子天平、SPAD-502叶绿素测定仪、Li-6400 光合作用测定仪。 3.1.2试验方法 根长、茎高以及叶片的大小使用直尺测量;根径使用游标卡卡测定;单株根重、茎重以及叶重使用电子天平测定;叶绿素含量用 SPAD-502 叶绿素测定仪测定的 SPAD 值表示;光合速率使用 Li-6400 光合作用测定仪测定。 3.2结果与分析 3.2.1氮肥对西洋参各时期生长指标的影响 根重、根径、叶面积等是植物生长最表观的指标,可以直观并且充分地反映西洋参生长的状况以及氮肥对西洋参生长的影响。 表3.1 不同氮素水平对西洋参根生长的影响 (mean±SEM, n=5) Table 3.1 Effect of different nitrogen levels on the growth of American ginseng(mean±SEM,n=5) 生育期 氮水平 根重/g 根径/mm 根长/cm 展叶期 NO 3.30±0.21b 9.04±0.20bc 19.70±0.22a N1 4.25±0.23a 9.28±0.44ab 19.72±0.33a N2 4.64±0.38a 10.23±0.24a 20.26±1.24a N3 4.11±0.24a 10.13±0.26a 20.04±0.24a N4 2.65±0.15b 8.28±0.43c 19.53±0.75a N0 3.47±0.13c 9.66±0.46bc 19.30±0.77a 开花期 N1 4.48±0.06b 10.18±0.27ab 19.72±0.62a N2 5.55±0.33a 11.04±0.21a 19.28±0.58a N3 4.15±0.19b 10.36±0.24ab 18.90±0.18a N4 2.98±0.32c 9.09±0.50c 18.76±0.42a NO 5.24±0.20b 9.94±0.44b 18.60±0.67a 绿果期 N1 5.63±0.24b 10.24±0.22b 18.80±0.88a N2 6.67±0.30a 12.94±0.70a 19.04±0.47a N3 5.50±0.62b 11.07±0.45b 19.00±0.46a N4 4.87±0.20b 10.55±0.27b 18.58±0.61a N0 9.24±0.19b 11.61±0.39c 18.68±1.32a 红果期 N1 11.49±0.38a 11.80±0.19c 19.10±0.45a N2 11.60±0.51a 15.30±0.25a 19.78±0.50a N3 8.50±0.18b 13.08±0.60b 19.56±0.48a N4 6.36±0.41c 11.03±0.10c 18.76±0.16a N0 5.65±0.13d 11.30±0.10c 16.26±0.44b 收获期 N1 9.58±0.30b 12.35±0.23b 17.80±0.37a N2 10.83±0.64a 15.08±0.34a 18.42±0.92a N3 7.42±0.10c 11.61±0.30c 17.58±0.43ab N4 5.67±0.25d 11.08±0.20c 16.40±0.70b 注:小写字母表示不同氮素水平处理间差异达显著水平, P<0.05,后同。 表3.2 7不同氮素水平对西洋参地上部分生长的影响 (mean±SEM, n=5) Table 3.2 Effect of different nitrogen levels on the growth of the aerial part of American ginseng (mean±SEM, n=5) 生育期 氮水平 茎重/g 茎高/cm 叶重/g 叶面积/cm² NO 1.29±0.03b 12.26±0.42b 0.83±0.05b 32.31±1.02b 展叶期 N1 1.48±0.09ab 12.56±0.24b 0.86±0.05ab 35.77±2.29b N2 1.62±0.04a 15.52±0.97a 1.04±0.07a 56.28±4.85a N3 1.46±0.20a 15.40±0.67a 0.98±0.15a 41.43±4.77b N4 0.95±0.07c 12.70±0.21b 0.91±0.04a 34.37±2.25b N0 1.54±0.04a 17.14±0.31a 2.02±0.03b 57.03±3.90c N1 1.78±0.15a 17.90±0.39a 2.20±0.08b 60.90±3.51bc 开花期 N2 1.80±0.12a 15.66±0.41b 3.26±0.15a 92.33±1.60a N3 1.74±0.02a 15.30±0.40b 2.19±0.10b 68.54±2.86b N4 1.03±0.11b 13.70±0.21c 2.07±0.15b 58.00±2.97c NO 1.63±0.06a 15.86±0.36ab 2.56±0.10c 69.69±4.43cd N1 1.70±0.09a 16.40±0.42a 2.67±0.15c 71.31±3.03bc 绿果期 N2 1.83±0.10a 16.36±0.57a 4.49±0.24a 95.12±4.15a N3 1.77±0.18a 15.30±0.25ab 3.35±0.13b 80.78±2.24b N4 1.19±0.13b 15.18±0.31b 2.64±0.03c 60.18±4.06d N0 1.61±0.08a 15.86±0.41ab 1.71±0.19b 55.50±2.89b N1 1.25±0.08b 16.66±0.24a 1.81±0.08b 59.84±3.20b 红果期 N2 1.08±0.03c 15.94±0.68ab 3.05±0.08a 98.74±1.85a N3 0.96±0.04c 15.98±0.24a 1.01±0.05c 59.80±2.49b N4 0.52±0.02d 14.78±0.24b 0.93±0.12c 48.73±6.70b N0 0.19±0.02b 13.94±0.38c 0.25±0.04b 22.28±3.14b 收获期 N1 0.68±0.07a 15.84±0.29b 0.56±0.05ab 42.82±5.59a N2 0.69±0.07a 17.44±0.58a 0.68±0.31a 53.67±10.85a N3 0.32±0.04b 15.10±0.48bc 0.41±0.13ab 42.41±0a N4 0.21±0.02b 14.38±0.52c 0.33±0.06ab 注:叶面积为复叶面积。 对表3.1和表3.2进行分析,r,西洋参在生长过程中其根重的变化范围为2.65g~11.60 g, 各生长期参根重量均随着施氮量的增加先升高后降低,在施氮量为 N2时重量最高,红果期 N2 比同期对照组参根重量增加 25.54%,收获期的 N2 比对照组增重91.68%,在0.05水平下有显著性差异。参根重量最大值出现在红果期的 N2 水平,为11.60 g,,比收获期的最高值10.83g高出7.11%,且整个红果期的参根重量在各氮素水平中均达到最高值。 根径的变化范围在8.28 mm~15.30 mm,与根重的变化趋势一致,在N2水平到达各生育期的最高值,经方差分析结果显示有显著性差异。收获期的 N2 根径比对照组 NO 高出 33.45%。最粗根径依旧出现在红果期的N2 水平,为15.30 mm,比收获期 N2 的15.08 mm 高出1.46%。收获期与红果期各水平的根径很相近。 西洋参的参根长度在整个生育期内的变化范围为 16.26 cm~20.26 cm,虽然根长随氮素水平的不断提高有先升后降的趋势,但并没有显著差异。且随着生长的不断进行,根长没有出现明显的增长,反而有轻微的降低现象,,故而猜测两年参西洋参参根的生长主要集中在根径以及须根的发育上。可能由于收获期较晚,并伴随着病虫害现象以及轻微烂根现象的缘故,西洋参收获期的参根长度明显短于红果期。 茎的重量随氮素含量变化的规律除红果期外,其他生长期随氮的增加所呈现的趋势是先升高后降低, N2 水平下有最高值。红果期茎的重量是随氮的增加而直线下降的,经差异性分析在0.05水平下差异显著。收获期的茎重明显低于其他水平。 茎高随氮肥施用量的增加呈现先上升后下降的趋势,但不同生长期出现最高值的氮素水平有所不同,展叶期、收获期的最高值出现在 N2水平,而开花期、绿果期及红果期的最高值出现在 N1 水平。展叶期茎高N2 水平比对照组 NO 高出26.59%,开花期N1比 N0高出4.43%,绿果期N1 比N0 高出 3.40%,红果期N1比 N0 高出5.04%,收获期 N2 比 N0 高出 25.11%。 叶面积的变化范围较大,在22.28 cm²~98.74 cm²之间。不同生长期呈现相同的变化规律,即随氮素水平的增加叶面积先增大后减小,在 N2 水平时叶面积有最大值。红果期 N2 水平叶片面积比对照组远远高出 77.91%,差异性极其显著。此外开花期、绿果期及红果期的叶面积明显高于展叶期和收获期,这是由于展叶期叶片刚刚萌发并没有全部展开,而收获期时叶片出现了枯萎的现象。 叶片重量的变化范围在 0.25 g~4.49 g, 与叶片面变的变化规律相一致。可能是由于在绿果期也就是果实膨大期植株需要更多的营养物质,通过叶片进行储存与运输,绿果期的叶片重量高于其他时期。该时期N2水平的叶重高出对照组75.39%,差异性显著。 图3.1 不同氮素水平下西洋参长势情况Figure 3.1 Growth of American ginseng under different nitrogen levels 图3.1为不同氮素水平下西洋参的长势情况图,从图中可以看到,适当增施氮肥有助于西洋参植株的生长,氮肥过多时会产生抑制。N2 水平下西洋参长势情况明显优于其他水平,与前边生长指标数据的分析结果一致。 综上所述,在西洋参的整个生长过程中,随着氮肥水平的不断增加,根重、根径、茎重、茎高、叶重以及叶面积这几个生长指标呈现先升高后降低的趋势,而且各指标绝大部分在 N2 水平也就是施氮量为10 g/m²时达到最高点, N0 与 N4各指标数据偏低,说明不施氮和施氮过多均不利于西洋参生长或者说是对其生长产生抑制。单从西洋参的生长状况来看, N2水平最适宜西洋参的生长。 3.2.2氮肥对西洋参各时期叶面 SPAD 值的影响 氮素是对作物的生长发育、产量水平、品质和光合特性的改善等方面影响最为敏感的营养元素[69-72]。研究表明,施氮量跟作物叶片叶绿素含量成正比I73],而 叶绿素计(SPAD-502)是一种测量作物叶片叶绿素相对含量高低的仪器,因此叶绿素计可以监测作物叶片片素含量的高低[74]。这种仪器以叶绿素对红光和近红外光的不同吸收特性为原理来测定植物叶片的相对叶绿素含量,我们可以通过叶绿素与叶片全氮的关系来得出作物的氮营养状况,进而确定作物角否缺氮[75-76]。 表3.3 不同氮素水平对西洋参叶片 SPAD 值的影响(mean+SEM, n=15) Table 3.3 Effect of different nitrogen levels on SPAD values of American ginseng leaves(mean±SEM, n=15) 开花期 绿果期 红果期 N0 37.93±0.78b 38.83±0.54b 32.26±0.79b N1 39.33±1.54b 40.15±0.41a 32.99±0.52b N2 39.19±1.20b 40.73±0.57a 35.83±0.45a N3 42.47±0.77a 40.32±0.37a 35.15±0.51a N4 40.77±1.02ab 39.03±0.32b 31.88±1.00b 表3.3可以看出, SPAD 值得范围在 31.88~42.47,不同生育期随着施氮量的不断增加,西洋参叶片 SPAD 值呈先升后降的趋势,绿果期和红果期均在N2 时达到最高值,开花期在N3时最高。开花期的最高 SPAD 值42.47比 N0 组高 11.97%;绿果期在 N2 水平下的最高值40.73比对照组高4.89%;;红红果期时最高 SPAD 值为35.83,比对照组 NO的 32.26高出11.07%,比高氮水平 N4 高出12.39%。i说明氮肥施用量的不同对叶片 SPAD 有显著的影响,适当增加施肥量可提高叶片 SPAD值,但当施肥量过多时反而会降低 SPAD, 这可能是过多的氮素不利于叶绿素的合成所造成的。本试验的五个氮素水平中, N2 能有效提高叶片的 SPAD值,为适宜施肥量。 3.2.3氮肥对西洋录绿果期叶面光合速率的影响 光合作用在植物生理特性的研究中占有重要地位,而光合速率是衡量绿色植物光合作用强弱的一个重要指标。光合速率的大小可用单位时间、单位叶面积所吸收的二氧化碳或释放的氧气表示,亦可用单位时间、单位叶面积所积累的干物质量表示。植物的光合作用用于产生其生长所需的有机质和化学能,故而光合速 率在很大程度上决定了作物的产量与质量。 图3.2不同氮素水平下西洋参叶片光合速率的变化 Figure 3.2 Changes in photosynthetic rate of Panax quinquefolium leaves under differentnitrogen levels 图3.2为绿果期时不同氮素水平下西洋参叶片光合速率的变化,由图可知,氮肥施用量对西洋参的光合速率会产生一定影响。西洋参叶片的光合效率随着施氮量的增加先升高后降低。N2水平下光合效率最高,达到5.59 umolm.s-1, 相比于比对照组 NO 的提高了16.96%,但差异不显著。 3.2.4氮肥对西洋参产量的影响 图3.3 不同氮素水平下西洋参产量的变化 Figure 3.3Changes in the yield of American ginseng under different nitrogen levels 由图3.3可以看出,随着氮素水平的不断提高,西洋参的产量呈现先升后降的变化规律,N2时产量最高为107.58 g/m², 比对照组每平米增产51g,且经过显著性分析 P<0.05,差异显著。适当增加氮肥用量,可在确保较高出苗率的同时提高参根的重量,进而对西洋参的产量有显著性提高。在本试验中,可确定N2即施氮量10g/m²为适宜施肥量。 3.3小结与讨论 通过研究不同氮素水平对西洋参各生长性状的影响结果得出以下结论: 1.两年生西洋参的生长指标(叶面积、叶重、茎高、茎重、根径、根重)随着氮素水平的不断提高,呈现了先升高后降低的趋势,大多数都在施氮量为10 g/m²的N2水平时达到最高值,绝大部分有显著性差异。以红果期为例,适宜施氮量N2比对照组叶面积增加77.91%,叶重增重75.39%,茎高增长0.5%,根长增加5.89%,根径提高31.78%,根重增长25.54%。说明适当的增加氮肥用量,, 1可以明显提高西洋参叶面积、叶重,与多年生草本植物生姜的研究结形一致[77]。氮肥适量时,植株生长旺盛,每片叶的生活期和进行光合作用的功能都较长,从而光合产物增多。营养物质合成量的增加,进一步促进了西洋参根部的生长,根径、根重都得到相应的增长。由于收获期收获较晚,出现了不同程度的病虫害以及烂根 现象,使得收获期的根部生长状态低于红果期的参根。因此,在合理施用氮肥促进西洋参生长的同时,应注意采收期时间,防止病虫害、冻害、烂根等对西洋参产生不利的影响。 2.西洋参光合作用指标(SPAD、光合速率)随着施氮量的增加而升高, N2 水平时达到最高,随后又随着的氮的增加而下降。以绿果期研究结果为例, N2 水平时 SPAD 值为40.73,比对照组高出4.89%。相应地,光合速率也比对照提高了16.96%,这有效提高了西洋参生长所需的有机质与能量的合成,与叶片及根部表观性状的变化一致。 3.两年生西洋参收获期产量随施肥量增加呈现先升高后降低的变化规律,NN2水平即施氮量为 10 g/m²时,西洋参产量最高,达107.58 g/m²,远远高于对照组产量。适量增加施氮量能显著增加西洋参产量,肥量过多过少均不利于西洋参的产量的增加,反而会降低。红果期的参根重在不同施氮水平下均大于收获期,红果期的最高参重为 11.60 g,比对照增重25.54%。为避免自然灾害等对西洋参生产带来的不利影响,适当提前收获时间更能提高西洋参的产量。 第4章氮肥对西洋参质量的影响 西洋参作为珍贵的药用资源,具有极大的药用、保健价值。随着现代科学技术的发展,人们对西洋参药理作用的研究不断地深入,经大量研究表明西洋参起到主要药理作用的有效成分为皂苷、多糖、氨基酸等,且多种有效成分在根、茎叶中都大量存在,但各部位所含有效成分的种类和含量都有所不同[13,78-82]。其中皂苷类药理活性最为明显,皂苷具有抗疲劳、增强免疫力、提高学习能力等作用,也是西洋参最为珍贵的活性成分。氮肥在为西洋参增产的同时是否也会提高其有效成分含量,从而提高西洋参质量则还需进一步的研究。本研究旨在通过调控西洋参栽培过程中的氮肥用量来有效的提高西洋参中有效成分的积累,为西洋参的品质的提升提供理论基础,避免施肥过程中不必要的资源浪费,单因素的氮肥试验也可以为其他西洋参增产增质的研究提供准确可信的数据参考。基于此目的,我们着重研究了氮肥用量对西洋参中糖、皂苷、蛋白质积累的影响。 4.1氮肥对西洋参糖含量的影响 4.1.1实验材料与设备 实验材料:过100目筛干燥西洋参粉末,果糖,葡萄糖,蔗糖,麦芽糖,苯酚,浓硫酸,乙腈。 实验设备:离心机,振荡器,水浴锅,超声萃取仪,紫外分光光度计,西班牙KONIK 的 HPLC 560 (type B)。 4.1.2实验方法 样品待测液的制备:取2.3.2中制备的样品粉末0.1g, 精密称定(精确到0.001g),置于 25 mL 具塞试管中,加10 mL水振荡器摇匀,超声提取30 min,10000 r/min离心10分钟,取上清液待测。 可溶性总糖对照品溶液制备:精确称取50 mg D-无水葡萄糖,用水定容至50 mL 备用。 糖标准贮备液制备:经过96±2℃干燥2h的果糖、葡萄糖、蔗糖、麦芽糖各精确称取0.5g(精精至0.001g),加水定容至 50 mL 容量瓶中,待测。 可溶性总糖测定:分别取可溶性总糖对照品溶液0,0.1,0.2,0.4,0.6,1mL以及样品待测液0.1 mL 置于25 mL 具塞试管中,加水至10 mL,之后分别加入5%苯酚1mL 和浓硫酸5mL,振荡器混匀,于35℃水浴锅中水浴 30 min, 在490 nm 吸测吸光度值A。可溶性总糖标准曲线如图4.1.1所示。 100 图4.1.1可溶性总糖吸光度的标准曲线 Figure 4.1.1 The standard curve of absorbance of soluble total sugar. 果糖、葡萄糖、蔗糖、麦芽糖的测定:分别取糖标准贮备液 50 uL, 250 uL,500 uL,1000 pL,2500 pL 置于 50 mL 容量瓶中加水定容,制备成浓度为 10 pg/mL,50 ug/mL, 100 ug/mL, 200 ug/mL, 500 ug/mL 的标准液。分别取1 mL 样品待测液和糖标准液过 0.45 u.m 微孔滤膜至样品瓶,供液相色谱分析。色谱条件:流动相为70%的乙腈,流速为1.0mL/min,柱温40℃,进样量 10 uL。方法学考察结果显示精密度、重复性和稳定性良好,标准曲线R≥0.99。糖标准液色谱图如图4.1.2所示。 图4.1.2 果糖、葡萄糖、蔗糖、麦芽糖标准液高效液相色谱图 Figure 4.1.2 High performance liquid chromatogram of fructose, glucose, sucrose andmaltose standard solutions 注:1是果糖;2是葡萄糖;3是蔗糖;4是麦芽糖 4.1.3氮肥对西洋参茎叶糖积累的影响 氮素水平 图4.1.3 氮肥对西洋参茎叶中果糖含量的影响 Figure 4.1.3 Effect of nitrogen fertilizer on fructose content in stems and leaves of Americanginseng 由图4.1.3可以看出,西洋参茎叶中果糖含量受生育期影响比较大,大体呈现先增高再降低的变化趋势,且以绿果期果糖含量最高。进一步对各个生长时期不同氮素水平下的果糖含量变化进行详细的比较分析,结果表明:展叶期西洋参茎 叶果糖含量在N2时最高,比对照组增加8.95%,但差异不显著。开花期随着氮肥施用量增加,茎叶中果糖含量并没有出现上升趋势,反而出现不同程度的降低,N3 含量最低,降低了 25.91%,差异显著。绿果期与红果期茎叶果糖含量受氮肥的影响均呈现先增高在降低的趋势,红果期最为明显。红果期N2水平果糖含量最高,比对照组含量高出23.05%,可可见合理施氮有助于红果期茎叶果糖含量的积累。收获期由于地上部分枯萎严重,导致茎叶中果糖含量急剧降低。合理施用氮肥,适当安排地上部位的采收时期,可以实现西洋参茎叶中果糖含量的高效积累。 图 4.1.4 氮肥对西洋参茎叶中葡萄糖含量的影响 Figure 4.1.4 Effect of nitrogen fertilizer on glucose content in stems and leaves of Americanginseng 由图4.1.4可以看出,在不施加氮肥的情况下,西洋参茎叶中葡萄糖的含量随着生长时期的变化呈现先增高再降低的趋势,且以绿果期葡萄糖含量最高。分析比较同一时期氮肥施用量对茎叶中葡萄糖积累的影响,结果表明:展叶期茎茎中葡萄糖含量氮肥影响较小,基本维持在5.2%~6.2%之间。开花期则出现了随氮量增加葡萄糖含量先下降后上升的趋势, N3 水平时含量最低。绿果期在不同氮素水平下葡萄糖含量基本保持稳定,含量在6.9%~7.1%之间。红果期葡萄糖变化规律与开花期相反,含量先升高后下降,在N2时含量最高,但差异不显著。收获期葡萄糖含量则随追施氮量不同出现不同程度的降低, N2 含量下降程度最大,降低了 76.93%。总之,施氮量的不同对不同生育期中茎叶葡萄糖含量的影响也不同,这可能由各时期生长的气候环境及植株生长所需能量的不同所带来的差异。 图4.1.5 氮肥对西洋参茎叶中可溶性总糖含量的影响 Figure 4.1.5 Effect of nitrogen fertilizer on soluble total sugar content in stems and leaves ofAmerican ginseng 由图4.1.5可以看出在氮水平较低时,西洋参茎叶中可溶性总糖含量会随着生长时期先降低再升高再降低的变化趋势,且在绿果期是可溶性总糖含量最高。高氮水平呈现倒“V”型变化规律。同时期比较结果为:展叶期,低氮浓度对西洋参茎叶可溶性总糖含量的影响较小,只有在过度的氮肥使用情况下才能出现了可溶性总糖积累含量降低的现象, N3、N4试验组分别比对照组降低了13.98%和 14.67%,差异显著;开花期,随着氮量的不断提高茎叶可溶性总糖含量呈现了不断上升的趋势, N4 时达到最大值,高出对照组含量 28.97%;绿果期,可溶性总糖含量则表现为先升后降的规律,在N1时有最高值19.69%,高出NO即对照组6.43%;红果期、收获期的规律与绿果期相同,红果期是在N2 水平下达到最高值14.50%,,比对照高出15.86%,而收获期在N1时有最高值13.49%。 4.1.4氮肥对西洋参根部糖积累的影响 图4.1.6 氮肥对西洋参根部果糖含量的影响 Figure 4.1.6 Effect of nitrogen fertilizer on fructose content in roots of American ginseng 从图4.1.6中可以看出,西洋参根中果糖含量较少,在0.15%~1.16%之间。氮水平较低时,纵观西洋参的整个生长过程,参根部果糖含量在红果期最高,其次是展叶期,而N3、N4水平下则是展叶期和绿果期的含量较高。不同施氮量下,展叶期与开花期果糖含量变化呈现“V”型规律,最低含量分别为 0.45%和 0.28%。绿果期时,氮素的增加对根部果糖积累影响较小,在低、中氮量下果糖含量基本维持在0.46%~0.49%之间。整体来看,增加氮肥的施用量并不能有效的提高西洋参根部果糖的积累量,相反的,在红果期时西洋参根中果糖含量随施氮量的增加呈显著的下降趋势。收获期时参根果糖含量虽有明显的先升后降的趋势,但该时期的总体含量明显低于红果期。 2.4 图4.1.7 氮肥对西洋参根部葡萄糖含量的影响 Figure 4.1.7 Effect of nitrogen fertilizer on glucose content in roots of American ginseng 由图4.1.7可以看出,西洋参根中所含葡萄糖含量较少,大致在0.48%~2.08%范围内。生育期对参根中葡萄糖含量影响较大,不同施氮量下各时期的葡萄糖含量大致呈现先升高后降低的变化规律。从同一生长期不同氮素水平的角度分析,各生育期所呈现的变化规律不大相同。展叶期与收获期时,葡萄糖含量基本维持在0.60%左右,氮素的增加对参根葡萄糖含量的积累没有产生影响。开花期、绿果期以及红果期,随氮的增加葡萄糖含量先升高后降低,开花期在 N2 时有最大值0.97%,绿果期也是在 N2 时达最高含量1.37%,,而红果期在 N1时有最大含量2.08%,分别比同期对照组 N0 高出 64.35%, 49.98%,42.50%,差异性显著。且红果期各氮素水平下参根葡萄糖含量均高于收获期。 图4.1.8 氮肥对西洋参根部蔗糖含量的影响 Figure 4.1.8 Effect of nitrogen fertilizer on sucrose content in roots of American ginseng 由图4.1.8可以看出,西洋参根中蔗糖含量受生育期影响较大,均是呈现先升后降的趋势,除对照组N0外,基本在绿果期蔗糖含量达到最高值。但是同时期比较发现,氮肥对西洋参根部蔗糖的积累影响比较小,特别是收获期其蔗糖含量基本维持在6.85%~7.34%之间。 图4.1.9 氮肥对西洋参根部麦芽糖含量的影响 Figure 4.1.9 Effect of nitrogen fertilizer on maltose content in roots of American ginseng 图4.1.9为西洋参根部各个时期不同氮素水平下麦芽糖含量的变化趋势图,对每个时期不同氮素水平下麦芽糖的含量进行分析比较,结果表明:展叶期根中麦芽糖含量基本维持在4.33%左右,氮肥对其含量的积累没有影响。开花花、绿果期、红果期麦芽糖的含量变化趋势基本都随着氮肥浓度的升高先增加再降低,且差异性显著,开花期在 N3 水平时含量最高达5.82%,比对照组含量高出一倍;红果期在 N2 水平下麦芽糖含量高达6.389%,比同期对照组含量多 58.04%;1收获期麦芽糖的积累也是在 N2 水平含量最高,, I比对照组增长12.03%。各氮素水平下收获期麦芽糖含量均远低于红果时期。 图4.1.10 氮肥对西洋参根部可溶性总糖含量的影响 Figure 4.1.10 Effect of nitrogen fertilizer on total soluble sugar content in roots of Americanginseng 由图4.1.10可以看出,各施氮水平下西洋参根中总糖含量均以展叶时期含量最高,基本维持在 20.10%~21.66%之间。开花期、绿果期、红果期以及收获期四个时期的总糖含量积累基本处于随着氮肥浓度增加呈现先增加后下降的趋势,前三个时期在N2时含量最高,分别比对照组含量增长 30.54%、20.78%、11.19%。收获期在N1、N2 水平下含量较高,可溶性总糖含量在15%以上,分别比同期对照组增长25.40%和 24.24%。施氮量为 N2浓度时,西洋根中可溶性总糖含量在生长前期变化不明显,维持在20.00%左右,后期明显降低。 4.1.5小结与讨论 糖是所有生命体的重要组成部分,也是生命维持的重要营养物质,具有多种生物活性。三、四年生西洋参总糖含量在 55.2%~59.4%之间,还原性糖在3.73%~6.29%之间,可溶性多糖含量在8.00%左右,西洋参含糖量的多少可能会由于生长年限及生长环境的不同而产生差异[83]。目前已知从西洋参中分离纯化得到的多糖组分有26种,杨修仕[84]在其论文中进行了详细的介绍。现代药理研究结果表明西洋参中多糖具有抗补体、抗肿瘤、细胞保护、降血糖、免疫调节等活性[85],是一种不错的药品、保健品材料来源。西洋参体内糖含量的多少影响着其质量的高低,本研究在通过控制栽培过程中氮肥的施用量变化对西洋参表观生长产生影响的基础上进一步对氮肥与可溶性多糖、果糖、葡萄糖、蔗糖、麦芽糖积累的关系进行研究。主要结果如下: 1.在果糖、葡萄糖、蔗糖、麦芽糖的检测结果中,西洋参茎叶中主要含有果糖和葡萄糖,蔗糖、麦芽糖含量极少,大致在0.00%~1.30%范围内;根中则以蔗糖、麦芽糖为主,果糖和葡萄糖含量较少,含量多数在1.00%以下,极少量达到1.20%左右。叶片进行光合作用产生的碳水化合物需要经过长距离运输到达库组织中进行贮存和利用,与葡萄糖、果糖相比,蔗糖属于非还原性糖,不易降解,是高等植物长距离运输碳水化合物的主要形式[86],所以在西洋参茎叶中主要含有果糖、葡萄糖,参根中主要含有蔗糖、麦芽糖。郑毅男[87]等人指出人参根中含有丰富的麦芽糖,是精氨酸糖苷产生的物质基础,由此推测五加科植物化学成分的相似性决定了西洋参根中含有丰富的麦芽糖。纵观整个生长时期,西洋参根中所含有的可溶性总糖含量总是高于茎叶中的含量。 2.西洋参茎叶中果糖和葡萄糖含量受生育期影响很大,呈现随生育期的延长先升后降的趋势,在绿果期时含量最高,在4.55%以上;可溶性总糖含量是在展叶期和绿果期两个时期含量最高,大致在 17.32%~19.69%之间,收获期含量则较低。这是由于不同时期西洋参的氮肥利用率不同,绿果期为西洋参生长的旺盛期,此时需要大量的氮素供生殖生长及器官建造[66]。 展叶期,果糖与葡萄糖含量受氮肥影响较小,可溶性总糖含量随氮肥的增加先升高后下降,在N2 水平时达到最高,差异不显著;开花期,果糖与葡萄糖含量则是随氮肥的增加呈现了“V”字型变化规律,在N3时含量最低,可溶性总糖含量则是呈上升趋势,不施氮时含量最低;绿果期,果糖与葡萄糖含量随施氮量的增加变化不明显,可溶性总糖含量变化与展叶期规律一致;;红果期,果糖、、葡萄糖及可溶性总糖含量都随着氮的施用量增加而增加,在N2 时含量达最大值,之后又随着氮量的增加而下降,除葡萄糖外,果糖与可溶性总糖的变化具有显著性差异;收获期,三种糖的含量都远低于红果期,,且氮肥的增加使茎叶中果糖与葡萄糖含量出现不同程度的降低,可溶性总糖含量则是先升高后下降,在N1时有最大值。总体来看, N1与N2水平下,西洋参茎叶各时期糖含量较高,为了实际需要与经济效益的提高,可在不影响西洋参根部发育的前提下,在红果期末收获期前对西洋参茎叶进行采收。 3.西洋参根中蔗糖含量受生育期影响较大,其含量远高于麦芽糖。展叶期,增施氮肥会抑制参根中的蔗糖的积累,施氮后蔗糖含量下降显著;;而麦芽糖和可溶性总糖含量不受氮肥的影响,含量分别稳定在 4.33%和 20.71%左右。开花期,参根蔗糖含量随氮肥施用量增加呈现先下降后上升的趋势,N2时含量最低,下降了19.04%:麦芽糖和可溶性总糖含量的变化规律与蔗糖相反,先升后降,麦芽糖在N2时有最高含量 4.66%,总糖含量则以 N2 水平下最高为19.92%,差异显著。绿果期,,参根中蔗糖含量随着氮水平的提高出现了增加趋势,但趋势不明显;麦芽糖与可溶性糖的变化规律为先增加后减少,麦芽糖在 N2 时含量达6.45%,增长58.04%;可溶性总糖在N2 时含量为19.97%,比对照组增长20.78%。红果期时,蔗糖、麦芽糖、可溶性总糖含量均随着施氮量的增加先增后减,蔗糖最大量为8.71%,比同期对照组蔗糖含量增长8.14%,麦芽糖最高增长12.03%,可溶性总糖在N2时有最高含量15.73%,增长11.19%。收获期时,参根中蔗糖和麦芽糖含量基本稳定,分别维持在7.04%和2.61%左右;可溶性糖含量则随氮的增加而增加,在N1和N2 施氮量下含量分别增长25.40%和 24.24%,差异显著,之后施氮继续 增加会明显降低总糖含量。 综上所述,氮肥对西洋参糖分的积累会产生一定的影响。在综合考虑茎叶、根的糖积累情况以及生产成本与效益的前提下, N2 施肥量可作为适宜施氮量,红果期末对茎叶进行部分采收,而根的采收时间也可稍微提前,以确保糖含量积累及生产需求。 4.2肥肥对西洋参皂苷含量的影响 4.2.1实验材料与设备 实验材料与试剂:过100目筛干燥西洋参参粉末,,甲醇(优级纯),氨水,皂苷标准品(购于坛墨质检-标准物质中心)。实验仪器:器荡器、超声萃取仪、美国 Waters ACQUITY UPLC H-Classs系统西班牙KONIK 的 HPLC 560 (type B) . 4.2.2实验方法 取2.3.2中制备的样品粉末 0.4g, 精密称定(精确到0.001g), 置于25ml具塞试管中,加入10 mL 氨水-水-甲醇溶液(4:21:75),振荡器摇匀,密塞,超声提取30 min, 静置24h,取上清液过 0.2 um微孔滤膜,待测。单体皂苷对照品超高效液相色谱图见图4.2.1,皂苷F11对照品高效液相色谱图见图4.2.2。梯度洗脱程序:色谱条件为 ACQUITY UPLC BEH C18 色谱柱(50mm×2.1 mm, 1.7 um)柱温35℃,流速0.5 mL/min,检测波长203 nm,进样量3pL,流动相为乙腈-0.00125%磷酸水溶液(使用高效液相色谱 ELSD 测定西洋参中F11时,流动相为乙腈-水溶液,进样量为10pL, 其他条件不变),梯度洗脱(0~5 min, 15%乙腈;5~15 min, 40%乙腈;15~20 min, 90%乙腈; 20~23 min,90%乙腈;23~23.1 min,l5%乙腈; 25 min 停止),方法学考察结果显示精密度、重复性和稳定性良好,标准曲线 R≥0.999。 图4.2.1 单体人参皂苷对照品的 UPLC 色谱 Figure 4.2.1 UPLC chromatogram of monomeric ginsenoside reference substance 注:1表示的是 F11 图4.2.2 皂苷 F11对照品的 HPLC 色谱 Figure 4.2.2 HPLC chromatogram of saponin F11 control 4.2.3 氮肥对西洋参茎叶皂苷积累的影响 如下图所示,图4.2.3为氮肥对西洋参茎叶九种单体皂苷含量总和的影响情况,图4.2.4~图4.2.12为西洋参茎叶中各单体皂苷在氮肥影响下的变化趋势。 图4.2.3 氮肥对茎叶九种皂苷含量的影响 图4.2.4 氮肥对茎叶 F11 含量的影响 Figure 4.2.3 Effect of nitrogen fertilizer on thecontents of nine saponins in stems and leaves Figure 4.2.4 Effect of nitrogen fertilizer on F11content in stems and leaves 氮素水平 氮素水平 图4.2.5 氮肥对茎叶Rg1 含量的影响 图4.2.6 氮肥对茎叶 Re 含量的影响 Figure 4.2.5 Effect of nitrogen fertilizer onRgl content in stems and leaves Figure 4.2.6 Effect of nitrogen fertilizer on Recontent in stems and leaves 图4.2.7 氮肥对茎叶Rb1 含量的影响 图4.2.8 氮肥对茎叶Ro 含量的影响 Figure 4.2.7 Effect of nitrogen fertilizer on Rb1content in stems and leaves Figure 4.2.8 Effect of nitrogen fertilizer onRo content in stems and leaves 1..5 0.6 展叶期 图4.2.9 氮肥对茎叶 Rb2 含量的影响 图4.2.10 氮肥对茎叶 Rc 含量的影响 Figure 4.2.9 Effect of nitrogen fertilizer onRb2 content in stems and leaves Figure 4.2.10 Effect of nitrogen fertilizer onRc content in stems and leaves 图4.2.11 氮肥对茎叶 Rb3 含量的影响 图4.2.12 氮肥对茎叶Rd含量的影响 Figure 4.2.111Effect of nitrogen fertilizer onRb3 content in stems and leaves Figure 4.2.12Effect of nitrogen fertilizer onRd content in stems and leaves 图4.2.3可以看出,茎叶中西洋参九种皂苷总和(以下简称“总皂苷”)受生育期影响较大,随着生育期的变化,其含量先升高后下降,基本在绿果期及红果期时含量达到最高,收获期的含量在各时期中最低,,可能由于收获时间太晚,导致西洋参进行有效成分的消耗来抵御外部不利条件的破坏,因此要适当提前采收时间。在氮肥的影响下,茎叶总皂苷含量在不同生育期受到的影响不大相同。展叶期、开花期,总皂苷含量呈现先增加后下降的变化规律,N1或N2 时含量达到最高值,分别比同期增长14.71%和 15.86%,差异显著。绿果期含量不受氮肥影响,含量大致维持在10%左右。红果期 N1 水平下总皂苷含量虽比对照组增加10.75%, 但差异并不显著,之后随着氮素水平的增加,含量不断下降。收获期总皂苷含量的变化没有显著差异,说明此时氮肥的浓度对其皂苷的积累没有产生影响。 图4.2.4可以看出,西洋参茎叶中皂苷 F11的含量受生育期影响变化不大,其含量变化范围处于 1.235%~1.515%之间,基本稳定。在展叶期时,施氮肥使茎叶F11含量出现不同程度的降低,分别下降10.40%、11.00%、11.28%和8.63%,差异显著。开花期氮肥量的多少对 F11的积累影响不大,基本在1.4%左右,但氮过量时还是会降低其含量的积累。绿果期,才不同氮肥水平下 F11的含量出现不断增加的变化规律, N3、N4明显比对照组增长18.14%和20.09%。红果期与收获期时F11的含量变化无规律可循,可能由于生长后期生殖器官发育的需要以及根部吸收能力的强弱等多种因素影响了 F11的积累,仅综合生育期与氮肥量两个影响因素来看, N4水平下的红果期与收获期含量都比较高。 分析图4.2.5可知,茎叶中 Rg1 皂苷在生长前、中期含量较低,主要在0.1%~0.2%之间,后期即红果期到收获期含量较多,高达0.3%左右。红果期发现,Rg1 含量随施肥量增加出现先增加后下降的趋势,以 N2 时含量最多,为0.33%,明显比对照增加14.7%。而收获期与红果期变化规律正好相反,在N2时达到最低含量。 由图4.2.6可知,不同生长期茎叶中 Re 的积累呈现先升后降的变化规律,且以绿果期时含量最高,约在1.45%左右,收获期时含量最低。展叶期、绿果期乃至收获期,氮肥用量对其含量的积累并没有显著影响。适量的氮素只在开花期、红果期对 Re 含量有相对明显的促进积累的作用,开花期N1 水平下的 Re 含量明显比同期对照组增加14.84%,红果期则以施肥量为 N2 时 Re含量最高,为1.50%。 图4.2.7为不同生长期不同氮素水平下西洋参茎叶中 Rb1 含量的变化。氮肥对Rb1 积累的影响主要体现在红果期,随着氮量的增加,该时期Rb1含量逐渐增加,在N2 水平时达到峰值,比对照组含量增长近一倍。 收获期Rb1 含量受氮肥用量的影响较小。 由图4.2.8可以看出,茎叶中Ro 的含量主要集中在开花期和绿果期,其次是 收获期,展叶期含量最低,只有0.07%左右。在开花期和绿果期,随着氮素水平的不断提高, Ro含量先减后增,在N2时含量最低,比同期对照组明显减少33.69%和441.99%。红果期和收获期时的含量受氮肥用量的影响较小,基本维持在0.12%~0.15%的范围。 通过对图4.2.9进行分析可知,茎叶中Rb2含量受生育期影响较大,多以绿果期时含量最高,收获期含量最低。除红果期外,氮肥施用量的多少对其积累的影响都较为显著。展叶期、开花期、绿果期三个时期, Rb2 含量都是随着施氮量增加而出现先增高后降低的趋势,展叶期以N1水平下含量最高,开花期和绿果期则在N2 水平时出现峰值,N2 水平下绿果期 Rb2 含量可达1.19%。 分析图4.2.10, Rc 含量受氮肥影响较小,除展叶时期, N1、N2氮肥水平促进Rc 的积累外,其他时期不同施氮水平下含量并没有显著变化。Rc 含量受生育期影响较为明显,绿果期时含量较多,在0.4%左右,展叶期、收获期时含量较低,0.2%左右,约是最高含量的 1/2。 图4.2.11为西洋参茎叶中 Rb3 含量在不同氮量的变化规律图,对比分析发现,它与 Rb2 的变化规律相似,可能由于两者的结构较为类似,故而氮肥对其含量的影响作用相近。 由图4.2.12可知,Rd皂苷含量随着生长时期的变化而逐渐的提高,基本以绿果期、红果期含量最高,约3%左右,收获期由于植株叶片枯萎等原因皂苷含量出现不同程度的降低。西洋参不同时期, Rd 皂苷含量随氮肥施用量的增加呈现出不同的规律。展叶期随着施氮量的增加,Rd 含量出现了不同程度的增长,分别增长28.23%、42.33%、54.08%、48.47%, N3 水平下Rd 含量增长最多。开花期 Rd 的积累随着氮肥浓度的提高呈现明显的先增高再降低的变化趋势,在N2 水平下 Rd含量最高,达2.80%。绿果期, Rd 含量出现了“V”型变化规律,在N2施氮量下出现最低值。红果期则与绿果期变化趋势相反,且以N1 水平下皂苷含量最高,达到4.069%,并远高于其它水平与时期。收获期Rd 含量较低,约在0.8%~1.7%范围内上下浮动,氮肥施用量的多少并没有对其积累产生不利影响。 氮素水平 图4.2.13 氮肥对西参根九种皂苷含量的影响 图4.2.14 氮肥对西洋参根 F11 含量的影响 Figure 4.2.13 Effect of nitrogen fertilizer on thecontents of nine saponins in American ginseng root Figure 4.2.14 Effect of nitrogen fertilizer onF11 content of American ginseng root 氮素水平 氮素水平 图4.2.15 氮肥对西洋参根 Rg1 含量的影响Figure 4.2.15 Effect of nitrogen fertilizer onRg1 content of American ginseng root 图4.2.16 氮肥对西洋参根 Re含量的影响 Figure 4.2.16Effect of nitrogen fertilizer onRe content of American ginseng root 图4.2.18 氮肥对西洋参根 Ro 含量的影响 Figure 4.2.18 Effect of nitrogen fertilizer onRo content of American ginseng root 图4.2.19 氮肥对西洋参根 Rb2含量的影响 图4.2.20 氮肥对西洋参根 Rc 含量的影响 Figure 4.2.19Effect of nitrogen fertilizer onRb2 content of American ginseng root Figure 4.2.20Effect of nitrogen fertilizer onRc content of American ginseng root 氮素水平 图4.2.21 氮肥对西洋参根 Rb3含量的影响 图4.2.22 氮肥对西洋参根Rd 含量的影响 Figure 4.2.21 Effect of nitrogen fertilizer onRb3 content of American ginseng root Figure 4.2.22Effect of nitrogen fertilizer onRd content of American ginseng root 图4.2.13为不同氮肥施用量对西洋参根中总皂苷含量的影响,由图可知,从不同生育期来看,参根总皂苷含量的影响在展展期最高,在4.5%左右,之后随着生长时期的变化出现不同程度的降低。开花期时,氮肥对参根总皂苷含量的变化几乎没有影响。绿果期、红果期以及收获期这三个时期,,总皂苷含量随氮肥的增加呈现先增长后减少的变化趋势,绿果期和红果期的高峰值在 N2 水平时出现,总皂苷含量为3.88%和4.34%,分别比同期对照组增加23.59%、18.29%,收获期在N1 时有峰值4.00%,高于对照组28.79%。总体来看,施氮量为N1、N2时,参根的皂苷含量相对较高,能够有效提高西洋参质量。 图4.2.14为参根 F11 含量随氮素变化的趋势图,可得生育期对根中 F11 积累 的影响没有固定规律,但在展叶期和收获期两个时期的含量较高。在西洋参生长的中后期,氮对 F11 的积累表现出明显的影响,即其含量随着氮肥量的增加呈现出先增后减的趋势。绿果期时,施氮比不施氮是 F11 含量出现了不同程度的增加,以 N3 施氮量增量最多,增长了 75.00%之多。红果期和收获期都以 N1水平增长量最多,分别比同期对照组增加24.37%和12.28%。单一考虑 F11 的积累可选 N1 为适宜施肥量,此氮肥水平下,西洋参根中F11 的含量较高。 由4.2.15可知,西洋参根中Rgl 含量在生长前中期含量较多,后期呈现不同程度的降低。氮肥对 Rg1 含量积累的影响也主要表现在生长的前中期,随着氮肥的增加,参根中 Rg1的含量出现不同程度的增长。开花期的峰值为0.26%,在施氮量为N1 时比 NO 增加41.37%。绿果期在施氮量为 N3 时增长量最大,比同期NO 增长 46.34%。红果期和收获期 Rg1 含量基本稳定,分别在0.14%和0.11%左右。 通过图4.2.16可知,参根在展叶时期Re 含量较高,含量稳定在1.20%左右。展叶期和开花期 Re 受氮肥的影响较小。氮肥对 Re 含量的积累影响主要表现在生长中后期。增加氮肥用量使绿果期 Re 含量得到不同程度的积累, N4 水平下 Re 含量增长最为明显,增长了 58.33%。红果期和收获期时, Re 含量随着氮的增加有先升后降的变化趋势。红果期在施氮量为 N2 时 Re积累量增长最多,达1.06%,t比NO 增长 22.26%,差异显著。收获期在N1时Re 含量比对照组增加一倍多,达1.17%。 图4.2.17为Rb1 含量的变化图,由图可知,l,各时期氮肥对 Rb1含量的影响各不相同。氮肥增多会使展叶期、开花期以及收获时期 Rb1 含量出现不同程度的降低,但影响不显著。绿果期、红果期,随着氮素水平的增加 Rb1 含量出现了不同程度的增加现象,绿果期的变化差异几乎不显著,红果期 N1 比 NO 水平 Rb1含量显著增加了 50.25%。综合分析,N1 水平西洋参根各时期 Rb1含量较高,可作为纳入适宜氮肥施用量的参考。 分析图4.2.18可知,随着氮肥施用量的增加,参根 Ro 的含量几乎在各个生长期都表现出先增后减的趋势。展叶期 N3 水平 Ro含量最高,比对照组增加41.29%。绿果期和红果期Ro 含量都在N2水平时达到峰值,分别比同期对照组增加37.64%、 16.81%,差异不显著。收获期时以N1水平下Ro 含量增长明显,比对照组显著增加22.15%。总体分析,N2 水平西洋参根 Ro 含量较高,只考虑单一皂苷 Ro 积累的情况下可将 N2 作为适宜施肥水平。 从图4.2.19可以看出,参根 Rb2 含量以展叶期含量最高,在0.13%左右,生长后期含量较低,大约0.07%。氮肥在各个时期对 Rb2含量的积累没有影响。对比图4.2.21可发现, Rb3 含量的变化与 Rb2相似。 通过图4.2.20可知,在展叶期时参根 Rc 含量最高,之后随着生长的不断进行,其含量不断下降。氮肥对参根 Rc 含量的影响主要表现在展叶期和绿果期,即随氮量增加呈现“V”型变化趋势,且在N2时含量最低,分别比对照降低25.92%、20.50%。只考虑 Rc 含量积累的情况下最经济的施肥方案为不施氮肥。 由图4.2.22可知,西洋参根Rd 含量在生长期变化没有明显的规律。氮肥的增加对Rd 含量的影响在整个生长期都可体现,其规律为先增后降。展叶期Rd 在N3水平时的含量比对照显著增加22.74%。开花期 N2 比 NO显显增加31.25%。绿果期 N2、N3分别比 NO 显著增加 84.50%、86.31%。红果期、收获期Rd 含量都在N2达峰值,分别为0.59%、0.50%,但增长差异不显著。综合比较,施氮量为N2水平有利于西洋参根 Rd 的积累。 4.2.5小结与讨论 西洋参皂苷是由皂苷元和糖相连接而构成的一种糖苷类化合物,是西洋参的主要活性成分和重要的质量控制指标,广泛存在于西洋参的各个部位当中[80,88]。目前研究表明已分离出西洋参皂苷成分有50余种,按其母体即皂苷元结构的不同,主要分为达玛烷型 (Dammarane)、齐墩果酸型(Oleanane)、奥克梯隆醇型(Ocotillol)三种类型[89]。许多药材中都含有皂苷成分,西洋参的特性在于Rb1 和 Re 的含量占西洋参总皂苷含量的50%以上,二醇型皂苷含量大于三醇型皂苷,并且拟人参皂苷F11 是其中独有的皂苷[90]。国产西洋参人参总皂苷含量在6.36%~7.35%之间,与国外咽洋参总皂苷含量基本相当当]。药理实验证明西洋参皂苷具有抗肿瘤、抗疲劳、降血糖、提高免疫力、保护血管以及改善学习记忆能力等多种生物活性和药 理活性[91-93]。皂苷含量的多少决定着西洋参的品质,本章通过分析西洋参不同时期在不同施氮水平下9种主要单体皂苷含量的变化,探讨氮肥用量对西洋参皂苷含量的影响,旨在分析评价氮肥对西洋参质量的影响。 由于2017年天气的原因,西洋参在收获期受到冻害,致使叶片提前枯萎,使收获时期西洋参的生长及有效成分的积累受到一定影响,而红果期和收获期相近,所以现主要以红果期为主进行分析,综合研究,有以下结论: 1.在检测的9种皂苷中,西洋参茎叶皂苷含量以Rd为主,约在3.40%左右;Rb3次之,含量有 1.65%; Re 含量在1.40%左右,在排在第三位;之后依次为F11(1.30%)、Rb2(0.7%)、Rc(0.35%)、Rg1(0.26%)、Rb1(0.16%)、Ro(0.13%)。西洋参根中九种皂苷含量的排列顺序依次为 Ro(1.20%)> Re(1.00%)> Rd(0.55%)>Rb1(0.50%)>Rc(0.30%)>F11(0.23%)>Rg1(0.14%)>Rb2(0.07%)>Rb3(0.05%)。茎叶中的Rd、Rb3 和F11的含量远远高于参根中的含量,且茎叶皂苷总量大于参根。 2.氮肥对西洋参茎叶皂苷含量的影响如下:随着氮着水平的增加,Rg1、Re、Rb1、Rb2、Rb3、Rc、Rd、 Ro 的含量都呈现了先增高后降低的变化规律,其中Rg1、Re、Rb1、Rb2、Rb3以及Rc 的峰值出现在N2水平,分别比N0 对照组增长14.70%、17.24%、96.83%、7.60%、18.37%、18.54%,!只有Rb1具有显著性差异; Rd、Ro在N1水平时有峰值,比对照组增加16.82%、14.5%,没有显著差异;F11 没有明显的变化规律。红果期总皂苷含量在N1 时达14.47%,虽比对照组增加10.75%,但差异并不显著, N2 比 NO 增长了 3.79%,之后随着氮素水平的增加,含量不断下降。 氮肥对西洋参根皂苷含量的影响如下:随着氮素水平的增加,九种皂苷含量都出现了先升后降的变化趋势,不同的是, Re、Rb2、Rc、Ro 的峰值出现在 N2水平下,分别比对照组NO 增加 22.26%、21.46%、17.6%、16.81%,差异不显著;F11、Rg1的最高含量在N1 水平下,分别比 NO 组增长 24.37%、9.24%; Rd 在N2、N3 组分别比 N0 组含量增加12.66%、14.00%,差异不显著; Rb1在N3时含量增加量最大,增长60.94%,差异显著; Rb3,施氮量越多其含量增加越多, N4比 N0 组含量增加 22.99%,但变化没有显著差异。参根皂苷总量随氮增加也出现先增加后减少少趋势, N2 时总量达到最大值4.34%,比对照组增长18.29%,没有显著差异, N1组比N0增加12.57%。 3.综合比较,N1和N2水平下西洋参茎叶与根中皂苷含量相对较高,分别为10.35%+4.13%(茎叶+参根)、9.16%+4.34%(茎叶+参根),因此在仅考虑皂苷这一有效成分时,可选 N1 为适宜施氮方案。 不同种类的皂苷受氮肥影响的趋势并不相同,合理的施用氮肥可有效提高西洋参的质量,对单一皂苷的含量进行可控性提高也有一定的帮助。这为西洋参的高效种植、精细化加工提供了理论基础,4特别是为单一种类皂苷的应用提供很好的原料来源。 4.3肥肥对西洋参蛋白质含量的影响 4.3.1实验材料与设备 实验材料:过100目筛干燥西洋参粉末,标准品 EDTA(意大利 VELP 公司)。 实验设备:电子天平,锡箔纸,镊子, NDA701杜马斯定氮仪(意大利 VELP公司)。 4.3.2实验方法 准确称取干燥西洋参粉末 50 mg(精确至0.001 g),并做好记录,用锡箔纸包好,压缩空气完成制样后置于自动进样盘中等待进样检测。燃烧反应器温度设置在1020℃以上,还原反应器温度650℃以上,在氧气(纯度≥99.99%)压力 2.5 bar 以上,氦气(纯度≥99.99%)压力2.0 bar以上,氮气(纯度≥99.99%)压力 3.0 bar 以上时自动进样检测。 4.3.3氮肥对西洋参茎叶蛋白质的影响 20 r 图4.3.1 不同生长期西洋参茎叶蛋白质含量的变化 Figure 4.3.1(Changes in protein content of stems and leaves of American ginseng in differentgrowth stages 图4.3.2 氮对西洋参茎叶蛋白质含量的影响 Figure 4.3.2 Effect of nitrogen on protein content of stems and leaves of American ginseng 由图4.3.1和图4.3.2可知,随着西洋参的不断生长,茎叶蛋白质的含量出现了不断降低的趋势,最高含量出现在展叶期,约为17.35%。瓦肥施用量的不同对茎叶蛋白有一点影响,低氮水平即N1时,茎叶蛋白质含量比对照组增加3.8%,之后氮肥量继续增加,茎叶蛋白质则出现了不同程度的降低,说明过多的氮肥抑制了茎叶蛋白质的积累。 4.3.4氮肥对西洋参根部蛋白质的影响 图4.3.3 不同生长期西洋参根部蛋白质含量变化 Figure 4.3.3Changes in protein content in roots of American ginseng at different growth stages 图4.3.4 氮对西洋参根部蛋白质含量的影响 Figure 4.3.4 Effect of nitrogen on protein content in roots of American ginseng 图4.3.3和图4.3.4为西洋参根部蛋白质在不同生长期和不同氮素水平下含量的变化,由图可以发现,根部蛋白质的含量并没有受生育期的变化而表现出明显的变化规律,基本维持在9.47%~10.97%之间。随着氮素水平的增加,西洋参根部蛋白质含量出现了不断减少的趋势,同茎叶蛋白质积累一致,过多的氮肥抑制了根部蛋白质含量的积累。 4.3.5小结与讨论 蛋白质是生命存在的物质基础,被称为“生命元素”,它参与植物生长过程中的细胞增长分裂以及新细胞的形成以及代谢等过程,是植物体必不可少的组成部分。已有研究报道,中药蛋白具有抗肿瘤、抗病毒、免疫调节等多种活性,不仅与中药的治疗作用密切相关,而且由于其稳定性对亲缘关系相近的中药品种的鉴定和质量的控制有着重要的影响。对于人参蛋白质的研究多集中于人参,西洋参中的蛋白质研究相对较少。人参蛋白具有具有调节机体免疫功能、抗真菌病毒、抗疲劳、抗降血脂等药理活性[94-102]。西洋参中蛋白质的含量比较少,其中可溶性蛋白所占的比例相对稍微高一点。西洋参中蛋白质的含量是处于动态变化中的,而且随着西洋参植株不同生长时期出现规律性变化[103]。 蛋白质平均含氮16%左右,在理论上氮肥对其含量的积累应有一定的影响,而蛋白质的含量也往往影响着西洋参的生长及品质,研究合理的施氮量十分重要。本节着重讨论了氮肥施用量对西洋参展叶期及收获期的蛋白质含量影响,及植株体内蛋白质含量受生长期时期的影响。综合分析可知有以下结论: 1.西洋参茎叶蛋白含量明显高于根部,且茎叶蛋白质含量随西洋参植株生长的进行呈现了不断降低的规律性变化,而根部则无明显规律。蛋白质在参根中的积累过程是逐渐进行的,此过程主要可能是靠叶片运输I104],因此茎叶蛋白会不断减少。本实验中西洋参根中蛋白质含量没有明显变化,但由于参根的膨大,参根蛋白的产出量明显增加。 2.茎叶蛋白质含量受氮肥量的影响呈现出先升高后降低的趋势,在N1时含量达峰值,比对照组增加3.8%,差异不显著。适当增施氮肥会提高植株叶片蛋白质的含量[105]。 3.根部蛋白质含量随氮素含量的增多呈现缓慢降低的趋势,在N1、N2、N3时蛋白质含量分别比对照组降低6.28%,7.25%,9.93%, 差异不显著,在N4时明显降低 13.30%。可能由于天气等原因,使茎叶中的蛋白质向根部转移减少,同时根部还需大量能量来抵御外界不利环境带来的影响,因此本研究中参根蛋白质含量没有表现出与茎叶相同的变化趋势。 因此,若单一考虑蛋白质积累的情况下,可选择不施加氮肥的施肥方案来保证西洋参蛋白质含量的积累。 4.4肥肥对西洋参游离氨基酸含量的影响 4.4.1实验材料与设备 实验材料:过100目筛干燥西洋参粉末,混合氨基酸标准溶液,i,内标正亮氨酸(Nle),磺基水杨酸,盐酸,滤膜(水系膜、有机膜)。 实验设备:电子天平,振荡器,涡旋离心机,氨基酸自动分析仪(德国塞卡姆 S433D)。 4.4.2实验方法 内标配制:称取10g(精确至0.001 g)磺基水杨酸,用超纯水定容至 100 mL,制成10%磺基水杨酸溶液。精密称取 0.6559 g 正亮氨酸,用 0.1 mol/L 的HCl 定容至100 mL, 配成浓度为 50 umol/mL 的正亮氨酸溶液。吸取 0.5 mL 的浓度为 50umol/mL 的正亮氨酸溶液置于 100 mL容量瓶中,用10%磺基水杨酸溶液定容,由此配制成 250 nmol/mL 正亮氨酸的内标溶液。 样品处理:称取0.05g(精确至0.0001g)西洋参粉末,加入5 mL超纯水,振荡器混匀后静置2h,在振荡在静置重复两次,取上清液。 样品检测:取0.5 mL上清液于1mL离心管中,加入0.5mL 内标溶液,10000r/min 下离心5 min, 上清液置于上机小瓶中在放入氨基酸自动分析仪中进行检测。 4.4.3氮肥对西洋根部部游离氨基酸含量的影响 表4.4.1 不同氮素水平下16种游离氨基酸含量的变化(单位: mg/g) Table 4.4.1Changes in 16 amino acid contents under different nitrogen levels (mg/g) 天冬氨酸 苏氨酸 丝氨酸 谷氨酸 脯氨酸 甘氨酸 丙氨酸 缬氨酸 Asp Thr Ser Glu Pro Gly Ala Val N0 0.33 0.50 0.29 0.01 0.23 0.06 0.45 0.27 N1 0.25 0.82 0.43 0.26 0.05 0.36 0.27 N2 0.38 0.94 0.57 0.47 0.15 0.04 0.49 0.25 N3 0.79 0.39 0.45 0.21 0.05 0.56 0.21 N4 0.25 0.89 0.35 0.18 0.20 0.04 0.39 0.20 蛋氨酸 异亮氨 亮氨酸 酪氨酸 苯丙氨 组氨酸 赖氨酸 精氨酸 Met 酸 Ile Leu lyr 酸 Phe His Lys Arg N0 0.08 0.26 0.42 0.17 0.46 1.21 10.36 7.44 N1 0.12 0.25 0.43 0.12 0.36 1.28 12.37 10.18 N2 0.06 0.23 0.37 0.13 0.38 1.44 3.74 15.97 N3 0.01 0.21 0.40 0.09 0.43 2.15 0.14 22.73 N4 0.07 0.17 0.35 0.11 0.33 2.23 5.22 13.30 图 4.4.1 氮肥对西洋参总氨基酸含量的影响 Figure 4.4.1 Effect of nitrogen fertilizer on total amino acid content of American ginseng 已有研究表明,西洋参根中精氨酸含量丰富,占游离氨基酸总量的50%以上[106-107]。分析表4.4.1西洋参根部中不同氮素水平下16种氨基酸含量的变化情况可以看出,本研究的结果与已报道的结果一致,西洋参根部中含量最高的氨基酸为Arg, 在 7.44 mg/g~22.73 mg/g 范围内,其次为 Lys, 含量在0.14 mg/g~ 12.37 mg/g之间,排在第三位的为 His,平均1.5 mg/g 左右。含量最低的氨基酸有 Gly、Met和Tyr,含量在 0.01 mg/g 左右。氮肥对16种氨基酸含量的影响不大相同,随着氮 素水平的增加, Ser 和 Arg 的含量表现出先升高后降低的趋势, Ser 的峰值出现在N2 水平下,为 0.57 mg/g, 比对照组增加将近一倍,差异显著, Arg 的最高值为22.73mg/g,明显比对照组NO 增加两倍之多;; Val 和 Ile 随氮的增加含量逐渐降低; His的含量则是逐渐升高; Met 含量随着氮肥水平的增加先降低后上升,在N3 时达到最低值,比对照组降低 83.00%;其余氨基酸则未没有呈现明显的变化规律。由图4.4.1,16种氨基酸总含量的变化趋势可知,随着氮素水平的提高,游离氨基酸总含量呈现了上升、下降在上升的变化趋势,N1时有最大值,明显比 NO 增加 22.19%,N2时也增加了 6.65%. 氨基酸是组成蛋白质的结构单位,是一种广泛存在于自然界的含有羧基的有机酸的统称,是一切生命之源。西洋参中主要含有精氨酸、组氨酸、赖氨酸、苏氨酸、甘氨酸、亮亮酸、天门冬氨酸等18种以上的氨基酸[8,12],其中包括7中人体必需氨基酸。西洋参不同部位氨基酸含量不同,由高到低分别为须根>芦头>主根[108],并且西洋参根部总氨基酸含量会随着参龄的增长而有所减少[109]。西洋参的氨基酸中,有的能明显抑制癌细胞的增殖,有的可降低血液中的血糖值,有的可参与胆碱的合成具有去脂的功能,有的具有较强的抗病毒作用,有的对血糖有较好的调节作用,这些作用对人体的健康十分有益[110]。综合分析,N1、N2施氮水平可考虑为促进氨基酸增加的适宜施肥方案。 第5章氮肥对西洋参硝酸盐积累的影响 氮肥施用是植物积累硝酸盐的主要原因之一。实验证明,蔬菜中硝酸盐的含量与化学学肥施用量呈正相关[111-114]。控制氮肥施用量是减少蔬菜硝酸盐的一项重要措施。研究表明食用亚硝酸盐和硝酸盐含量较高的蔬菜会使人们患肠胃癌、高铁血红蛋白症等疾病的概率上升,为此,世界各国都建立了食品中亚硝酸盐含量的限量标准。I目前关于食品中对硝酸盐及亚硝酸盐含量变化的研究还主要集中在叶类蔬菜当中,对中药材中硝酸盐和亚硝酸盐的含量变化规律的研究报道罕见。施氮是否会给西洋参带来硝酸盐及亚硝酸盐的残留危害以及它们的含量变化规律等不得而知。本课题主要通过研究氮肥对西洋参体内硝酸盐积累及硝酸还原酶活性的影响,了解氮肥用量与硝酸盐积累的关系,确定西洋参体内硝酸盐含量的积累情况,从而为西洋参食用药用安全性评价提供更多理论依据。 5.1氮肥对西洋参硝酸盐含量的影响 5.1.1实验材料 实验用品:新鲜西洋参样本,i亚铁氰化钾,乙酸锌,冰乙酸,硼酸钠,盐酸。实验仪器:流动分析仪,水浴锅,电子天平,研钵。 5.1.2试验方法 样品处理:!:参考国标 GB5009.33-2016 中的样品处理方法,对西洋样品参进行处理。鲜样洗净晾干后切碎混匀,四分法取适量,研钵研磨成匀浆备用(记录加水量)。 提取:称取5g(精确至0.0001g,记录)匀浆试样(按加水量折算)置于250mL具塞锥形瓶中,加入 50 g/L 的饱和硼砂溶液12.5mL 和70℃左右的水150 mL,混匀,于沸水浴中加热 15 min, 取出置冷水浴中冷放放置至室温。定量转移上述提取液至200 mL 容量瓶中,加入106 g/L亚铁氰化钾溶液 5 mL 摇匀,再加入220 g/L 的乙酸锌溶液5mL, 以沉淀蛋白质。加水至刻度,摇匀,放置30 min, 除去上层脂肪,滤纸过滤上清液,初滤液30 mL 弃去,得到的提取液即为待测液。 测定:流动分析仪上机检测。 5.1.3结果分析 表5.1 不同氮素水平下西洋参根中硝酸盐、亚硝酸盐含量变化 Table 5.1 Changes of Nitrate and Nitrite Content in Roots of American Ginseng underDifferent Nitrogen Levels 生长期 氮素水平 硝酸盐 mg/kg 亚硝酸盐 mg/kg N1 4.45±0.24c 1.38±0.21b 开花期 N2 16.81±0.48b 1.38±0.07b N3 16.62±0.32b 1.98±0.16a N4 35.49±0.27a 1.02±0.04b N1 14.37±0.21c 1.22±0.20a 收获期 N2 14.74±0.33c 0.94±0.07a N3 22.06±0.32b 1.47±0.13a N4 28.20±0.17a 1.05±0.19a 由表5.1可知,西洋参根中亚硝酸盐含量在 0.94 mg/kg~1.98 mg/kg 之间, 小于4 mg/kg, 即低于国标中所规定的蔬菜中亚硝酸盐限量标准。而参根中硝酸盐含量远高于亚硝酸盐含量,收获期的参根中硝酸盐含量范围为 14.37 mg/kg~28.20mg/kg。 西洋参根中硝酸盐含量在开花期和收获时期均表现出了随着氮肥施用量的增多不断上升的变化趋势,有明显的正相关性,这与其他作物的研究结果一致[115]。收获时期亚硝酸盐含量的变化不大,可能由于收获期参根中硝酸还原酶活性较低的缘故。 硝酸盐可经过细菌的作用,在动物体内还原成亚硝酸盐。而亚硝酸盐可使动物中毒缺氧,产生高铁血红蛋白症,智力愚钝,严重者可致死。它可间接与次级胺结合形成强致癌物质亚硝胺,从而诱发动物的消化道系统癌变。但在自然环境中,天然亚硝胺很少发现,目前出现最多的是在食品加工过程中形成。在人畜体内,它主要是通过食物或饮水,摄入它的前体物硝酸盐及胺类物质于机体内合成。因此,有效控制西洋参硝酸盐与亚硝酸盐的含量可在一定程度上保证其食用安全。 5.2氮肥对西洋参硝酸还原酶活性的影响 5.2.1实验材料和设备 实验用品:新鲜西洋参样本,冰袋或冰屑,硝酸还原酶试剂盒(购于南京建成生物工程研究所)。 实验仪器:水浴锅, ,i台式离心机,研钵,96孔酶标板,酶标仪。 5.2.2试验方法 1.测定原理: 硝酸还原酶(Nitrate Reductase,, NR)催化硝酸盐还原为亚硝酸盐,NO3-+NADH+H*→NO2-+NAD*+H2O;产生的亚硝酸盐能够在酸性条件下,与对氨基苯磺酸及 α-萘胺定量生成红色偶氮化合物;生成的红色偶氮化合物在540nm 有最大吸收峰,,可用分光光度法测定。 2.硝酸还原酶测试盒试剂组成及配制: 试剂一,2mmol/L NR标准品贮备液;试剂二,底物;试剂三,显色剂;试剂四,匀浆介质;;证试剂五,诱导贮备液。 (所有试剂均在4℃保存) 100umol/L NR 标准品应用液配制:将2 mmol/L 标准品贮备液与双蒸水按 1:19的比例混合,即将标准品贮备液20倍稀释,得到100 umol/L 标准品应用液。 诱导剂应用液配制:临用前将诱导剂贮备液与双蒸水按 1:3比例稀释,用多少配多少。 3.样本前处理: 将试剂五-诱导剂应用液倒入烧杯中备要。取新鲜西洋参掌状复叶的中叶,洗净、用滤纸吸干,将叶片放入诱导剂应用液中,浸泡诱导2h(4℃环境中)。诱导完毕后取出叶片用滤纸吸干后置于-20℃冷冻30 min, 然后再次用滤纸吸干并称取一定重量,0.3g(精确至0.0001 g)。按重量(g):体积(mL)=1:3的比例加入3倍体积的试剂四,即1.2 mL的匀浆介质,在冰浴环境中研磨制成25%的匀浆液。匀浆液在3500 r/min 离心10 min, 取上清液待测。 4.操作步骤 表5.2 具体操作步骤 Table 5.2 Specific steps 空白管 标准管 测定管 对照管 双蒸水 0.2 100 umol/L 标准应用液 0.2 样本 0.2 试剂二底物 1 1 1 1 混匀后,37℃避光水浴 30 min 试剂三显色剂 1 1 1 1 样本 0.2 充分混匀后3500 r/min 离心10 min, 取上清1 cm 光径、540 nm 比色,双蒸水调零,测定OD 值 5.计算方法: 单位定义:每克组织在37℃的条件下每小时还原1.0 umol 硝酸盐为亚硝酸盐为1个酶活力单位。 公式: NE活力h定OD对照OD值、品浓度 眼(L) 花本测前1(Ug姐织》 1标准OD值空白QD值 (100umolL)X.反应带鲜()X反店时间0) 数 5.2.3结果与分析 图5.1 氮肥对西洋参叶片 NR 活性的影响 Figure 5.1 Effect of nitrogen fertilizer on NR activity of Panax quinquefolius leaves 由图5.1可以看出 NR 活性受生育期、肥肥施用水平的双重制约。整体来看,收获期阶段 NR 活性最高,尤其是在 N2 水平下达到最高值。在N0、N1低氮水平下, NR 在生长后期活性较大,在生长的早、中期活性不高,且受氮肥施用影响较小。在高氮水平 N4 下, NR活性则受生育期的影响较大,呈上升趋势。在N2、N3 水平时 NR 活性均呈现了先升高在下降在升高的趋势,且西洋参在不同生长阶段其 NR 活性有两个高峰期,一个是盛花期、一个是收获期,这与马小军[116-117]的研究结果有些出入。这可能与环境条件、/气候条件有关,生长环境的不同(比如土壤营养状况、降水量、光照强度等)可能会导致影响西洋参对氮肥吸收和利用的一些干扰因素产生交互作用,从而产生不同的影响。本试验的研究结果表明NR 在西洋参的生殖生长初期以及参根膨大期活性较强,这可能是由于此时西洋参需要大量能量来满足果实、参根这些生殖器官的发育,需氮量增加,故而导致 NR活性增强。 图5.2 盛花期不同氮素水平下西洋参叶、根 NR 活性的变化 Figure 5.2Changes of NR activity in leaves and roots of Panax quinquefolius under differentnitrogen levels at full flowering stage 对西洋参根部 NR 活性进行检测时发现其活性较低,在盛花期时检测出了相对明显的活性变化。图5.2为盛花期时西洋参叶片与根中 NR 活性在不同氮素水平下的变化情况。分析可知,西洋参叶片 NR活性明显高于根部,说明硝态氮的还原主 要在叶片中进行,这与孙非[104]的研究结果一致。叶片 NR 活性随着氮肥的增加呈现先增加后降低的趋势,N2 时出现峰值,比N0 时活性增强近一倍,表明氮素对叶片硝酸还原酶活性具有重要影响[118]。增施氮肥使根部 NR 活性出现不同程度的增加,N2 增强最为显著,,比对照组增强7倍之多。可见, NR活性受施氮量影响较大, N2 水平时西洋参的 NR 活性最强。 15.3硝酸还酶酶与硝酸盐的关系 2.7 图5.3 硝酸盐、亚硝酸盐含量与硝酸还原酶活性变化的关系 Figure 5.3 The relationship between nitrate and nitrite content and nitrate reductase activity 由图5.3可以看出,硝酸还原酶活性的强弱影响着西洋参体内硝酸盐以及亚硝酸盐的含量。在酶活性为 1.5U/g以前,硝酸盐含量随着 NRA 的增强呈现明显的降低趋势,亚硝酸盐含量有轻微的变化;1.5U/g以后,硝酸盐与亚硝酸盐的含量变化波动极小,趋于稳定,说明硝酸还原酶活性较强反而对硝酸盐的积累影响较小,几乎没有影响,这可能是由于硝酸还原酶活性加强的同时也加速了西洋参对外界氮元素的吸收与转化,使得西洋参体内的硝酸盐含量达到了一个稳定水平。 5.4小结与讨论 1973年世界卫生组织(WHO)与联合国粮农组织(FAO)规定硝酸盐及亚硝酸盐 每日安全允许摄入量(ADI) 分别为 3.6 mg/kg 和 0.13 mg/kg。我国据此制定并不断更新相应的国家标准,在食品中污染物限量国家标准(GB 2762-2012)规定的蔬菜及其制品亚硝酸盐限量为 4 mg/kg。本研究中收获期时西洋参(即三年生西洋参)参根中硝酸盐含量变化范围为 14.37 mg/kg~28.20 mg/kg,亚硝酸盐含量在 0.94mg/kg~1.47 mg/kg 之间,低于 GB 2762-2012中的蔬菜中亚硝酸盐限量标准,但目前还未对西洋参硝酸盐做出限量。根据波兰农产品中农药残留风险评估方法(由吉林省农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全风险评估实验室提供)对西洋参中硝酸盐残留进行慢性暴露评估。经典的农产品中农药残留慢性暴露评估模型一般采用下面两个公式进行计算。 首先根据式(1)估算每日摄入量(EDI)。再根据式(2)将得到的 EDI 与世界卫生组织(WHO)等机构确定的每日允许摄入量(ADI)进行比较,得出农产品中某种农药慢性危害系数(HQ)。当HQ≤100%时,说明该农药不存在慢性健康风险。当 HQ>100%时,说明存在慢性健康风险,需要引起注意, HO越大风险越高。 (1) 式中: EDI-每日摄入量的估算值 Fi-食品消费量 RLi-农残平均残留水平 (2) 式中:HO-某种农药的危害指数 EDI-每日摄入量的估算值 ADI-每日允许摄入量 《中华人民共和国药典》2015年版中西洋参推荐服用量为 3 g/d~6 g/d[119],己列入新资源食品的人参的每日食用量不得超过 3g/dl120],据此可将西洋参的食品消 费量定为3g,再根据 JECFA 规定硝酸盐及亚硝酸盐的 ADI, 人均体重按 60 kg计算,西洋参中硝酸、亚硝酸盐的平均残留水平按照本实验的最高含量计算,得到西洋参硝酸盐的 HO为 0.04%,亚硝酸盐的 HQ为0.06%,远远小于100%,说明西洋参中硝酸盐、亚硝酸盐不存在慢性健康风险。因此,西洋参在硝酸盐污染方面具有相对安全的食用性。 本研究中,参根中硝酸盐含量在收获期时与与素水平呈明显的正相关性, NR活性规律则是呈现先增后降的趋势,说明硝酸盐与 NR 活性在一定氮素水平下是呈负相关性的,,-与早期蔬菜中的相关研究结果硝态氮的积累与NR 活性成负相关[121]一致。可见,硝酸盐的积累并不是单一物质的转化,除施氮量的不同外,其积累规律还受到多种因素的制约,如不同生育期西洋参生长所需氮量的不同;7不同氮素形态也会产生不同的影响;NR 对硝酸盐的转化起关键作用,其活性也受到许多因素的影响。 NR 是植物氮素同化的限速酶,氮代谢过程中的关键酶,,与作物吸收利用氮肥有关,能迅速反应植物氮代谢状况,并对作物的产量和品质有影响。NR 主要存在于细胞质中,在根系和叶片中都有分布,但分布量不同。本研究结果显示西洋参叶片 NR 活性远高根部,低施氮水平下,西洋参叶片 NR 活性受氮素水平影响较小,在生长的早中期活性较小,在参根膨大的生长后期活性增大;在中氮水平下,NR活性呈现先升高在下降在升高的趋势,其中有两个高峰期,分别为开花期和收获期;高氮水平下,NR 活性随生育期的变化成上升趋势。总的来说,西洋参 NR 活性受氮肥施用量及生育期变化的双重制约,,可以收获期 N2 水平活性最强。NR 的活性被多种因素所调控,有研究发现适当增加氯离子可增强 NR 的活性,还有实验证明外源 NH4*还可以通过终产物的抑制来降低硝酸还原酶的活性[122]。 要想提高西洋参的氮肥利用率,可根据不同施氮水平、不同生育期酶活性的大小以及硝酸盐积累情况,适当施加氮肥,在提高西洋参的产量及质量的同时增强了食用安全性。 结论与展望 一、结论 植物的光合作用在其生长过程中占有极其重要的地位。而表观性状则是氮肥对西洋参生长影响的最直接体现。在本研究中,作为叶绿素含量指标的 SPAD 值以及光合速率这两个指标随着氮肥用量的增加呈现了先增加后下降的变化趋势,峰值在N2(10 g/m²)水平时出现,此时 SPAD 值明显高于对照组,说明适宜氮肥用量对西洋参的光合作用有很好的促进作用。西洋参的生长指标叶面积、叶重、茎高、茎重、根长、根径、根重随着施氮量的增加呈现了一定规律性的变化。与 SPAD值、光合速率的变化规律一致,多数生长指标都在施氮量为 10 g/m²的水平时(即N2)达到有最高值,且绝大部分有显著性差异。以红果期为例,适宜施氮量N2 比对照组叶面积增加77.91%,叶重增重75.39%,茎高增长0.5%,根长增加5.89%,根径提高31.78%,根重增长25.54%。另外适当增加氮肥用量可以显著增加西洋参的产量,在N2水平时,,西洋参产量达到峰值为 107.58 g/m²。 本研究中,氮肥对西洋参质量产生的影响主要体现在四种有效成分上,即糖、皂苷、蛋白质以及氨基酸。施氮量的增加对这四种有效成分的积累产生了一定的影响。茎叶中,有效成分含量随氮肥用量的增加呈现先升高后降低的趋势,可溶性总糖在N1时有最大值13.45%,比对照组增加25.40%,差异显著;总皂苷含量在N1 水平为10.35%,亦有所提高;蛋白质同样在N1 时达到峰值,差异不显著。参根中,可溶性总糖在N1、N2水平的均表现较高郊含量,比对照组 NO 显著增加25.40%和 24.24%,持续增加量肥含量则会明显降低可溶性总糖的积累;总皂苷在N2时出现最大值,含量为4.34%,比对照组增长18.29%;蛋白质含量在较低氮素浓度时含量变化不明显,含量在9g/100g 左右,在 N4 高氮水平下积累量显著降低;氨基酸含量随氮素水平的提高出现不同程度的增加,其中N1 水平增加量最多,比对照组显著增加22.19%。总体分析,N1与N2 施氮水平下西洋参有效成分的积累提高最为明显,施肥量为5 g/m²~10 g/m²时有助于两年生西洋参体内有效成分的 积累。 在西洋参鲜食安全性方面对西洋参体内硝酸盐含量的积累情况进行研究,发现西洋参体内硝酸盐的积累随氮素水平的提高出现不同程度的增加,在N2时增加幅度相对较小。本研究结果显示,两年生西洋参收获期根中硝酸盐与亚硝酸盐含量在14.37 mg/kg~28.20 mg/kg 和 0.94 mg/kg~1.47 mg/kg范围内,低于国标(GB2762-2012)中规定的蔬菜及其制品的限量标准。根据波兰农产品中农药残留风险评估方法对西洋参中硝酸盐残留进行慢性暴露评估发现,西洋参中硝酸盐、亚硝酸盐的 HO分别为 0.04%和 0.06%,远远低于100%,说明西洋参中硝酸盐、亚硝酸盐不存在慢性健康风险,具有食用安全性。 从西洋参生长、产量、质量、硝酸盐含量等几方面综合比较分析,确定 N2 水平即施氮量为 10 g/m² 为本实验中西洋参栽培的适宜施氮量。为农田栽培西洋参的科学有效施肥提供参考依据。 、展望 本研究以两年生西洋参幼苗为研究对象,发现其生长过程中有效成分在不同生育期的积累情况不同;有效成分在不同部位的分布不同;不同部位有效成分的含量受氮肥影响的规律不同。这说明西洋参在生长的不同时期对氮肥的需求量以及用于合成的主要活性物质、主要合成部位等不同。针对这一研究结果,笔者认为接下来的工作重点应该放在以下几个方面: 1,开展单一氮元素对三年生、四年生以及五年生西洋参幼苗生长的影响实验,进一步分析氮对西洋参生长的影响,确定不同参龄西洋参对氮的吸收利用情况,为农田栽参提供更全面的参考;2,利用同位素示踪法开展外源氮素在西洋参生长与品质的影响机制研究,,明确追施氮肥在土壤中的形态分布以及外源氮素在西洋参体内的富集、迁移规律,为西洋参合理施用氮肥提供更为有力的科学依据;3,地域不同,参地土壤肥力各不相同,为此应实施测土栽培,开展营养素丰缺对西洋参氮代谢影响的研究,用有机肥代替单一一肥,改善西洋参栽培的土壤微环境,为提高氮素利用率提供基础条件;4,对西洋参不同生育期、不同部位的有效成分 进行全面分析,以期为西洋参的全面、高效利用提供理论依据。 针对西洋参硝酸盐积累方面,还应从以下几个方面进行研究: 1,进行同位素示踪实验探索西洋参硝酸盐积累的机理;2,从不同部位硝酸还原酶活性的强弱与硝酸盐积累含量角度出发,细致研究硝酸盐积累与硝酸还原酶活性的关系;3,对硝酸盐转化机制中的其他活性酶进行检测;4,为进一步确定西洋参的安全用量,还需全面检测不同施氮量下不同年生西洋参以及各种西洋参制品中硝酸盐的含量,以期建立完备的西洋参体内硝酸盐含量的信息库,为安全食用药用西洋参提供参考。笔者认为还应该从西洋参食用者的角度出发,采用跟踪调查的方式,选取正在食用西洋参及其制品的老年人、中年妇女等群体为调查对象,测定不同人群每日从其他途径摄入的硝酸盐含量,确定还可接受的从西洋参中摄入硝酸盐的含量,从而确定西洋参食用安全标准,同时也为老年人、病人等特殊人群制定安全的膳食食谱提供有价值的参考。 ( 参考文献 ) ( [1]高晖富,姜丽萍 , 姜志辉,等.不同方法测定不同产地西洋参中人参皂苷含量[J].人参研 究,2017(4):6-8. ) ( [2]尚金燕,李桂荣,邵明辉,等.西 洋 参的药理作用研究进展[].人参研究,2016,28(6): 49-51. ) ( [3]钟均超.长白山区西洋参、人参农田土栽培技术研究[D].延边:延边 大 学,2006. ) ( [4]赵树清,载新荣.西洋参研究进展[].广东药学,2005,15(6): 63-65. ) ( [5]孙贺.西洋参养分积累规律的研究[D].长春: : 吉林农业大学中药材学院,2008. ) ( [6]舒秀丽.不同土壤处理对西洋参连作障碍的影响[D].泰安:山东农业大学农学院,2011. ) ( [7]张敏芝.西洋参与人参鉴别方法对比研究[J].河南中医,2009,29(11):1122-1123. ) ( [8]渠琛玲.西洋参化学组分的研究[D].长春:吉林大学,2009. ) ( [9]黄林芳,索风梅,宋经元,等.中国产西洋参品质变异及生态型划分[].药学学报,2013, 48(4):580-589. ) ( [10]周海燕,赵润怀,傅建国,等.国产西洋参生产及商品规格质量的调查分析[J].中国现代 中药,2013,15(4):324-328. ) ( [11]吴雨桐.人参、西 洋 参的比较研究概况[J].现代食品 , 2016(15):57-60. ) ( [12]刘佳.吉林产区人参、西洋参化学和蛋白差异性对比研究[D].北京:北京中医药大学, 2013. ) ( [13]贾婵.不同产地西洋参的品质评价[D].北京:北京协和医学院,2017.[14]隋春青,李早永,吕文,等.西洋 参 种子处理与播种技术[J].中国种业,2013(6):84-85. ) ( [15] Cruz J L , Mosquim P R, Pel a cani C R , et a l . Pho t osynthesis impairment in cassava leaves inresponse to nitrogen deficiency[J].Plant and Soil, 2003, 275 (2):417-42 3 . ) ( [16]郑冬梅.不同氮素形态及用量对三七生长、品质和生理特征的影响[D].昆明:云南民族大学,2015. ) ( [17]何志学.氮素水平对辣椒生长生理和养分利用的影响[D],兰州:甘肃农业大学农艺学院, 2016. ) ( [18]黄璐琦,孙丽英,张小波,等.全国中药资源普查(试点)工作进展情况简介[J].中国中药 杂志,2017,42(22): 4256-4261. ) ( [19] 张泽坤,张小波,杨光, 等 .中药资源评估方法探讨[J].中国中药杂志,2018,43(15): 3223-3227. ) ( [20]张铁军,王文燕.中药资源研究与开发战略[J].中草药,2005,36(4):626-627. ) ( [21]黄璐琦,彭华胜,肖培根.中药资源发展的趋势探讨[J].中国中药杂志,2011,36(1):1-4. ) ( [2 2 ]肖博今,李丹祈.我国药用植物栽培历史与概况[J].世界最新医学信息文摘,2018, 18(37):41-42. ) ( [23]朱伟群,王丽君,梁攀,等.中药资源可持续发展的现状与未来[J].世界中医药,2018, 13(7):1752-1755. ) ( [24]高微微,赵杨景,王玉萍,等.我国药用植物栽培地的可持续利用研究[J].中国中药杂志, 2006,31(20): 1665-1669. ) ( [25]袁勇,黄慧莲,刘贤旺.无机肥料对中药有效成分含量的影响[].江西林业科技,2000 (1):29-30,38-39. ) ( [26]梁娟,胡海丽,杨伟.不同供氮水平对天门冬生长和品质的影响[J]. 中 国土壤与肥料, 2016,(1): 53-56. ) ( [27]梁娟,叶漪,杨伟.不同氮素形态及配比对天门冬生长和品质的影响[J].中国土壤与肥 料,2018(1):28-31. ) ( [28]卢丽兰,杨新全,杨勇,等.不同供氮水平对广藿香产量与品质的影响[J].植物营养与肥 料学报,2014,20(3):702-708. ) ( [29]朱虹,郭晓瑞.硝态氮浓度对长春花体内生理代谢指标的影响[响].东北林业大学学报, 2013,41(11):63-65. ) ( [30]朱孟炎,于博帆,陈华峰.外源硝态氮水平对长春花生理代谢的影响[J].植物研究,2016, 36(4):535-541. ) ( [31]凌敏. 气雾栽培条件对传统中药车前草品质的影响[D].广州:广州中医药大学中药学专 业,2015. ) ( [32]刘大会,朱端卫,郭兰萍,等.肥肥用量对药用菊花生长及其药用品质的影响[].植物营 养与肥料学报,2012,18(1):188-195. ) ( [33]欧小宏,张智慧,郑冬梅,等.氮肥运筹对二年生三七产量、品质及养分吸收与分配的影 响[J].中国现代中药,2014,16(12):1000-1005, 10 1 4. ) ( [34]张杰,黄海棠,杨立均,等.氮素形态对烟草生长及品质影响的研究进展[J].中国农学通 报 ,2018,34(15):38-43. ) ( [35]叶芳,刘晓静,张进霞.氮素形态对紫花苜蓿不同生育期生长特性的影响[J].甘肃农业大学学报,2015,50(1):116-122. ) ( [36]张迪迪,张亚玉.氮形态对药用植物生长及品质影响的研究进展[J].中药材,2016,39(3): 696-698. ) ( [37] Wright M J, D a vison K L. N itrate accumulation in crop s and n itrate poisoning in an i mals[J].Advances in Agronomy, 1964,1 6 :197-247. ) ( [38] Comly H H. Cya n osis in i n fa n ts caused by nitrates in w e ll water[J]. The J ournal of th e American Medical Association , 1987,257(20):2788-2792 ) ( [39]徐虹,韩松.同步测定硝酸盐和亚硝酸盐方法的研究进展[J].实用医药杂志,2014,31(2): 177-178. ) ( [40]顾翔宇,郭军.硝酸盐/亚硝酸盐检测方法的研究进展[J].中国食物与营养,2016,22(3): 24-28. ) ( [41]黄小红.食物中的硝酸盐与人类健康[].中国新技术新产品,2011(7):256. ) ( [42]杨芸.不同小白菜品种硝酸盐积累差异及及光照、温度和湿度调控机理研究[D].重庆: 西南大学,2015. ) ( [43]王朝辉,李生秀,田霄鸿.不同氮肥用量对蔬菜硝态氮累积的影响[J].植物营养与肥料 学报,19 9 8, 4(1):22-28. ) ( [44]陆正松,赵玲,张硕,等. 土 壤污染、施肥对稻米和蔬菜品质的影响[].土壤肥料,2001(4): 13-16. ) ( [45]卢凤刚,陈贵林.氮素浓度及形态对韭菜硝酸盐及硝酸还原酶活性的影响[J].北方园艺, 2011,(4):41-43. ) ( [46]贾长青,胡喜巧,成元刚,等.不同氮素形态及配比对红花芽菜产量和硝酸盐积累的影响 [J] . 科技信息,2011, (23): 449-450. ) ( [47]张勇.蔬菜硝酸盐积累机理与调控技术的研究[D].瞻洲市:华南热带农业大学农学院, 2002. ) ( [48] GB2767-2017 食品安全国家标准食品中污染物限量[S]北京:中国食品卫生杂志,2018. ) ( [49]黄海燕,卢晓峰.中药鲜药的现代应用浅析[J].浙江中医杂志,2011,46(1):61-62. ) ( [50]陈斌,贾晓斌.鲜药物质基础的研究进展与研究策略[J].中草药,2012,43(3): 592-597 ) ( [5 1 ]王谷强.鲜活西洋参在中医养生康复中的奇特作用[C].见:第十次全国中医养生康复学.术会议论文集,兰州:中国会议,2012.116-118. ) ( [52]郭建华,田成旺,张铁军.鲜药研究的状况与展望[].药物评价研究,2011,34(3): 20-223. [53]任晓莉.贮藏与养护中药鲜药[J].实用中医内科杂志, 2013,27(7):137-138. ) ( [54] 周焕 第 ,李丽.中药鲜药的药理作用和临床应用研究概况[J].中国民族民间医药,2012, 21(1):43-45. ) ( [55]曾建国.药材鲜用与用鲜药材初加工[].首都医药,2013,20(3):48-49. ) ( .[56]陶嘉磊,张宏如.鲜药在温病中应用浅析[J].时珍国医国药,2014,25(3): 689-690. ) ( [57]李家磊,卢淑雯,任传英,等.西洋参贮藏保鲜技术的研究进展[J].中国食物与营养, 2015,21(11):27-31. ) ( [58]陈德经.西洋参保鲜过程中有效成分的变化[J].食品科学,2 0 14,35(14):155-158. ) ( [59]张建逵,高睿,康廷国,等.西洋参鲜品与干品蛋白质、维生素C、维生素E、挥发油成及超氧化物歧化酶活性的比较[J].中国实验方剂学杂志,2013,19(8):102-106 ) ( [60]丁立威.国产西洋参产供销趋势分析[J].特种经济动植物,2014,17(1):7-11. ) ( [61]庞小存.常用中药材中亚硝酸盐及硝酸盐等六种阴离子含量分析及比较[D]. 北京:北京中医药大学,2016. ) ( [62]庞小存,王东辉,李先恩.丹参药材中亚硝酸盐和硝酸盐的含量比较[J].中国实验方剂 学杂志,2017,23(13):48-53. ) ( [63]马冬云,郭天财,宋晓,等.施氮对冬小麦旗叶 RuBP 羧化酶活性及叶绿素荧光参数的影 响[J].西北植物学报,2010,30(11):2197-2202. ) ( [64]马存金,刘鹏,赵秉强,等.施氮量对不同氮效率玉米品种根系时空分布及氮素吸收的调控[J].植物营养与肥料学报,2014,20(4):845-859. ) ( [65]吴中伟,樊高琼,王秀芳,等.不同氮肥用量及其生育期分配比例对四川丘陵区带状种植小麦氮素利用的影响[J].植物营养与肥料学报,2014,20(6):1338-1348. ) ( [66]陈光,李向高.西洋参氮素营养特性的研究[J].吉林农业大学学报,2000,22(4): 59-63. ) ( [67]赵杨景.西洋参对不同氮源N的吸收利用和在体内的分布[J].核农学报,1998,12(1): 28-34. ) ( [68]杜静,杨家学,焦晓林,等.氮、磷、钾缺乏对西洋参根分泌物中酚酸类化合物的影响[J]. 中国中药杂志,2011,36(3):326-329. ) ( [69]宋飞,李世清 , 王辉.施氮对灌浆期冬小麦不同叶片 SPAD 值及光合速率的影响[].麦类 作物学报,2006,26(6):172-174. ) ( [70]KropffM J, Gassman K G, Van Laar H H, et a l .. Nitrogen andyield potential of irrigated rice[J ] .Plant and Soil, 1993, 155(1):391-394. ) ( [71]阙金华,张洪程,戴其根,等.氮肥对稻米品质影响的研究进展[J].耕作与栽培,2003(1): 11-12,54. ) ( [72]刘立军,王志琴,桑大志,等.氮肥运筹对水稻产量及稻米品质的影响[J].扬州大学学报, 2002,23(3):46-50. ) ( [73]曹翠玲,李生秀.供氮水平对小麦生殖生长时期叶片光合速率、NR活性和核酸含量及产 量的影响[].植物学通报,2003,20(3):319-324. ) ( [74]贾良良,陈新平,张福锁.作物氮营养诊断的无损测试技术[J].世界农业,2001(6):36-37. ) ( [75]刘艳春,樊明寿.应用叶绿素仪 SPAD-502 进行马铃薯氮素营养诊断的可行性[J].中国 马铃薯,2012,26(1):45-48. ) ( [76]戈长水,应武,杨虎,等.叶绿素计(SPAD-502)在水稻氮素营养诊断和推荐施肥中的应 .用、 研 究及展望[J].农业科技通讯,2014(2):8-13.铃薯,2012,26(1):45-48. ) ( [77]李录久.施用氮磷钾对生姜产量和品质的影响[D].北京:中国农业科学院,2009. ) ( [78]宋月,刘艺,张强,等.西洋参茎叶中皂苷、多糖联合提取工艺研究[J].中华中医药学刊, 2016(9):2158-2160. ) ( [79] 汪亚菁,苏宁,金建明.西洋参茎叶化学成分研究进展[].中国现代中药,2016,18(9): 1224-1229. ) ( [80]逢世峰,李亚丽,许世泉,等.西洋参不同部位人参皂苷类成分研究[].中国林副特产, 2015(2):1-3. ) ( [81] 侯集瑞.国产及进口人参和西洋参药材质量的对比研究[D].长春:吉林农业大学中药材 学院,2003. ) ( [82] Zhang K, Wang X, Ding L, et al. Determination of Seven Major Ginsenosides in Different Partsof Panax q uinquefolius L.(American Ginseng) w ith D i fferent A ges[J]. Chemical R esearch in.Chinese Universities, 2008, 24(6): 707-711. ) ( [83]齐滨,刘莉,赵大庆,等.人参、西洋参和红参中糖类含量的比较研究[J].中国药房,2013, 24(7):616-618. ) ( [84]杨修仕.西洋参品质评价、多糖提取纯化工艺及生物活性研究[D].山西:山西大学环境科 学研究所,2014. ) ( [85]于晓娜.西洋参多糖的提取分离及活性研究[D].山东:齐鲁工业大学食品与生物工程学 院,2014. ) ( [86]张懿,张大兵,刘曼.植物体内糖分子的长距离运输及其分子机制[J].植物学报,2015,50(1): 107-121. ) ( [87]郑毅男,孟祥颖,张晶,等.红参中新化合物精氨酸苷的生成机理及生成条件的研究[J].中 国药物化学杂志,1997,03(25): 217-219. ) ( [88]李蕾,谢丽娟,王国明,等.人参、西洋参不同部位提取物中14种皂苷含量比较[J].人参 研究,2018,30(3): 1 1-13. ) ( [8 9 ]王炜明,赵东娇.西洋参中有效成分及其抗肿瘤关系的研究进展[J].中国民族民间医药, 2013,22(10):43-44. ) ( [90]张崇禧,鲍建才,李向高,等. HPLC 法测定人参、西洋参和三七不同部位中人参皂苷的 含量[J]. 药 物分析杂志,2005,25(10): 11 9 0-1194 ) ( [91]姚华.人参皂苷微波辅助降解产物及其生物活性研究[D] . 长春:吉林大学化学学院, 2015. ) ( [92] Xu H , Y u X, Qu S, et a l. Protective effect of 20(S)-protopanaxadiol sapo n ins, isol a ted fromPana q uinquefolium, o n permanent focal cerebral i s chemic in j ury in rats[J]. E xperimental &Therapeutic Medicine,2014,7(1):165-170. ) ( [93] Xu H, Yu X, Qu S, e t al. In vive and in vi t ro cardioprotective effects of panax quinquefolium20(S)-protopanaxadiol saponins (PQDS), is o lated from panax qui n quefolium[J]. Pha r mazie, 2013 , 68(4):287-292. ) [94] Wang H X, Ng T B. Quinqueginsin, a Novel Protein with Anti-Human Immunodeficiency ( Virus, Antifungal, R ibonuclease an d Cell-Free Translation-Inhibitory Act i vities fro m Amer i canGinseng Roots[J]. Biochemical and Biophysical Research Communications, 2000, 269(1):0-208. ) ( [95] N g T B, W a ng H. Panaxagin, a new protein fr o m Chinese ginseng possesses anti-fungal,anti-viral, translation-inhibiting and ribonuclease activities[J]. Li f e Sc i ences, 200 1 , 68(7):739-749. ) ( [96]徐云凤,赵雨,张惠,等.人参蛋白对小鼠的耐缺氧及抗氧化作用[].食品科技,2012, 37(3):79-82. ) ( [97]徐云凤,赵雨,幺宝金,等.人参蛋白对高脂血症模型大鼠的降泽脂作用[J].中药新药与 临床药理,2011,22(2):138-141.. ) ( [98]李红艳,赵雨,孙晓迪,等.人参蛋白抗辐射损伤作用研究[J].时珍国医国药,2010,21(9): 2143-2144. ) ( [99]李红艳,代永霞,张江华,等.人参蛋白对过氧化氢致神经元损伤的保护作用[J].中国医 院药学杂志,2015,35(21):19 0 6-1910. ) ( [100]徐云凤,赵雨,邢楠南,等.人参蛋白对小鼠抗疲劳作用的研究[J].食品工业科技,2011, 32(11):406-407,436. ) ( [101]李红艳,曹阳,白雪媛,等.人参蛋白对β淀粉样蛋白1-40和H2O2损伤神经元的保护作用及其机制[J].吉 林 大学学报(医学版),2013,39(6):1138-1142. ) ( [102]李红艳,赵雨,孙晓迪,等.人参蛋白对小鼠免疫功能影响的研究[J].亚太传统医药, 2010,6(1):14-16. ) ( [103]刘佳.吉林产区人参、西洋参化学和蛋白差异性对比研究[D].北京中医药大学,2013. ) ( [104]孙非,曹悦群,孙立侠,等.不同光质对西洋参硝酸还原酶(NR)活性和蛋白质含量变化的影 响[J]. 中 草药, 1992,23(5):260-263,280. ) ( [105]于海燕,付乃鑫,万勇善,等.不同施氮量对花生生理特性和产量的影响[].山东农业科学, 2018,50(6): 1 45-149. ) ( [106]周敏.应用不同柱前衍生法于 HPLC 测定西洋参中的氨基酸[].基因组学与应用生物学, 2018,37(2):524-530. ) ( [107]刘丽敏,王海敏,虞海霞,等.柱前衍生反相高效液相色谱法测定西洋参中游离氨基酸[]. 中成药,2009,31(2):275-278. ) ( [108]王秋,刘莉,何慧楠,等.不同生长年限西洋参不同部位氨基酸含量比较研究[J].中华中 医药杂志,2017,32(8):3692-3695. ) ( [10 9 ]李向高 , 郑友兰, 贾 继红.西 洋 参的氨基酸成分的分析[J].中国中 药 杂志,1985,10(5): 33. ) [110]岳彬.人参与西洋参根中氨基酸积累规律的研究[D].长春:吉林农业大学农学院,2008. ( [111]陈俭霖.蔬菜硝酸盐累积机制及其调控措施研究进展[].污染防治技术,2005,18(3): 29-31,38. ) ( [112] Chen B M , Wang Z H , Li S X, e t al. Eff e cts of n itrate supply on pl a nt growth, ni t rateaccumulation, m e tabolic n i trate concentration and nit r ate reductase activity in thre e leafyvegetables[J]. Plant Science, 2004,167(3):635-643. ) ( [113]张贵龙,任天志,邱建军,等.日光温室白萝卜生产系统的氮素利用与平衡研究[J].农 业环境科学学报,2009,28(7):1500-1507. ) ( [114]廖鸿昕.设施菜地蔬菜硝酸盐的积累与减控农艺措施研究[D].湖南:湖南农业大学, 2011. ) ( [115]李殿波,郑禾,李海东,等.不同施肥处理对菠菜硝酸盐及亚硝酸盐含量的影响[J].北方园 艺,2014,1(3):1 6 6-168. ) ( [116]马小军,陈震,赵扬景,等.西洋参营养特点的研究Ⅵ.西洋参硝酸还原酶的研究[].中 草药,1995,26(7):375-376,393. ) ( [117]马小军,陈震,赵杨景,等.西洋参氮肥施用方法与硝酸还原酶活性的关系[J].中国中药 杂志,19 9 3, 1 8 (10):591. ) ( [118]梁雄.氮素营养对三种药膳植物生理效应的影响[D].湖南:湖南农业大学, 2011. ) ( [119]国家药典委员会.中华人民共和国药典:2015年版.一部[M].中国医药科技出版社,2015.[12 0 ]卫生部.关于批准人参(人工种植)为新资源食品的公告[J].中国食品添加剂,2012, (5): 254. ) ( [121]胡承孝,邓波儿,刘同仇.施用氮肥对小白菜、番茄中硝酸盐积累的影响[J].华中农业大 学学报,1992,11(3):239-243. ) ( [122]李莹,陈冰星,郭容芳.无土栽培番茄果实中亚硝酸盐积累的规律[].园艺与种苗,2017, (4):3-5. ) 附录A色谱图 1. 糖(代表性色谱图) 1.果糖;2.葡萄糖;3.蔗糖;4.麦芽糖 2.皂苷(代表性色谱图) 3.氨基酸(代表性色谱图) 在学期间公开发表论文及著作情况 论文发表情况: [1]曹欣欣,曹庆军,杨粉团,姜晓莉,孔凡丽,卢丞文,李刚.影响西洋参中皂苷含量的因子分析[J].东北农业科学,2018,43(05):43-46. [2]曹欣欣,孔凡丽,杨粉团,曹庆军,姜晓莉,李刚.不同氮素水平对西洋参体内皂苷积累的影响[J].东北农业科学(已录用). ( 主持项目: ) ( [1 ] 吉林省农业科技创新工程(C7208000408),省级,2 0 17.11-2019.3,1/ 4 . 参与项目: ) ( [1 ] 吉林省科技发展计划项目 (201603081YY),省级,2016-2018. ) ( [2]吉林省农业科技创新工程(CXGC2017TD011):农产品质量安全创新团 队,省级,20 1 7-2020. ) 致 谢 从踏入大学的大门到今天的研究生毕业,我已在长春这个第二故乡求学七年,在这七年的时间里有艰辛也有收获,更多的是感恩,感恩在我求学生涯中遇到的每一个帮助过我的人。回首研究生三年,时光一晃而过,,留在我心中的是充实的生活,道不尽的回忆。在我研究生生活即将结束之际,首先诚挚的感谢我的恩师吉林省农业科学院李刚老师。三年前有幸成为您的学生,您慈祥的面容、和蔼的语气总会在我遇到困难时给与我砥砺前行的勇气,让我更加自信。三年前从对科研工作的一无所知到现在的独立完成研究工作,您严谨的治学态度、渊博的专业知识深深地影响着我,为我在今后的学习工作树立了榜样。 衷心的感谢我长春师范大学的导师卢丞文老师,感谢这三年来对我的支持与鼓励。卢丞文老师从我入学到现在,无论在实验上还是在生活都给与了我很大的鼓舞与帮助。 由衷的感谢我们科研团队的杨粉团老师和曹庆军老师对我的帮助。杨粉团老师和曹庆军老师在我进入这个团队伊始就给予了我很大的帮助。从实验的设计、问题的分析、数据的采集、论文的整理每一个环节都有他们的耐心指导与倾心帮助。在我遇到困难时总能够尽心尽力的帮我克服,不辞劳苦的给我提建议想办法。这份恩情终身难忘。 感谢孔凡丽师姐在实验上给与我的帮助,孔凡丽师姐从一开始加入我们团队就倾心帮助我做实验,经历了很多的辛苦。我们一起克服了很多实验过程中遇到的问题,使我的实验能够顺利的进行。由衷的感谢师姐在实验过程中付出的辛勤汗水。 真诚的感谢姜晓莉老师,姜老师作为李刚老师珀爱人,对我的学习与生活都给予了无私的帮助与支持。 感谢中国农业科学院左家特产研究所雷秀娟老师、张秀莲老师以及许世泉老师、于老师在实验上对我的帮助,为我提供了宽松和谐的科研平台,帮我解决了 许多科研上的问题。 感谢参田的工人,他们吃苦耐劳、热情好客,拥有多年栽参的种植经验,在我进行田间采样时期给予了很多的帮助。在此特别感谢苏德悦、迟秀宇、韩师傅等人的大力帮助。 衷心的感谢质标所宋志峰老师、孟繁磊老师、刘笑笑老师、何智勇、王嵩、王莹、赵晓霞;环资所的梁尧老师、吕老师、郑洪兵老师;生物所的郭东全老师,谢谢你们为我实验过程中提供的无私帮助,使我的实验能够顺利的进行。 感谢为我们学生工作付出辛勤汗水的李雪老师、丁亦男老师、胡冠男老师。 感谢和我一起学习、生活、奋斗的同窗和室友,你们乐观的生活态度,为我们营造了和谐的生活环境,与你们朝夕相处之间,感受到了姐妹情谊,在生活上给予了我很大的支持与鼓励,也祝你们前程似锦。 最后,我要谢谢我最亲最爱的家人,感谢父母这二十多年来的养育之恩和姐姐对我学习生活的支持与鼓励,谢谢你们二十多年来为我付出了无尽的汗水与努力,给予了我无私的爱护。 在此向参加本论文评阅、审议、答辩的专家以及参与答辩的工作人员致以诚挚的谢意! I 实验样品:过100 目筛干燥西洋参粉末,标准品EDTA(意大利VELP 公司)。主要设备:NDA701 杜马斯定氮仪(意大利VELP)检测指标:氮肥对西洋参蛋白质含量的影响实验结果:蛋白质平均含氮16%左右,在理论上氮肥对其含量的积累应有一定的影响,而蛋白质的含量也往往影响着西洋参的生长及品质,研究合理的施氮量十分重要。本节着重讨论了氮肥施用量对西洋参展叶期及收获期的蛋白质含量影响,及植株体内蛋白质含量受生长期时期的影响。综合分析可知有以下结论:1.西洋参茎叶蛋白含量明显高于根部,且茎叶蛋白质含量随西洋参植株生长的进行呈现了不断降低的规律性变化,而根部则无明显规律。蛋白质在参根中的积累过程是逐渐进行的,此过程主要可能是靠叶片运输,因此茎叶蛋白会不断减少。本实验中西洋参根中蛋白质含量没有明显变化,但由于参根的膨大,参根蛋白的产出量明显增加。2.茎叶蛋白质含量受氮肥量的影响呈现出先升高后降低的趋势,在N1 时含量达峰值,比对照组增加3.8%,差异不显著。适当増施氮肥会提高植株叶片蛋白质的含量。3.根部蛋白质含量随氮素含量的增多呈现缓慢降低的趋势,在N1、N2、N3时蛋白质含量分别比对照组降低6.28%,7.25%,9.93%,差异不显著,在N4 时明显降低13.30%。可能由于天气等原因,使茎叶中的蛋白质向根部转移减少,同时根部还需大量能量来抵御外界不利环境带来的影响,因此本研究中参根蛋白质含量没有表现出与茎叶相同的变化趋势。 因此,若单一考虑蛋白质积累的情况下,可选择不施加氮肥的施肥方案来保证西洋参蛋白质含量的积累。研究意义:本课题通过研究不同氮肥水平对西洋参农艺性状、产量、有效成分的影响,了解西洋参的需氮规律,确定适宜施氮量,为农田栽参合理科学施肥提供依据,不仅能够有效提高西洋参的产量,同时也使其质量得到保障。合理的施肥一方面能为参户创收,让有限的土地资源发挥巨大的经济利用价值;另一方面减少了氮肥滥施的现象,降低了生产成本也保护了环境、土地资源。另外本课题还通过研究氮肥对西洋参体内硝酸盐积累的影响,了解氮肥用量与硝酸盐积累的关系,确定西洋参体内硝酸盐含量的积累情况,为西洋参食用药用安全性评价提供更多理论依据。
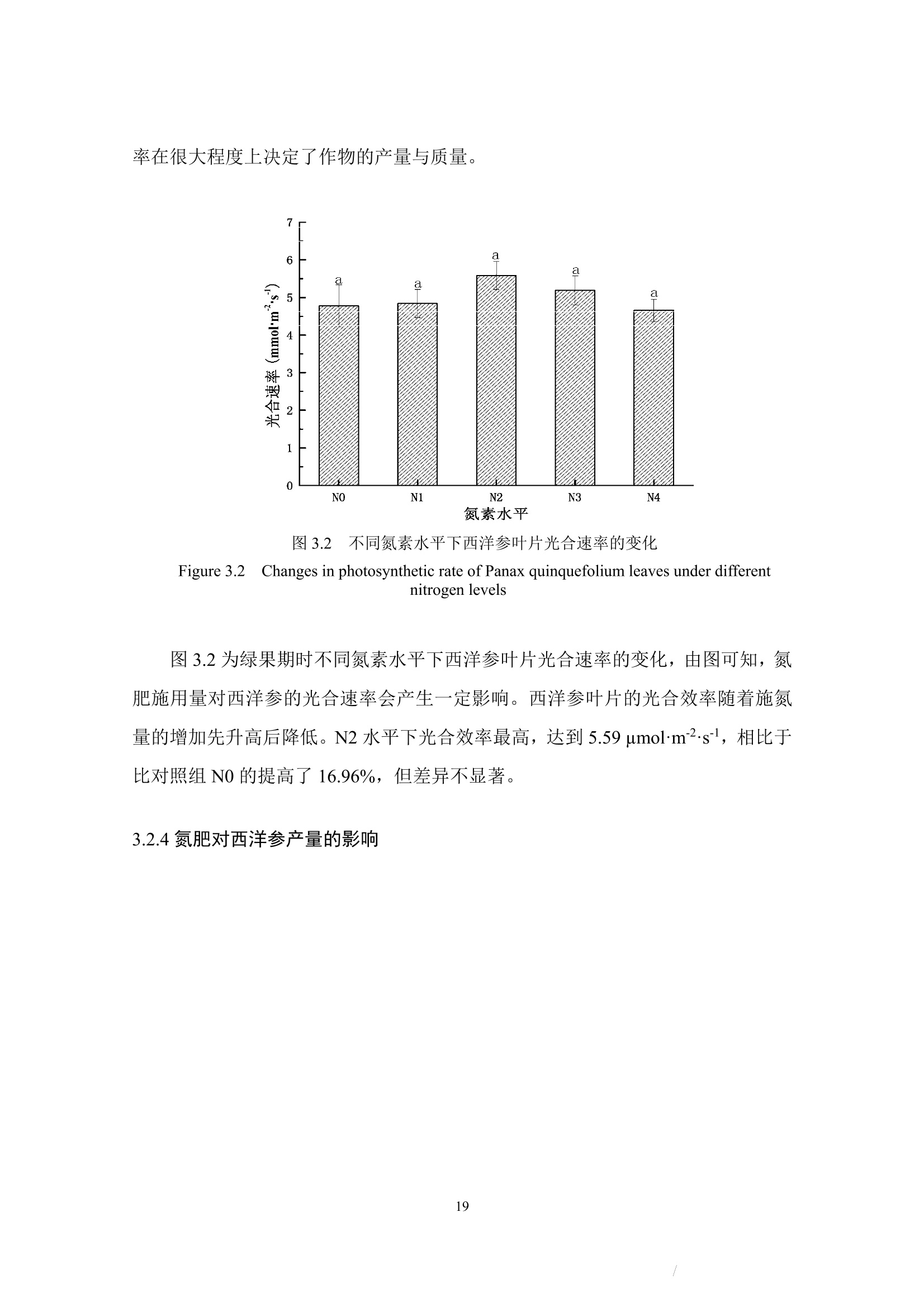
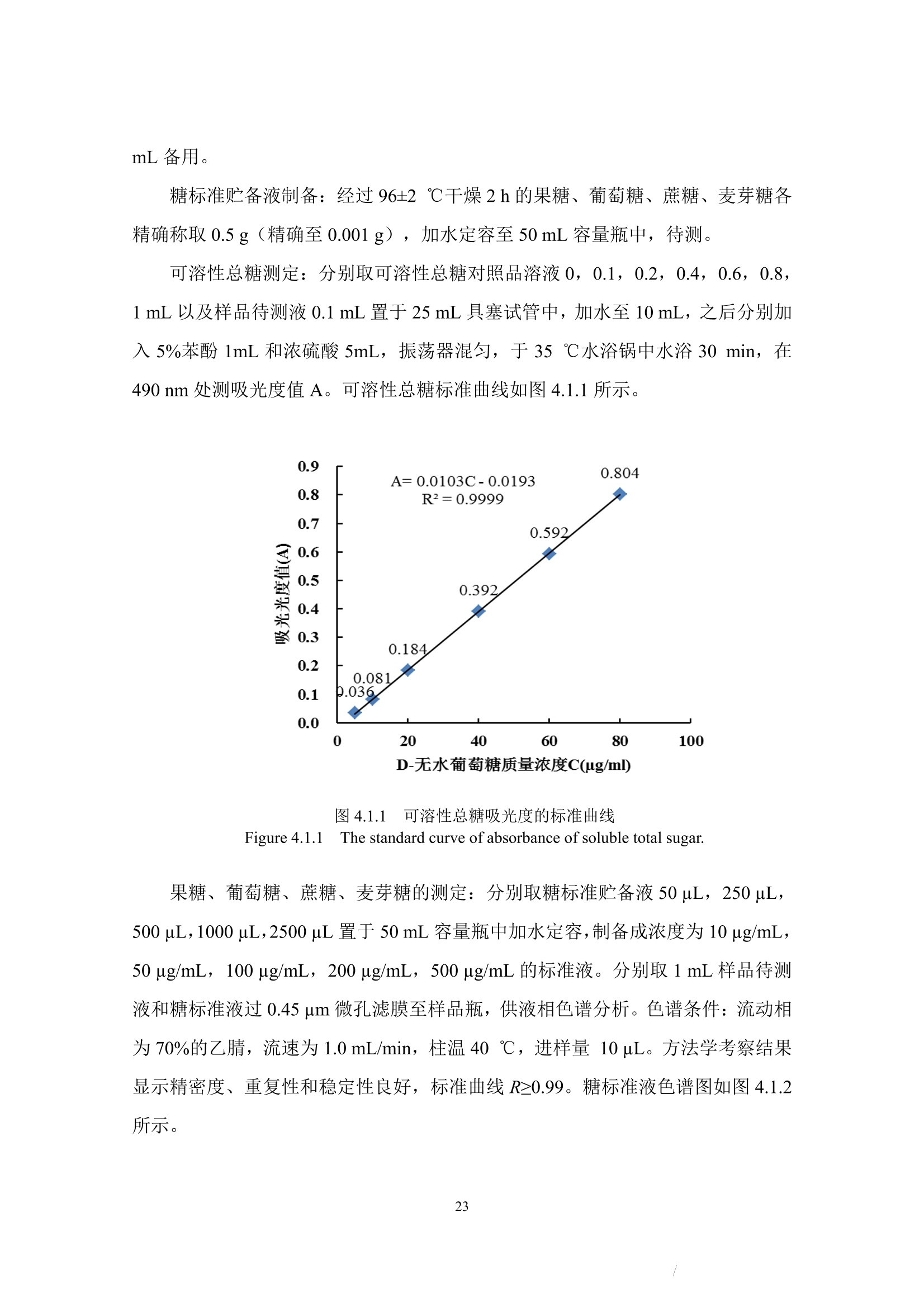
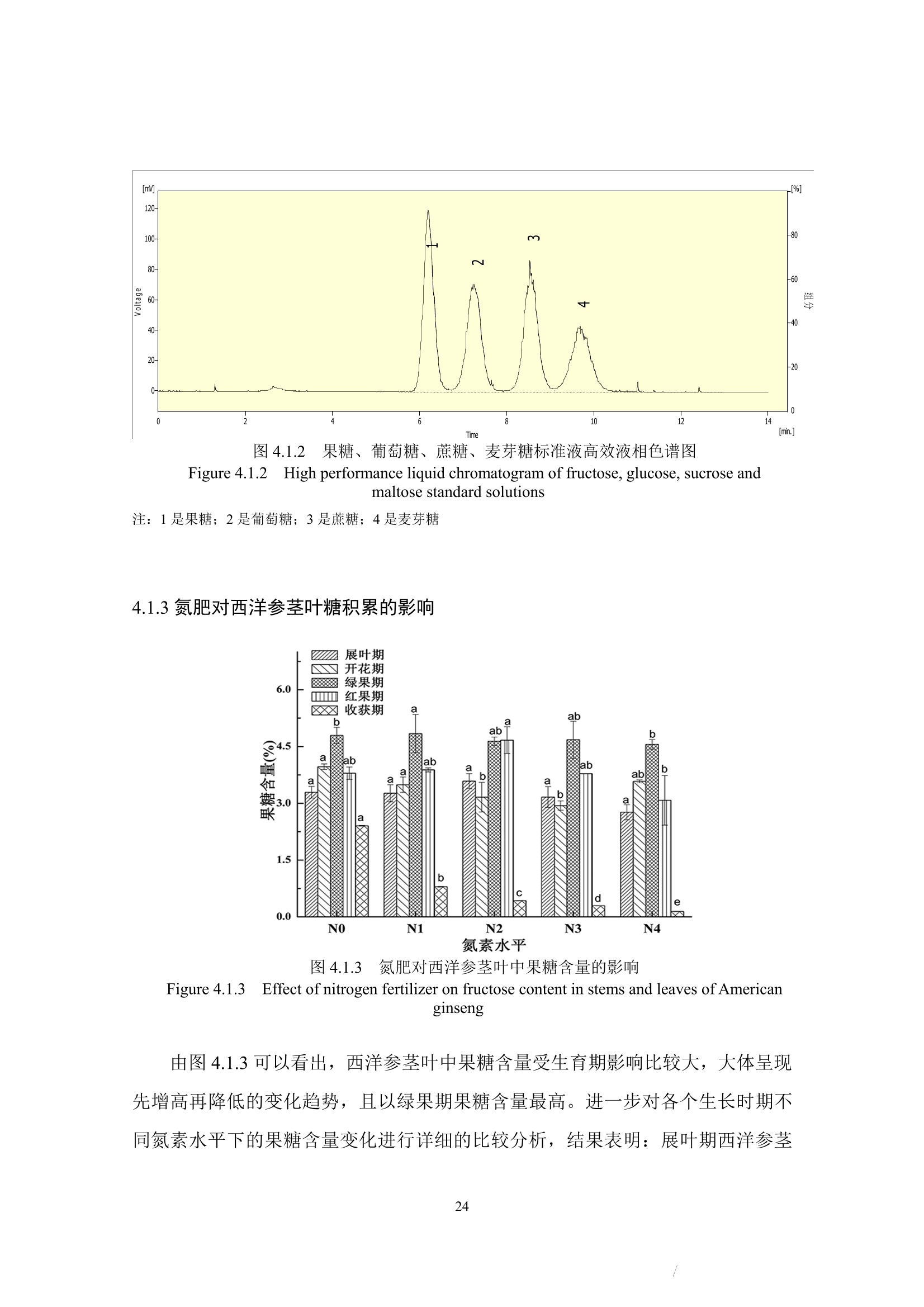
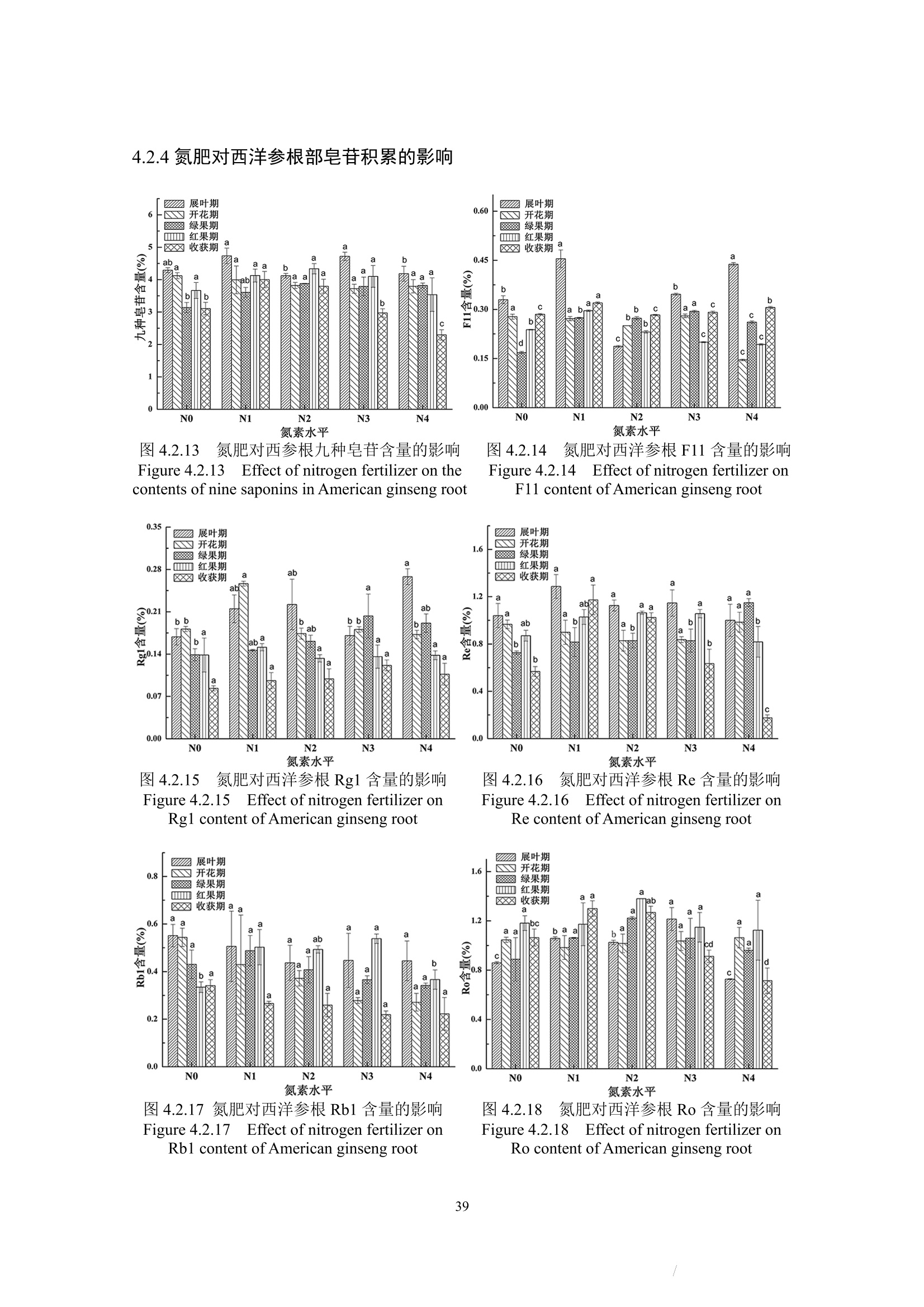
确定








































































还剩80页未读,是否继续阅读?
北京盈盛恒泰科技有限责任公司为您提供《西洋参中蛋白质含量检测方案(定氮仪)》,该方案主要用于中药材和饮片中含量测定检测,参考标准--,《西洋参中蛋白质含量检测方案(定氮仪)》用到的仪器有VELP-杜马斯定氮仪NDA701
推荐专场
相关方案
更多
该厂商其他方案
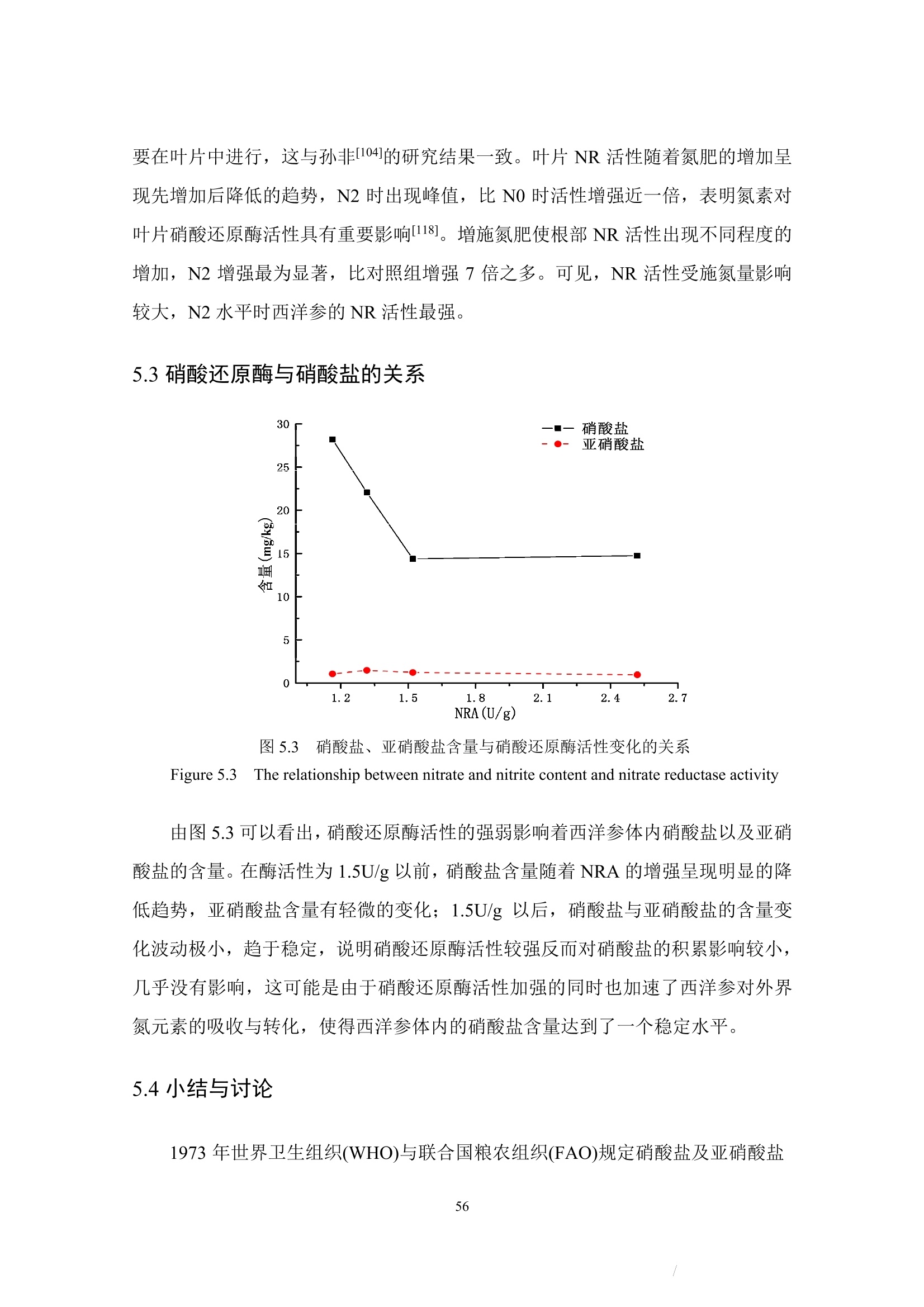
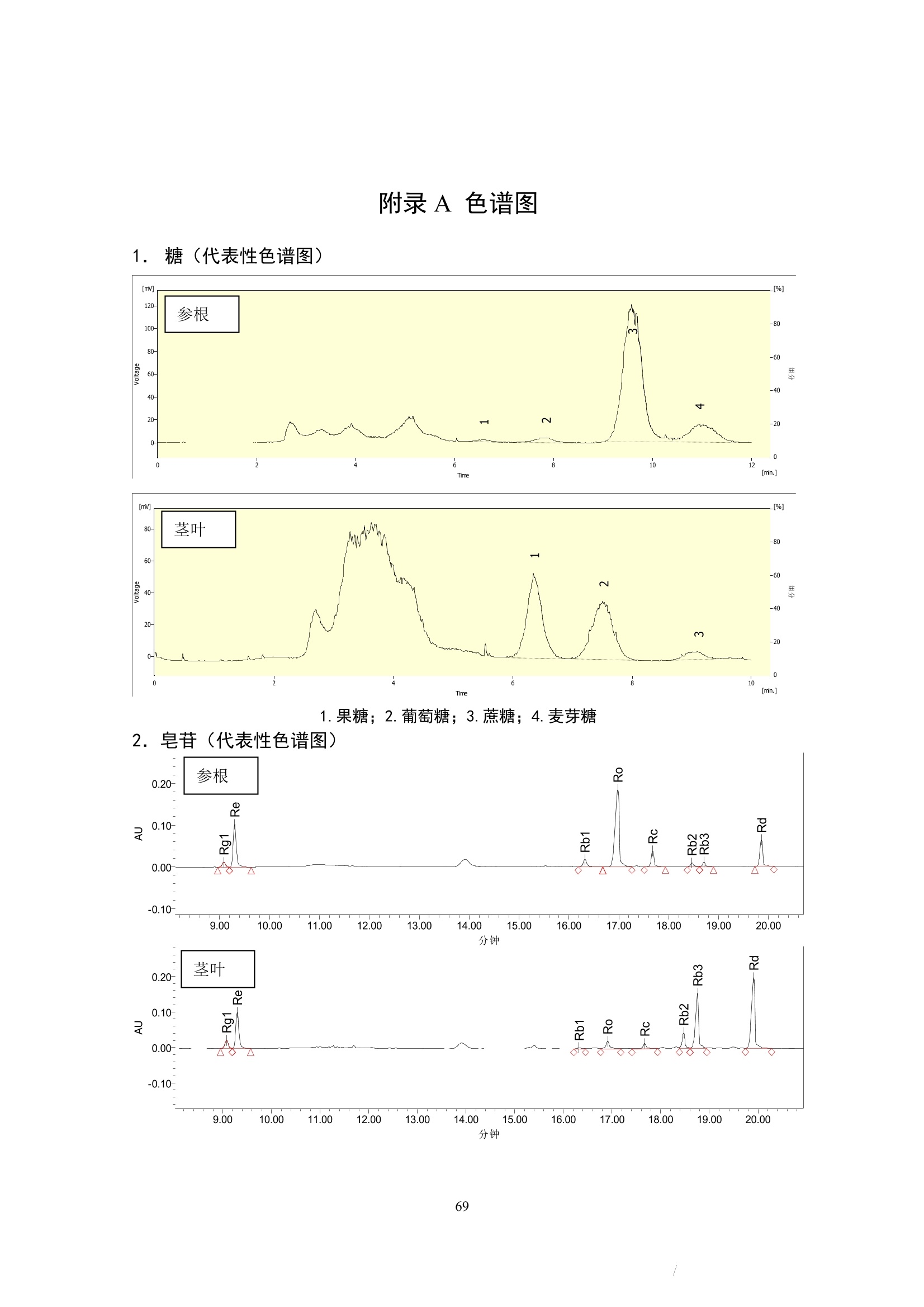
更多

















