方案详情
文
悬液芯片技术整合了荧光素编码微球、激光技术、流式技术、快速信号处理和数据分析系统。对同一样本多指标同时检测时悬液芯片技术更有优势,因为其利用不同颜色的荧光微球与其上面所标记不同的探针,同时针对多重靶标进行检测。
方案详情

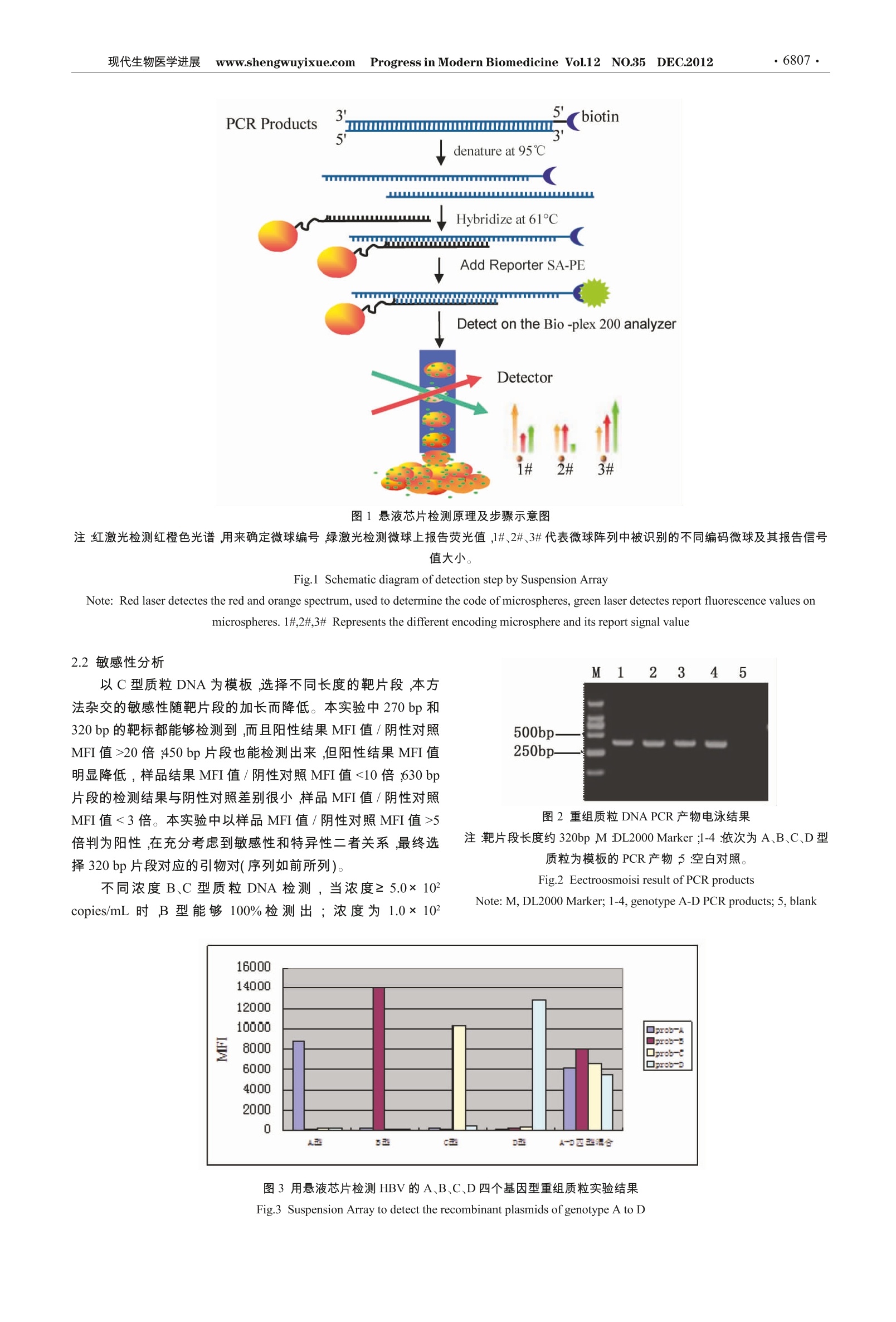
DOI:10.13241/j.cnki.pmb.2012.35.014现代生物医学进展 www.shengwuyixue.com Progress in Modern Biomedicine Vol.12 NO.35DEC.2012·6805. ·6806·现代生物医学进展 ww.shengwuyixue.com Progress in Modern Biomedicine Vol.12 NO.35DEC.2012 高通量流式荧光微球悬液芯片检测乙肝病毒基因分型* 刘永兰 包 晗 赵锦荣 向 安 郭晏海 雷小英 汪 钦 颜 真 (第四军医大学药学院药物基因组学教研室全军基因诊断技术研究所陕西西安710032) 摘要目的:建立HBV基因分型高通量液相芯片检测技术,并探讨其应用价值。方法:对GenBank 中收录的明确分型的 HBV 基因序列进行分析,选择 preS2-S区设计引物和A、B、C和D型特异性探针。与荧光编码微球偶联的特异型探针与一条引物生物素标记的 PCR 产物直接杂交反应,然后结合亲和素标记的藻红蛋白,用流式检测仪(Bio-Plex 200)检测荧光信号。 检测182份阳性乙肝患者血清 DNA, 其中35份样品检测结果与测序法比较。用B、C型质粒 DNA 倍比稀释及混合样品检测灵敏度来评估该方法。结果:建立了 HBV 基因分型的快速高通量液相芯片检测方法。182份患者血清检测结果为:B型占24.2%(44/182),C型占71.4%(130/182),D型为6.6%(12/182),BC混合型4.4%(8/182)。其中35份样本与测序法比较,除3份混合型测序法未检出外,其它32例结果均相同。本方法的灵敏度检测下线为1× 10 copies/mL。结论:应用悬液芯片技术进行乙肝病毒的基因分型分析,具有较好的特异性和较高的灵敏度,并有简便、灵活和高通量等优势。该检测系统不仅在科研中有广泛的前景,也有望成为临床推广的多重分子诊断和基因分型的新方法。 关键词:荧光微球;悬液芯片;乙肝病毒;基因分型 中图分类号:R373.2,R446.11+9 文献标识码:A 文章编号:1673-6273(2012) 35-6805-05 Development of High-throughput Detection of HBV Genotypes Using a FluidFluorescent Microsphere Suspension Array* LIU Yong-lan, BAO Han, ZHAO Jin-rong, XIANG An, GUO Yan-hai, LEI Xiao-ying, WANG Qin, YAN Zhen^ (Institute of Gene Diagnosis & Department of Pharmacogenomics, School of pharmacy, The Fourth Military Medical University, Xi'an,Shaanxi, 710032, China) ABSTRACT Objective: A rapid and high-throughput method has been developed to detect multiple HBV genotypes by aFluorescent-coded Microsphere Suspension Array, and the application value has been discussed. Methods: According to the sequencewith known genotypes of HBV in GenBank, the primers and specific genotyping probes from A to D were designed in preS2-S of HBVgenome. The type-specific oligonucleotide probes coupled to fluorescence-labeled polystyrene beads, subsequently hybridized directly tobiotinylated PCR products, then conjugated streptavidin-phycoerythrin, and analyzed by the flow cytometer detector (Bio-plex 200). Wedetected 182 serum samples from HBV DNA-positive patients, and 35 cases were compared with sequencing analysis. The sensitivity ofthe method was evaluated by using serial diluted Plasmids of genotype B and C, And the sensitivity for the detection of co-infections wasexamined by mixture of plasmids. Results: The suspension array system for rapid and high-throughput detection HBV genotypes wasestablished. A total of 182 serum samples of patients were tested by the assay. Genotype B was detected in 24.2 %(44/182), genotype Cin 71.4%(130/182), genotype D in 6.6%(12/182) and genotype B/C mixture in 4.4 %(8/182). Hepatitis virus genotyping in 35 cases bySuspension Array were compared with the sequences, there were 32 serum samples except 3 B/C mixed samples were concordant.Further studies showed suspension Array could detect 10% of genotype B and genotype C among mixed genotype samples at HBV DNA≥ 3x 10' copies/mL. The sensitivity of the detecting limit for the HBV was 1000 copies/ml. Conclusion: Suspension array technology forHBV genotyping analysis has good specificity and high sensitivity, and simple, flexible and high throughput advantage. The detectionsystem is expected to be clinically popularized as a new method for multiple molecular diagnostics and identification of genotyping. Key words: Fluorescent microsphere; Suspension Array;HBV; Genotyping Chinese Library Classification(CLC):R373.2, R446.11+99Document code: A Article ID:1673-6273(2012)35-6805-05 前言 乙肝病毒(HBV)是在世界范围内广泛流行的一种嗜肝性 DNA 病毒,可引起急慢性乙型肝炎,可导致肝硬化、肝功能衰竭和肝癌。其感染人数众多而危害广泛,是严重影响人类健康的因素之一。乙肝病毒基因组全长约3.2kb,通过反转录进行 ( *基金项目:国家“十一五”重大传染病 专 项 (2009ZX10004-311);国家重点基础研究发展规划(973)项目(2010CB933900) ; ) ( 西安市科技计划 (SF09027) ) ( 作者简介:刘永兰(1970-),女,实验师,研究方向:分子诊断技术和药物基因组学 E-mail:yonglanliu@163 . com ) ( ▲通讯作者:颜真,E-mail: yanzhen@fmmu.edu.cn ) 病毒复制,由于 HBV DNA 聚合酶缺乏自我校正功能,容易发生突变;而且在感染过程中,由于宿主免疫反应或药物治疗的抗病毒压力导致病毒基因组的进化。这些变异不断积累造成了HBV核苷酸序列多态性。按照 HBV 基因组序列异质性>8%或S基因差异>4%的分型原则,已公认的有 A~H8 个基因型2.近年又发现新的基因型被建议确认为Ⅰ型3.4和J型。研究表明 HBV 基因型分布呈明显的地域性和人种特征;而且不同基因型具有不同的致病性和不同的病毒学特性。HBV基因分型有助于病情评估、治疗药物选择和预后判定,且为病毒变异、发病机制的探讨和分子流行病学研究提供参考依据9。本研究拟以检测我国分布的A、B、C、D四种 HBV基因型为目的,建立高通量、快速、灵敏鉴别 HBV基因型的悬液芯片 (SuspensionFluorescent-bead microarray) 检测方法。 1材料与方法 1.1主要试剂和仪器 BIO-Rad bio-plex 200 型悬液芯片系测系统(仪器同Lu-minex-200,分析软件为 Bio-plex manager 6.0,BIO-Rad 悬液芯片洗板机,ABI Veriti PCR 仪;荧光微球 (Biorad Bio-Plex COOHbeads) ;pMD-18T载体(Takara,大连),病毒 DNA提取试剂盒(天根生化)。 1.2临床样本及DNA提取 182例乙肝患者血清收集于第四军医大学附属唐都医院和西安交大第二附附医院,临床 HBV-DNA检测均为阳性结果,即大于1x 10' copies/mL。血清保存于-20℃。200pL血清样按照试剂盒操作流程提取 DNA,DNA分装5 uL/管保存-70℃备用。 1.3引物和探针 根据 GenBank 中已发表的43株明确分型的 HBV全基因组序列进行比对分析,获得了8个基因型的 preS2-S区一致序列。利用 Primer 5 分析设计 PCR 引物和HBV 基因型特异性探针。上游引物生物素标记,所有探有5'端NH2-C12修饰,均由上海生工合成。引物序列:上游引物:5'-Biotin-CTGCTGGTG-GCTCCAGTT-3',下游引物:5'-ATAAAACGCCGCAGACA-CAT;PCR 扩增靶片段约320bp, 引物用超纯水溶解成10 uM备用。分型探针为:Prob-A:5'-NH,C12-AGTCCTCGCGGAGATTGAC;Prob-B:5'-NH,Cp2-AGTGACTGGAGATTTGGGAC;Prob-C:5'-NH-Cj2-CAGGAACGTGGGTGCTC;Prob-D:5'-NH,Cj2-CATGTTCAGCGCAGGGTC。各探针用超纯水溶解配置成100uM备用。 1.4重组质粒标准品及其构建 随机选择血清样本35份提取DNA,用一对引物扩增PreS2-S区约630bp片段。上游引物5'-CTGCTGGTG-GCTCCAGTT-3',下游引物5'-GCACTAGTAAACTGAGC-CA-3'}'。PCR扩增条件为95℃预变性5 min;然后95℃变性30s,56℃退火30s,72℃延伸30s,进行35个循环;最后72℃延伸5 min。 PCR 产物经测序分析筛选到B、C和D型,其他型未见到。A型模板为参照 GenBank 上A型参考标准株 X51970人工合成序列。A、B、C、D各型DNA模板,经PCR扩增,产物纯化,将纯化好的产物用T-A 克隆系统进行质粒的构建,质粒经 PCR 和测序鉴定。提纯的质粒 DNA紫外分光光度法测定OD260,计算出 DNA 拷贝数。用来优化和评价方法,并作为阳性 1.5悬液芯片检测系统的建立 1.5.2 PCR 扩增样品 DNA 在梯度 PCR 仪上进行试验得到优化的PCR反应条件:25 pL PCR 反应体系中,2×PCR supermix(上海欣百诺)12.5 uL,上下游引物终浓度为0.5 uM,样本DNA 3 pL 做模板。反应条件为:95℃预变性3min;然后95℃变性20s,62℃退火30s,72℃延伸30s,进行40个循环;最后72℃延伸5 min。 1.5.3杂交反应及检测 向 0.2 mL PCR 管中依次加入33 pL1× TMAC 杂交缓冲液,耦联特异型探针的四种微球各1pL,PCR产物10pL,补TE至50pL,充分振荡混匀,95℃变性2min,61℃ 杂交30 min。转移至96孔滤板(美国 Millipore) ,使用1×TMAC 在洗板机上洗涤两次,然后加入1:500 稀释的SA-PE 70 pL /孔,室温避光放置 10 min,振荡悬浮微球,将96孔滤板放进 Bio-plex 200 分析仪,设置软件中各项参数,进行检测读数。检测仪有两束激光检测器,可同时分别识别微球编号和微球上分子反应的报告信号,经过一次读板即可按微球编号生成各反应数据供分析(见图1所示检测原理及步骤)。 1.6灵敏度分析 1.6.1不同长度靶片段敏感性分析 选择均包含所设计的A-D四个基因型特异性探针的不同引物对,均以1x 10 copies / mL的C型质粒为模板分别扩增270 bp、320 bp、450 bp、630 bp的靶片段,选择检测敏感度较高的靶片段对应的引物对。 1.6.2检测样本的灵敏度评估 取 B、C质粒调至1.0×10copies /mL,分别稀释成1.0× 10copies /mL、1.0x 10'copies /mL、5.0×10copies/mL、1.0× 10’ copies /mL,经 PCR 产物杂交反应及检测,每个浓度重复三次,根据MFI信号值来评估本方法的检测灵敏度下限。 1.6.3混合型感染分辨率 浓度为 3.0×10 copies/mL 的A、B、C、D质粒分别按 49:25:25:1、25:49:1:25、25:1:49:25、1:25:25:49混合,混合DNA 样品经 PCR 和杂交反应,检测样品的MFI 值/阴性对照 MFI 值,用来分析本方法检测混合样本的敏感度。 2结果 2.1重组质粒鉴定和质粒 DNA 样品悬液芯片验证特异性 重组质粒测序结果进行序列分析表明分型正确,对探针结合区域短片段进行对比显示序列完全正确,成功获得各型重组质粒。各型质粒 DNA 分别进行 PCR 扩增,得到约320bp 扩增条带(见图2)。经过优化的悬液芯片方法分别检测四种质粒和四种质粒等量混合样品,结果表明本系统所选择的探针特异性强,无交叉杂交反应现象(见图2)。 图1悬液芯片检测原理及步骤示意图 注:红激光检测红橙色光谱,用来确定微球编号,绿激光检测微球上报告荧光值,1#、2#、3#代表微球阵列中被识别的不同编码微球及其报告信号值大小。 Fig.1 Schematic diagram of detection step by Suspension Array Note: Red laser detectes the red and orange spectrum, used to determine the code of microspheres, green laser detectes report fluorescence values onmicrospheres. 1#,2#,3# Represents the different encoding microsphere and its report signal value 以C 型质粒 DNA 为模板,选择不同长度的靶片段,本方法杂交的敏感性随靶片段的加长而降低。本实验中270 bp 和320 bp 的靶标都能够检测到,而且阳性结果 MFI 值/阴性对照MFI值>20倍;450 bp 片段也能检测出来,但阳性结果 MFI 值明显降低,样品结果MFI值/阴性对照MFI 值<10倍;630 bp片段的检测结果与阴性对照差差很小,样品MFI值/阴性对照MFI 值<3倍。本实验中以样品MFI值/阴性对照 MFI 值>5倍判为阳性,在充分考虑到敏感性和特异性二者关系,最终选择320 bp片段对应的引物对(序列如前所列)。 不同浓度 B、C 型质粒 DNA 检测,当浓度≥5.0×10copies/mL 时 ,B 型能够100%检测出;浓度为1.0×10 图2重组质粒 DNA PCR 产物电泳结果 注:靶片段长度约320bp,M:DL2000 Marker;1-4:依次为 A、B、C、D型质粒为模板的 PCR 产物;5:空白对照。 Fig.2 Eectroosmoisi result of PCR products Note: M, DL2000 Marker; 1-4, genotype A-D PCR products; 5, blank 图3用悬液芯片检测 HBV 的A、B、C、D四个基因型重组质粒实验结果 Fig.3 Suspension Array to detect the recombinant plasmids of genotype A toD copies/mL 的B型质粒样品检测三次,均未检测到。C型质粒样品当浓度≥1.0× 10 copies/mL时,能够100%检测出;浓度为5.0× 10 copies/mL 的C型质粒样品检测三次,有一次未检测到;浓度为1.0×10 copies/mL 的检测三次,均未检测到。表明建立的本系统检测 HBV 的可靠检检下限为1.0×10copies/mL。 A、B、C、D质粒 DAN 混合样品检测,结果所建立的方法可以检测到1%的混合基因型,即混合型检测下限为3.0×10 copies/mL。 2.3检测临床样本 HBV 基因分型 182份乙肝患者血清 DNA 检测结果为:B型占24.2%(44/182),C型占71.4%(130/182) ,D型为6.6%(12/182) ,B/C混合型占4.4%(8/182),未见A型。(见表1)。35份样本用悬液芯片法和测序分析法双盲检测结果比较,除3份B、C混合型测序结果为单一型 B或C,其他32份结果均相同,其一致性达91.4%。(见表2)。 图4不同长度 PCR 产物杂交敏感性实验 Fig.4 Test of hybridization sensitivity of different length of amplified products 3讨论 目前 HBV基因分型的方法有多种010-13):全基因组或S区基因序列测序,聚合酶链反应-限制性片段长度多态性(PCR-RFLP),线性探针法,特异引物 PCR 法,固相基因芯片法等。测序法为金标准法,但是由于测序仪器昂贵,大多委托专门的公司进行,测序结果还需序列比对分析,比较费时,而且该方 表1182份乙肝患者血清基因分型检测结果 Table 1 The results of detection HBV genotypies of 182 serum samples HBV genotyping No. of samples positive/ total % samples B 44/182 24.2 C 130/182 71.4 D 12/182 6.6 B+C 8/182 4.4 表2比较35例样本悬液芯片和直接测序检测结果 Table 2 Comparison of HBV genotype as determined by Suspension Arrayand sequencing (n=35) Infection type Genotype Suspension Array Sequence analysis B 7 8 Mono C 22 24 D 3 3 Mixed B+C 3 Total 35 35 法对混合型感染不能完全检测出来。PCR-RFLP 由于限制性酶只对特定序列识别,而乙肝病毒具有高突变率,如果突变发生在酶切位置,就可能导致酶切片段大小的改变,引起误判,而且该方法操作较繁琐,只适合实验室研究,不适合临床应用。特异引物 PCR 法需要借助对多重 PCR 产物进行电泳确认,或通过荧光定量 PCR 的融解曲线分析来判断分型。由于多重 PCR条件优化苛刻,容易引起非特异扩增而影响结果判断。Inno-Lipa线性探针法是比利时的商品化的试剂盒,但其价格昂贵,不可能在中国普及化。反向斑点法依靠肉眼观察杂交反应后显色状况来判断,带有主观性,特别是对一些杂交信号较弱的难以判读。固相芯片法在检测过程中可能存在较高的背景值,导致信噪比较低难于判断;而且依赖于昂贵的荧光阅读仪寻址识别,还不能普及。 悬液芯片技术整合了荧光素编码微球、激光技术、流式技术、快速信号处理和数据分析系统,是一种既能保证信息质量,又能提供相对高通量的新一代分子检测技术平台。它已被广泛的应用于基因组学和蛋白组学的诸多领域研究D5,16,19.20,核酸检测方面在多重单核苷酸多态性和病原微生物多重检测方面应用更成熟14,17.18],在国外已有商品化的试剂盒可应用于临床分子诊断。表明该技术能够满足临床分子诊断的灵敏度要求。本实验也证实其检测乙肝病毒基因分型的灵敏度下限度1.0×10°copies/mL,与实时荧光定量 PCR 相当。虽然其检测过程比定量PCR费时(约多1-2小时),但对同一样本多指标同时检测时悬液芯片技术更有优势,因为其利用不同颜色的荧光微球与其上面所标记不同的探针,同时针对多重靶标进行检测,在同一试管中,一次就可进行多达100种探针的检测与分型,具有容易 判读、记录及储存检测结果之优点。而且该技术还具有很好的灵活性,可以根据不同患者的不同检测项目,灵活组合不同的特异性探针标记的荧光微球。与测序法相比较,悬液芯片法能够检测到测序无法分析的混合感染。 总之,本研究中所建立的 HBV基因分型的悬液芯片检测方法具有高敏感性及特异性,只需一次 PCR,就能够同时并行检测多个基因型。既适合大样本的研究,也适合临床治疗中个体多指标差异识别,其检测结果可为个体化医疗提供参考。 ( 参考文献(References) ) ( [1] Kramvis A, K e w M, F rancois G. H epa t itis B v i ru s genotypes [ J].Vaccine, 2005, 23 : 2409-2423 ) ( [2] N o rder H , Cou r ouce AM , Coursaget P, e t al. Genetic div e rsity ofhepatitis B virus strain s derive d worldwide: genotypes, subgenotypes,and HBsAg subtypes [J]. Intervirology, 200 4 ,47:289-309 ) ( [3 Y ] u H, Y u a n Q, Ge S X, et al, Molecular and phy l ogenetic ana l ysessuggest a n additional h epatitis B v irus genotype “T”[J ] . PLoS One, 2010,5(2):9297 ) ( [4] Arankalle VA, Gandhe SS, Borkakoty BJ, et a l. A n ovel H BVrecombinant ( g enotype I) s i milar to V ietnam/Laos in a primitive t r ibein eastern India[J]. JViral Hepa t , 2010 ,1 7 : 501 - 510 ) ( [5 ] Tatematsu K, T a naka Y, Ku r banov F, e t al . A ge n etic va r iant o fh epatitis B virus divergent from known h uman and ap e ge n otypesisolated from a J apanese p a tient a n d provisionally assigned to ne w genotype J[J]. J Virol,2009,8 3 :10538-10547 ) ( [6 ] Zeng G, Wang Z, Wen S, et al. Geographic d i stribution, virologic andclinical characteristic s o f hepatitis B virus genotypes i n C hina [].JViral Hepat,2005, 12(6): 609-617 ) ( [7 ] L iu C J, K ao J H , C h e n DS . Therapeutic implieation of he p atitis Bvirus genotype[J]. Liver Int , 2005, 25(6) : 1097-1107 ) ( [8] L in C L, Kao JH. Th e cl i nical i m plications o f hepatitis B v irusgenotype: R ecent a dvances [J]. Journal of G a stroenterology and Hepatology,2011,26(1):123-130 ) ( [9] I P alumbo E. He p atitis B genotypes and res p onse to antiviral therapy:arev i ew[J]. Am J Ther, 2007, 14: 3 06-309 ) ( [10] B artholomeusz A, Schaefer S. He p atitis B v i r us ge n otypes: co m pari- ) (上接第6813页) [19]洪庆涛,宋岳涛,唐一鹏,等.细胞培养液乳酸脱氢酶漏出率的比 ( 色测定及其应用[J].细胞生物学杂志,2004,26(1):67-68 Hong Q i ng-tao, S o ng Yu e -tao, Ta n g Yi-peng, et al. De t ermination a nd A pplication o f Leakage R a te o f L a ctate D e hydrogenase in th e Cultured Medium of C e lls[J]. C h inese J ournal of Coll Biology, 2004,26(1):67-68 ) ( [20] L I Hai-feng, L I Ying , FAN Hong-bin, et al. Changes of MDA, LD a nd L DH in B r ain a n d Lung with Ex p erimental An o xia in M ic e []. ) ( son of genotyping methods[J] . Re v Med Vim, 2004 , 14:3-16 ) ( [ 1 1 ] L iu WC, M . Mizokami, M. But i , et al. S i multaneous q u antificationand g enotyping of h e patitis B v irus for genotypes A t o G by real-timePCR and tw o -step melting cur v e analysis[J]. J. C lin. Microbiol, 200 6 ,44:4491-4497 ) ( [ 1 2] T a n g X R , Zhang JS, Zh a o H, e t a l. Detection of hep a titis B virusgenotypes using oligonucl e otide chip among h e patitis B virus carriersin Eastern China[J]. World J . Gastroentero, 2007, 1 3 : 1975-1979 ) ( [1 3 ] L i D ing, C h e n R u i, J i a Zhan-sheng, et a l . Detection o f h epatitis Bvirus genotypes A t o D by the fluo r escence po l arization assay basedon a symmetric P C R[J]. J Virol M ethods, 2010, 1 6 8:31 - 7 ) ( [ 1 4] Bortolin S. M ultiplex genotyping f o r thrombophilia-as-sociated S N P s b y universal bead arrays[J] . Methods Mol B iol, 2009, 496: 59-72 ) ( [ 1 5] D unbar, S.A. A pplications o f Luminex x MA P technology for ra p id,high-throughput m u ltiplexed nu c leic ac i d de t ection [] . C l i n. Chim .A cta, 2006,363(1-2):71-82 ) ( [ 1 6] A C l avijo, K Hole, M L i, et al . S i multaneous det e ction of a nt i bodiesto foot-and-mouth d isease non-structural protein s 3ABC, 3D, 3 A a n d 3 B by a multiplexed Luminex assay to differentiate infected from vac-cinated cattle[J]. Vaccine,2006,24( 1 0): 1 693-1704 ) ( [17] B v i ng M K , Pe d ersen LN, M oller JK. Eight-plex PC R and liq u id-ar-ray d etection of b a cterial and viral p a thogens in c er e brospinal fluidfrom patients w ith s uspected meningitis [ ]. J C li n Microbiol, 2009,47:908-913 ) ( [ 1 8] Lee W M , Grindle K, P appas T, e t al. High-through-put,sensitive,andaccurate multiple x PCR-microsphere flow cytometry system forlarge-scale comprehensive d e tection of respiratory viruses [ ]. J C lin Microbiol, 2007,45(8):2626-2634 ) ( [ 1 9] G e gia M, Mdivani N,Mendes R E, e t al. Pr e valence of and molecularbasis f or t uberculosis drug resistance in the re p ublic of Georgia:Vali-dation o f a Q IAplex sy s tem for detection of drug res i stance-relatedmutations[ J ]. Anti microb Agents C hemother, 2008,52(2): 7 25-729 ) ( [20] L ee HJ, Kim Y T , P ar k PJ, et a l . A novel detection method o fnon-small cell lung cancer using multiplexe d bead-base d serumbiomarker profiling[J]. J Thorac C ardiovasc Surg, 2012,143: 4 21-427 ) ( J ournal o f Hebei N o r t h Un i v ersity (Medic a l Edi t i o n), 201 0 ,27 (1):23-26 ) ( [21]孙琪,敖海 清 ,富文俊, 等 .逍遥散抗慢性应激损伤中枢Glu-NR-Ca²-GR 信号 通 路机 制探 讨[].中药新药与临床药理, 2011,22(67):627-632 Sun Q i, A o H ai -qing, Fu W e n-jun, e t al . S t udy on Ce n t r alGlu- N R-Ca- G R Signaling Pathway Mechanism o f X i aoyao Powder o n C ounteracting C hronic S tress []. Traditional Chinese Drug Re- s earch and Clinical Pharmacology,2011,2 2 (67):627-632 )
确定




还剩3页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《高通量流式荧光微球悬液芯片检测乙肝病毒基因分型》,该方案主要用于其他中--检测,参考标准--,《高通量流式荧光微球悬液芯片检测乙肝病毒基因分型》用到的仪器有流式细胞仪校正用荧光微球、高通量检测用微球、高通量检测用微球
相关方案
更多
该厂商其他方案
更多












