方案详情
文
方格星虫酶解工艺优化及酶解物免疫活性
沙虫
方案详情

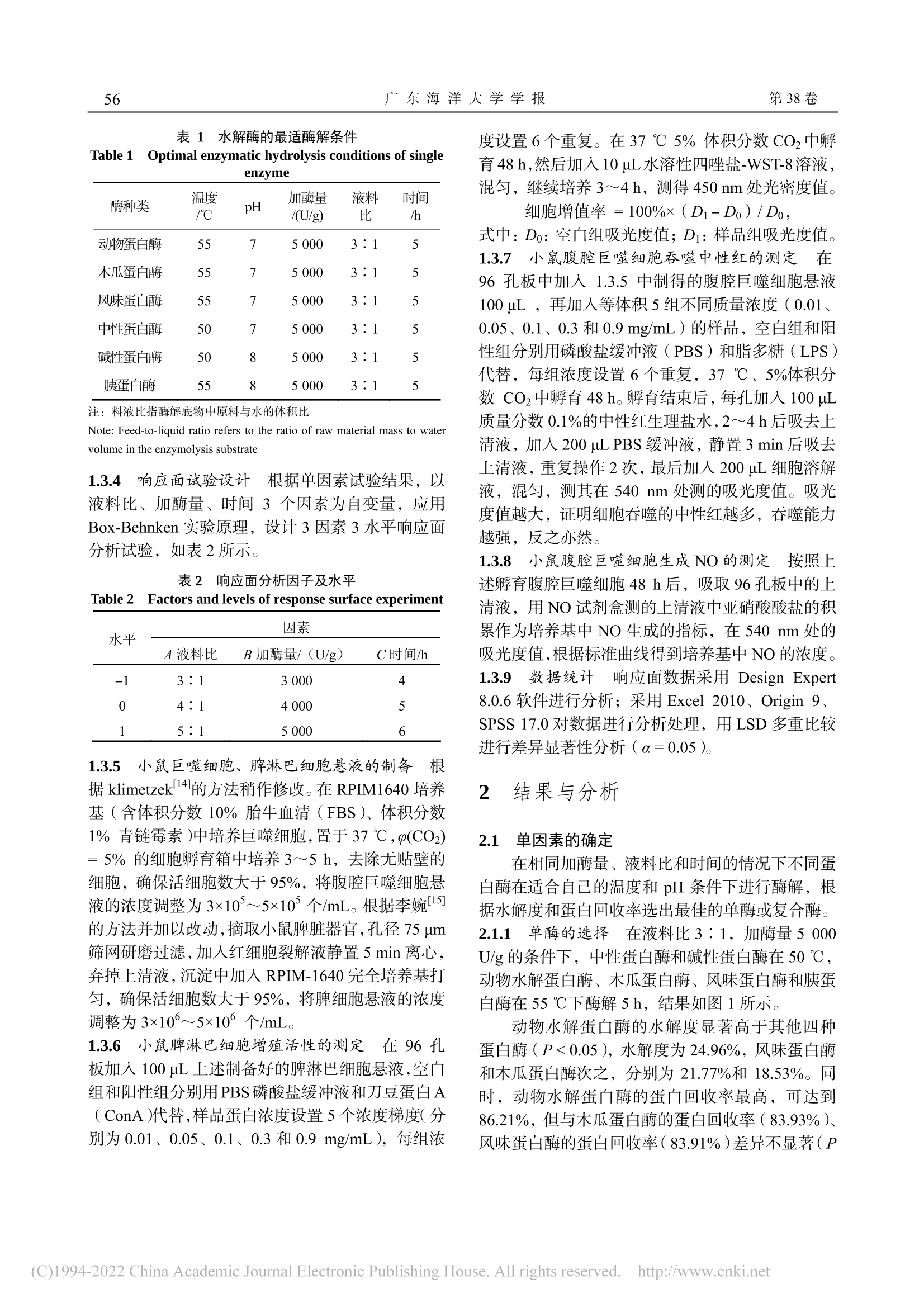
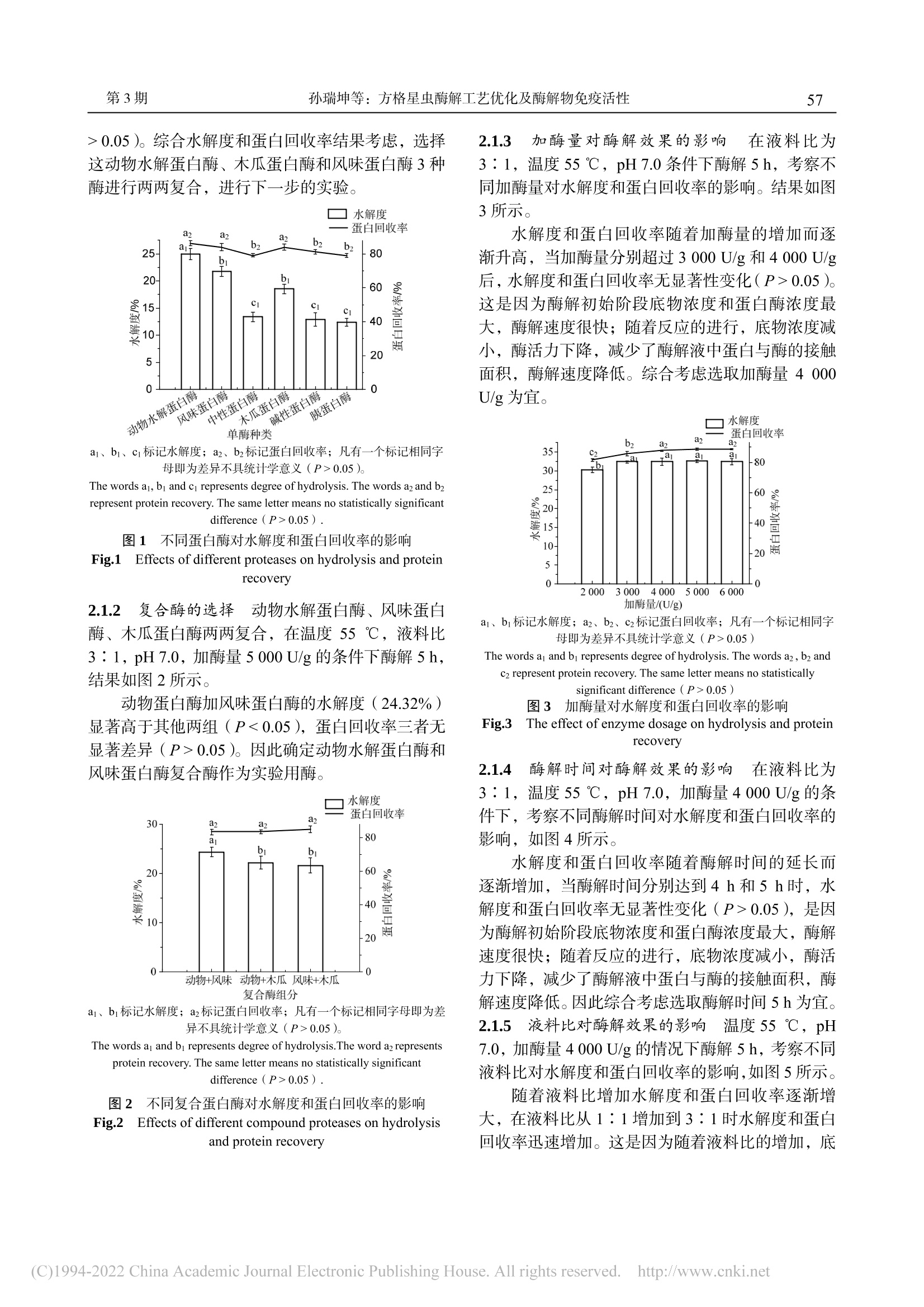
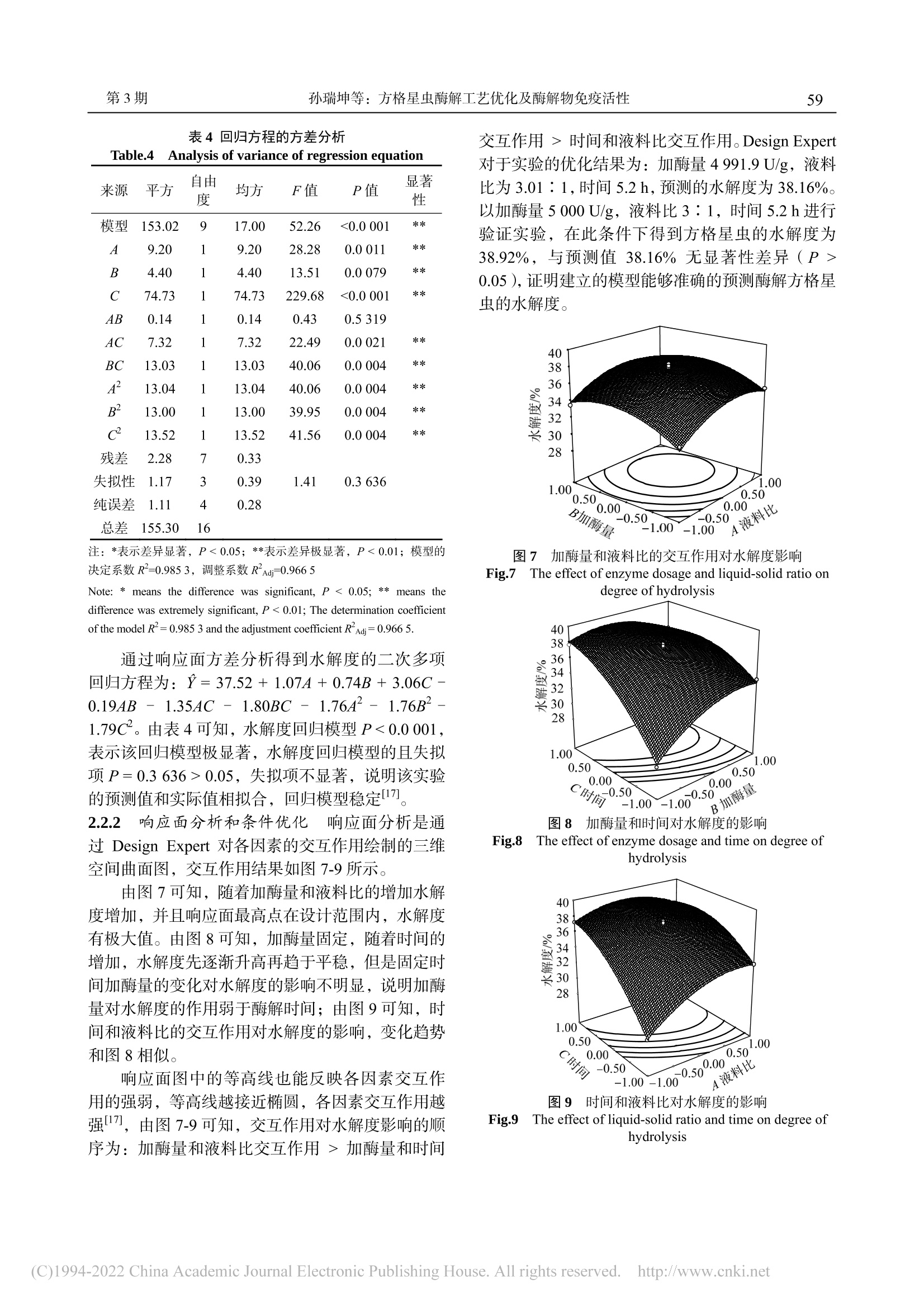
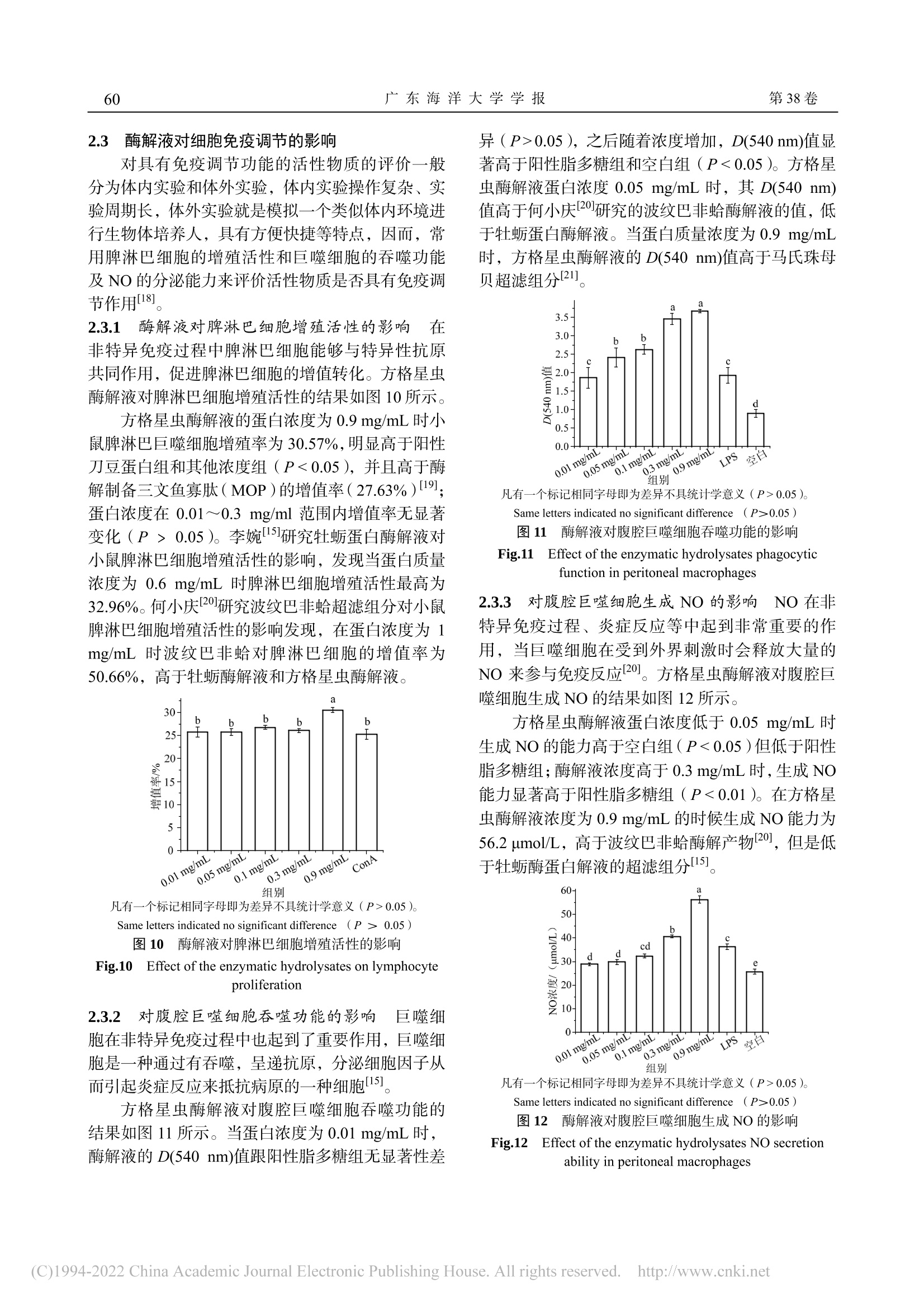
方格星虫酶解工艺优化及酶解物免疫活性沙虫广东海洋大学学报Journal of Guangdong Ocean University第 38卷 第 3期2018年 6月Vol.38 No.3Jun. 2018 孙瑞坤等:方格星虫酶解工艺优化及酶解物免疫活性第3期55 孙瑞坤 ,章超桦 ,曾少葵 ,等 .方格星虫酶解工艺优化及酶解物免疫活性 [J].广东海洋大学学报 , 2018, 38(3): 54-61. 方格星虫酶解工艺优化及酶解物免疫活性 孙瑞坤 1,章超桦 1,2,3,4,曾少葵 1,2,3,4,秦小明 1,2,3,4,曹文红 1,2,3,4,高加龙 1,2,3,4,郑惠娜 1,2,3,4 (1.广东海洋大学食品科技学院 // 2.广东省水产品加工与安全重点实验室 // 3.广东普通高等学校水产品深加工重点实验室 //4.国家贝类加工技术研发分中心(湛江),广东湛江 524088) 摘 要:【目的】优化方格星虫(Sipunculus nudus L.)酶解工艺条件,探讨其酶解液对细胞免疫活性的影响。【方 法】在确定实验用酶和单因素实验基础上,利用响应面设计建立数学模型,以水解度为响应值,进行 3因素 3水 平的响应面分析,得到适最适酶解条件。以小鼠脾淋巴细胞的增殖、小鼠腹腔巨噬细胞生成 NO 量和吞噬能力来评 价酶解液对免疫细胞的促进作用。【结果】以动物水解蛋白酶和风味蛋白酶组合用酶效果佳最佳,方格星虫酶解的适 宜条件为 pH 7.0、加酶量 5 000 U/g 、液料比 3∶1,55 ℃酶解 5.2 h ,其水解度为 38.92%;以此条件得到的酶解液 进行实验,酶解液质量浓度为 0.9 mol/mL 时,小鼠脾淋巴细胞的增殖率为 30.57%,小鼠腹腔巨噬细胞生成 NO 能 力为 56.2 μmol/L,吞噬能力 D (540 nm)值均明显高于阳性对照组(P <0.01)。【结论】方格星虫酶解液对细胞免疫 具有促进作用。 关键词:方格星虫;酶解;响应面分析;免疫调节 中图分类号 :TS254.1 文献标志码 :A 文章编号 :1673-9159(2018)03-0054-08 doi :10.3969/j.issn.1673-9159.2018.03.009 Optimization of Enzymatic Hydrolysis of Sipunculus nudus L. and Immunoassay of Its Enzymatic Hydrolysis SUN Rui-kun1, ZHANG Chao-hua1,2,3,4, ZENG Shao-kui1,2,3,4, QIN Xiao-ming1,2,3,4, CAO Wen-hong1,2,3,4, GAO Jia-long1,2,3,4,ZHENG Hui-na1,2,3,4 (1. College of Food Science and Technology, Guangdong Ocean University // 2. Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety // 3. Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution // 4. National Research and Development Branch Center for Shellfish Processing. Zhanjiang 520488, China ) Abstract :【Objective 】To Optimize the enzymolysis process conditions of Sipunculus nudus L . and explore the effect of enzymatic hydrolysates on cellular immune activity.【Method 】Based on the determination of experimental enzymes and single factor experiments, the response surface design was used to establish a mathematical model. With the degree of hydrolysis as the response value, response 收稿日期 :2018-04-19 基金项目 :广东省教育厅创新强校工程项目(2014GKXM047);广东普通高等学校水产品高值化加工与利用创新团队项目 (GDOU2016030503);2016年广东省应用型科技研发专项资金项目(2016B020235002) 第一作者 :孙瑞坤(1992—),硕士研究生,研究方向为食品科学。E-mail :1215657320@qq.com 通信作者 :章超桦(1956—),教授,博士,研究方向为海洋生物资源综合利用。E-mail :zhangch2@139.com surface analyses of 3 factors and 3 levels were performed to obtain the optimal conditions for enzymatic hydrolysis. The proliferation of mouse spleen lymphocytes, NO production in peritoneal macrophages of mice and phagocytosis capacity were used to evaluate the effect of the enzymatic hydrolysate on immune cells.【Result 】Animal proteases and flavour proteases were used as experimental enzymes. The optimum conditions for the enzymatic hydrolysis of S. nudus L. were pH 7.0, enzyme addition amount 5000 U/g, ratio of liquid to solid 3∶1, and hydrolysis at 55 ℃ for 5.2 h. The degree of hydrolysis was 38.92%. The enzymatic hydrolysate obtained under these conditions was tested at a concentration of 0.9mol/mL, the proliferation rate of mouse spleen lymphocytes was 30.57%, and the ability of mouse peritoneal macrophages to generate NO was 56.2 μmol/L. The OD540nm value was significantly higher than those in the positive control group (P < 0.01).【Conclusion 】The enzymatic hydrolysate of S. nudus L. has a promoting effect on cellular immunity. Key words : Sipunculus nudus L.;enzymatic hydrolysis ;response surface analysis ;immuno-regulation 方格星虫(Sipunculus nudus L .)又叫光裸星虫,俗称 “沙虫 ”,主要分布在大西洋、印度洋、太平洋 沿岸以及我国的广东、广西、海南和台湾沿海地区,一般生活在沿海滩涂的沙质区 [1-2]。因其肉质脆嫩、营养丰富,人工养殖规模逐年增加。目前,方格星 虫除了少数鲜销外,主要以加工成干制品销售,很 少有精深加工的高附加值产品,是一种尚未充分开 发利用的海洋水产品。方格星虫具有抗氧化、调节 免疫、抗菌、抗辐射、抗病毒、抗疲劳、延缓衰老 等功效 [3-8],其多糖和粗提物中对免疫细胞具有促进 作用 [4,9]。方格星虫蛋白质酶解液的研究主要集中在 抗氧化活性方面 [10-11],其免疫活性方面的研究鲜有 报道。本研究以方格星虫为原料,以水解度和蛋白 回收率为指标,筛选出适合的蛋白酶,并通过单因 素试验及响应面分析法优化方格星虫的酶解工艺 条件,对其酶解液进行免疫活性的评价,以期为方 格星虫的精深加工利用提供科学基础。 1 材料与方法 沙虫 1.1 材料与试剂 新鲜方格星虫购于湛江市霞山区东风市场,去 掉内脏,体壁用蒸馏水洗净沥干,分装后置于 -20 ℃贮藏,3个月内用完。 木瓜蛋白酶(21×104 U/g )、风味蛋白酶(18×104U/g )、中性蛋白酶(20×104 U/g )、动物水解蛋白酶 (23×104 U/g )、碱性蛋白酶(20×104 U/g )、胰蛋白 酶(20×104 U/g ),购自广西庞博生物科技有限公司;中性红,购自天津市天新精细化工有限公司;Cell Counting Kit-8,日本同仁公司;脂多糖 ( LPS),购 自美国 Sigma 公司;刀豆蛋白 A(Con A),购自上 海源叶生物有限公司;胎牛血清美国,购自 Gemini 公司 ; RPMI 1640培养基、青 /链霉素双抗,购自美 国 Gibco 公司。 1.2 仪器与设备 PHS-25雷磁 pH 计 ,上海康仪仪器有限公司; UV-8000紫外分光光度计 ,上海元析仪器有限公 司;VAPODEST450全自动凯氏定氮仪 ,德国 Gerhardt 公司; CKX41型倒置显微镜 ,日本 Olympus ;Multiskan FC 型酶标仪 ,美国 Thermo 公 司。 1.3 实验方法 1.3.1 含量测定 总氮和非蛋白氮的含量采用凯 氏定氮法 [12]。α-氨基态氮测定采用甲醛滴定法 [13],水解度 DH 按下式计算。 , 式中:A 为酶解液中的 α-氨基态氮质量分数;B 为 原料中的 α-氨基态氮质量分数 ; C 为总氮质量分数; D 为非蛋白氮质量分数。 1.3.2 蛋白酶的筛选 选择动物水解蛋白酶、木瓜 蛋白酶、风味蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶分别在各自适应的条件下进行酶解(表 1),以水解度和蛋白回收率作为指标,确定复合酶的种 类。 复合酶实验:将上述单酶实验酶解效果优最优的 前 3种酶进行复合,以水解度和蛋白回收率为指标 筛选出佳最佳的组合。 1.3.3 单因素试验 以水解度和蛋白回收率为指 标,考察液料比、酶解温度、酶解时间及加酶量对 水解度和蛋白回收率的影响。 表 1 水解酶的最适酶解条件 Table 1 Optimal enzymatic hydrolysis conditions of single enzyme 酶种类 温度 /℃ pH 加酶量 /(U/g) 液料 比 时间 /h 动物蛋白酶 55 7 5 000 3∶1 5 木瓜蛋白酶 55 7 5 000 3∶1 5 风味蛋白酶 55 7 5 000 3∶1 5 中性蛋白酶 50 7 5 000 3∶1 5 碱性蛋白酶 50 8 5 000 3∶1 5 胰蛋白酶 55 8 5 000 3∶1 5 注:料液比指酶解底物中原料与水的体积比 Note: Feed-to-liquid ratio refers to the ratio of raw material mass to water volume in the enzymolysis substrate 1.3.4 响应面试验设计 根据单因素试验结果,以 液料比、加酶量、时间 3个因素为自变量,应用 Box-Behnken 实验原理,设计 3因素 3水平响应面 分析试验,如表 2所示。 表 2 响应面分析因子及水平 Table 2 Factors and levels of response surface experiment 水平 因素 A液料比 B加酶量/(U/g) C时间/h -1 3∶1 3 000 4 0 4∶1 4 000 5 1 5∶1 5 000 6 1.3.5 小鼠巨噬细胞、脾淋巴细胞悬液的制备 根 据 klimetzek[14]的方法稍作修改。在 RPIM1640培养 基(含体积分数 10%胎牛血清(FBS )、体积分数 1%青链霉素)中培养巨噬细胞,置于 37 ℃,φ (CO2)= 5%的细胞孵育箱中培养 3~5 h ,去除无贴壁的 细胞,确保活细胞数大于 95%,将腹腔巨噬细胞悬 液的浓度调整为 3×105~5×105个 /mL 。根据李婉 [15]的方法并加以改动,摘取小鼠脾脏器官,孔径 75 μm 筛网研磨过滤,加入红细胞裂解液静置 5 min 离心,弃掉上清液,沉淀中加入 RPIM-1640完全培养基打 匀,确保活细胞数大于 95%,将脾细胞悬液的浓度 调整为 3×106~5×106个 /mL 。 1.3.6 小鼠脾淋巴细胞增殖活性的测定 在 96孔 板加入 100 μL 上述制备好的脾淋巴细胞悬液,空白 组和阳性组分别用 PBS 磷酸盐缓冲液和刀豆蛋白 A (ConA )代替,样品蛋白浓度设置 5个浓度梯度(分 别为 0.01、0.05、0.1、0.3和 0.9 mg/mL ),每组浓 度设置 6个重复。在 37 ℃ 5%体积分数 CO2中孵 育 48 h ,然后加入 10 μL 水溶性四唑盐 -WST-8溶液,混匀,继续培养 3~4 h ,测得 450 nm 处光密度值。 细胞增值率 = 100%×(D 1 - D 0)/ D 0 , 式中:D 0:空白组吸光度值;D 1:样品组吸光度值。1.3.7 小鼠腹腔巨噬细胞吞噬中性红的测定 在 96孔板中加入 1.3.5中制得的腹腔巨噬细胞悬液 100 μL ,再加入等体积 5组不同质量浓度(0.01、0.05、0.1、0.3和 0.9 mg/mL )的样品,空白组和阳 性组分别用磷酸盐缓冲液(PBS )和脂多糖(LPS )代替,每组浓度设置 6个重复,37 ℃、5%体积分 数 CO2中孵育 48 h 。孵育结束后,每孔加入 100 μL 质量分数 0.1%的中性红生理盐水,2~4 h 后吸去上 清液,加入 200 μL PBS 缓冲液,静置 3 min 后吸去 上清液,重复操作 2次,,最后加入 200 μL 细胞溶解 液,混匀,测其在 540nm 处测的吸光度值。吸光 度值越大,证明细胞吞噬的中性红越多,吞噬能力 越强,反之亦然。 1.3.8 小鼠腹腔巨噬细胞生成 NO 的测定 按照上 述孵育腹腔巨噬细胞 48 h 后,吸取 96孔板中的上 清液,用 NO 试剂盒测的上清液中亚硝酸酸盐的积 累作为培养基中 NO 生成的指标,在 540 nm 处的 吸光度值,根据标准曲线得到培养基中 NO 的浓度。 1.3.9 数据统计 响应面数据采用 DesignExpert 8.0.6软件进行分析;采用 Excel 2010、Origin 9、SPSS 17.0对数据进行分析处理,用 LSD 多重比较 进行差异显著性分析(α = 0.05)。 2 结果与分析 2.1 单因素的确定 在相同加酶量、液料比和时间的情况下不同蛋 白酶在适合自己的温度和 pH 条件下进行酶解,根 据水解度和蛋白回收率选出佳最佳的单酶或复合酶。2.1.1 单酶的选择 在液料比 3∶1,加酶量 5 000U/g 的条件下,中性蛋白酶和碱性蛋白酶在 50 ℃,动物水解蛋白酶、木瓜蛋白酶、风味蛋白酶和胰蛋 白酶在 55 ℃下酶解 5 h ,结果如图 1所示。 动物水解蛋白酶的水解度显著高于其他四种 蛋白酶(P ˂ 0.05),水解度为 24.96%,风味蛋白酶 和木瓜蛋白酶次之,分别为 21.77%和 18.53%。同 时,动物水解蛋白酶的蛋白回收率高最高,可达到 86.21%,但与木瓜蛋白酶的蛋白回收率(83.93%)、风味蛋白酶的蛋白回收率(83.91%)差异不显著(P > 0.05)。综合水解度和蛋白回收率结果考虑,选择 这动物水解蛋白酶、木瓜蛋白酶和风味蛋白酶 3种 酶进行两两复合,进行下一步的实验。 水 解度 单酶种类 a 1、b1、c1标记水解度;a2、b2标记蛋白回收率;凡有一个标记相同字 母即为差异不具统计学意义(P > 0.05)。 The words a1, b1and c1represents degree of hydrolysis. The words a2and b2represent protein recovery. The same letter means no statistically significant difference (P > 0.05). 图 1 不同蛋白酶对水解度和蛋白回收率的影响 Fig.1 Effects of different proteases on hydrolysis and protein recovery 2.1.2 复合酶的选择 动物水解蛋白酶、风味蛋白 酶、木瓜蛋白酶两两复合,在温度 55 ℃,液料比 3∶1,pH 7.0,加酶量 5 000 U/g 的条件下酶解 5 h ,结果如图 2所示。 动物蛋白酶加风味蛋白酶的水解度(24.32%)显著高于其他两组(P ˂ 0.05),蛋白回收率三者无 显著差异(P > 0.05)。因此确定动物水解蛋白酶和 风味蛋白酶复合酶作为实验用酶。 水 解度 a1、b1标记水解度;a2标记蛋白回收率;凡有一个标记相同字母即为差 异不具统计学意义(P > 0.05)。 The words a1and b1represents degree of hydrolysis.The word a2represents protein recovery. The same letter means no statistically significant difference (P > 0.05). 图 2 不同复合蛋白酶对水解度和蛋白回收率的影响 Fig.2 Effects of different compound proteases on hydrolysis and protein recovery 2.1.3 加酶量对酶解效果的影响 在液料比为 3∶1,温度 55 ℃,pH 7.0条件下酶解 5 h ,考察不 同加酶量对水解度和蛋白回收率的影响。结果如图 3所示。 水解度和蛋白回收率随着加酶量的增加而逐 渐升高,当加酶量分别超过 3 000 U/g 和 4 000 U/g 后,水解度和蛋白回收率无显著性变化(P > 0.05)。这是因为酶解初始阶段底物浓度和蛋白酶浓度最最 大,酶解速度很快;随着反应的进行,底物浓度减 小,酶活力下降,减少了酶解液中蛋白与酶的接触 面积,酶解速度降低。综合考虑选取加酶量 4 000U/g 为宜。 水解度 a 1、b1标记水解度;a2、b2、c2标记蛋白回收率;凡有一个标记相同字 母即为差异不具统计学意义(P > 0.05) The words a1and b1represents degree of hydrolysis. The words a2, b2and c2represent protein recovery. The same letter means no statistically significant difference (P > 0.05) 图 3 加酶量对水解度和蛋白回收率的影响 Fig.3 The effect of enzyme dosage on hydrolysis and protein recovery 2.1.4 酶解时间对酶解效果的影响 在液料比为 3∶1,温度 55 ℃,pH 7.0,加酶量 4 000 U/g 的条 件下,考察不同酶解时间对水解度和蛋白回收率的 影响,如图 4所示。 水解度和蛋白回收率随着酶解时间的延长而 逐渐增加,当酶解时间分别达到 4 h 和 5 h 时,水 解度和蛋白回收率无显著性变化(P > 0.05),是因 为酶解初始阶段底物浓度和蛋白酶浓度大最大,酶解 速度很快;随着反应的进行,底物浓度减小,酶活 力下降,减少了酶解液中蛋白与酶的接触面积,酶 解速度降低。因此综合考虑选取酶解时间 5 h 为宜。 2.1.5 液料比对酶解效果的影响 温度 55 ℃,pH 7.0,加酶量 4 000 U/g 的情况下酶解 5 h ,考察不同 液料比对水解度和蛋白回收率的影响,如图 5所示。 随着液料比增加水解度和蛋白回收率逐渐增 大,在液料比从 1∶1增加到 3∶1时水解度和蛋白 回收率迅速增加。这是因为随着液料比的增加,底 物和酶的接触面积也随之增加,酶解速度加快 [16]。但是当液料比达到 4∶1时,底物与酶的接触面积 已经达到大最大,变化缓慢,趋势无明显改变(P >0.05)。因此选用液料比为 4∶1。 水解度 a1、b1、c1、d1标记水解度;a2、b2、c2标记蛋白回收率;凡有一个标记 相同字母即为差异不具统计学意义(P > 0.05)。 The words a1, b1,c1andd1represent degree of hydrolysis. The words a2,b2and c2represent protein recovery. The same letter means no statistically significant difference (P > 0.05). 图 4 酶解时间对水解度和蛋白回收率的影响 Fig.4 The effect of enzymatic hydrolysis time on hydrolysis and protein recovery 液料比 a1、b1、c1、d1标记水解度;a2、b2、c2标记蛋白回收率;凡有一个标记 相同字母即为差异不具统计学意义(P > 0.05)。 The words a1, b1,c1andd1represent degree of hydrolysis. The words a2,b2and c2represent protein recovery. The same letter means no statistically significant difference (P > 0.05). 图 5 液料比对水解度和蛋白回收率的影响 Fig.5 The effect of liquid ratio on hydrolysis and protein recovery 2.1.6 酶解温度对酶解效果的影响 在液料比 4∶1,pH 7.0,加酶量 4 000 U/g ,酶解 5 h 的条件 下,考察不同酶解温度对水解度和蛋白回收率的影 响,如图 6所示。 随着温度的升高,水解度和蛋白回收率呈现先 上升后下降趋势,在 55 ℃时达到大最大,超过此温 度后水解度显著降低(P < 0.05),这是因为蛋白酶 在高温条件下会失活,失去其原有切断肽链的作 用。因此选用 55 ℃作为酶解佳最佳温度。 a1、b1、c1标记水解度;a2、b2标记蛋白回收率;凡有一个标记相同字 母即为差异不具统计学意义(P > 0.05)。 The words a1, b1and c1represents degree of hydrolysis. The words a2and b2represent protein recovery. The same letter means no statistically significant difference (P > 0.05). 图 6 酶解温度对水解度和蛋白回收率的影响 Fig.6 The effect of enzymatic hydrolysis temperature on hydrolysis and protein recovery 2.2 响应面优化试验 2.2.1 响应面实验结果和分析 综合两个酶解指 标发现蛋白质回收率在各个因素中的变化趋势不 明显。因此以液料比、加酶量和酶解时间为因素,水解度为响应值进行响应面优化试验,实验设计及 结果见表 3。采用 Design Expert 8.0.6软件对表 3的 数据进行方差分析,结果见表 4。 表 3响应面设计与结果 Table.3 Experimental design and results for response surface analysis 序号 A液料比 B加酶量/ (U/g) C时间 /h Y1水解度 /% 1 1 0 1 36.82 2 1 0 -1 33.36 3 0 -1 -1 28.02 4 -1 0 -1 28.42 5 -1 0 1 37.29 6 0 0 0 37.41 7 1 1 0 35.21 8 0 1 1 36.32 9 1 -1 0 34.86 10 0 0 0 37.82 11 -1 1 0 33.53 12 0 0 0 38.05 13 -1 -1 0 32.43 14 0 0 0 36.68 15 0 1 -1 33.87 16 0 -1 1 37.69 17 0 0 0 37.66 表 4回归方程的方差分析 Table.4 Analysis of variance of regression equation 来源 平方 自由 度 均方 F值 P值 显著 性 模型 153.02 9 17.00 52.26 <0.0 001 ** A 9.20 1 9.20 28.28 0.0 011 ** B 4.40 1 4.40 13.51 0.0 079 ** C 74.73 1 74.73 229.68 <0.0 001 ** AB 0.14 1 0.14 0.43 0.5 319 AC 7.32 1 7.32 22.49 0.0 021 ** BC 13.03 1 13.03 40.06 0.0 004 ** A2 13.04 1 13.04 40.06 0.0 004 ** B2 13.00 1 13.00 39.95 0.0 004 ** C2 13.52 1 13.52 41.56 0.0 004 ** 残差 2.28 7 0.33 失拟性 1.17 3 0.39 1.41 0.3 636 纯误差 1.11 4 0.28 总差 155.30 16 注:*表示差异显著,P < 0.05;**表示差异极显著,P < 0.01;模型的 决定系数 R 2=0.985 3,调整系数 R 2Adj=0.966 5 Note:*meansthedifferencewassignificant,P <0.05;**meansthe difference was extremely significant, P < 0.01; The determination coefficient of the model R 2 = 0.985 3 and the adjustment coefficient R 2Adj= 0.966 5. 通过响应面方差分析得到水解度的二次多项 回归方程为:Ŷ = 37.52 + 1.07A + 0.74B + 3.06C -0.19AB -1.35AC -1.80BC -1.76A 2-1.76B 2 -1.79C 2。由表4可知,水解度回归模型 P < 0.0 001,表示该回归模型极显著,水解度回归模型的且失拟 项 P = 0.3 636 > 0.05,失拟项不显著,说明该实验 的预测值和实际值相拟合,回归模型稳定 [17]。 2.2.2 响应面分析和条件优化 响应面分析是通 过 DesignExpert 对各因素的交互作用绘制的三维 空间曲面图,交互作用结果如图 7-9所示。 由图 7可知,随着加酶量和液料比的增加水解 度增加,并且响应面高最高点在设计范围内,水解度 有极大值。由图 8可知,加酶量固定,随着时间的 增加,水解度先逐渐升高再趋于平稳,但是固定时 间加酶量的变化对水解度的影响不明显,说明加酶 量对水解度的作用弱于酶解时间;由图 9可知,时 间和液料比的交互作用对水解度的影响,变化趋势 和图 8相似。 响应面图中的等高线也能反映各因素交互作 用的强弱,等高线越接近椭圆,各因素交互作用越 强 [17],由图 7-9可知,交互作用对水解度影响的顺 序为:加酶量和液料比交互作用 >加酶量和时间 交互作用 >时间和液料比交互作用。Design Expert 对于实验的优化结果为:加酶量 4 991.9 U/g ,液料 比为 3.01 ∶ 1,时间 5.2 h ,预测的水解度为 38.16%。以加酶量 5 000 U/g ,液料比 3 ∶ 1,时间 5.2 h 进行 验证实验,在此条件下得到方格星虫的水解度为 38.92%,与预测值 38.16%无显著性差异(P >0.05),证明建立的模型能够准确的预测酶解方格星 虫的水解度。 图 7 加酶量和液料比的交互作用对水解度影响 Fig.7 The effect of enzyme dosage and liquid-solid ratio on degree of hydrolysis 图 8 加酶量和时间对水解度的影响 Fig.8 The effect of enzyme dosage and time on degree of hydrolysis 图 9 时间和液料比对水解度的影响 Fig.9 The effect of liquid-solid ratio and time on degree of hydrolysis 2.3 酶解液对细胞免疫调节的影响 对具有免疫调节功能的活性物质的评价一般 分为体内实验和体外实验,体内实验操作复杂、实 验周期长,体外实验就是模拟一个类似体内环境进 行生物体培养人,具有方便快捷等特点,因而,常 用脾淋巴细胞的增殖活性和巨噬细胞的吞噬功能 及 NO 的分泌能力来评价活性物质是否具有免疫调 节作用 [18]。 2.3.1 酶解液对脾淋巴细胞增殖活性的影响 在 非特异免疫过程中脾淋巴细胞能够与特异性抗原 共同作用,促进脾淋巴细胞的增值转化。方格星虫 酶解液对脾淋巴细胞增殖活性的结果如图 10所示。 方格星虫酶解液的蛋白浓度为 0.9 mg/mL 时小 鼠脾淋巴巨噬细胞增殖率为 30.57%,明显高于阳性 刀豆蛋白组和其他浓度组(P < 0.05),并且高于酶 解制备三文鱼寡肽(MOP )的增值率(27.63%)[19];蛋白浓度在 0.01~0.3mg/ml 范围内增值率无显著 变化(P ﹥0.05)。李婉 [15]研究牡蛎蛋白酶解液对 小鼠脾淋巴细胞增殖活性的影响,发现当蛋白质量 浓度为 0.6mg/mL 时脾淋巴细胞增殖活性高最高为 32.96%。何小庆 [20]研究波纹巴非蛤超滤组分对小鼠 脾淋巴细胞增殖活性的影响发现,在蛋白浓度为 1mg/mL 时波纹巴非蛤对脾淋巴细胞的增值率为 50.66%,高于牡蛎酶解液和方格星虫酶解液。 凡有一个标记相同字母即为差异不具统计学意义(P > 0.05)。 Same letters indicated no significant difference (P > 0.05) 图 10 酶解液对脾淋巴细胞增殖活性的影响 Fig.10 Effect of the enzymatic hydrolysates on lymphocyte proliferation 2.3.2 对腹腔巨噬细胞吞噬功能的影响 巨噬细 胞在非特异免疫过程中也起到了重要作用,巨噬细 胞是一种通过有吞噬,呈递抗原,分泌细胞因子从 而引起炎症反应来抵抗病原的一种细胞 [15]。 方格星虫酶解液对腹腔巨噬细胞吞噬功能的 结果如图 11所示。当蛋白浓度为 0.01 mg/mL 时,酶解液的 D (540nm)值跟阳性脂多糖组无显著性差 异(P > 0.05),之后随着浓度增加,D (540 nm)值显 著高于阳性脂多糖组和空白组(P < 0.05)。方格星 虫酶解液蛋白浓度 0.05 mg/mL 时,其 D (540nm)值高于何小庆 [20]研究的波纹巴非蛤酶解液的值,低 于牡蛎蛋白酶解液。当蛋白质量浓度为 0.9 mg/mL 时,方格星虫酶解液的 D (540 nm)值高于马氏珠母 贝超滤组分 [21]。 凡有一个标记相同字母即为差异不具统计学意义(P > 0.05)。 Same letters indicated no significant difference (P >0.05) 图 11 酶解液对腹腔巨噬细胞吞噬功能的影响 Fig.11 Effect of the enzymatic hydrolysates phagocytic function in peritoneal macrophages 2.3.3 对腹腔巨噬细胞生成 NO 的影响 NO 在非 特异免疫过程、炎症反应等中起到非常重要的作 用,当巨噬细胞在受到外界刺激时会释放大量的 NO 来参与免疫反应 [20]。方格星虫酶解液对腹腔巨 噬细胞生成 NO 的结果如图 12所示。 方格星虫酶解液蛋白浓度低于 0.05 mg/mL 时 生成 NO 的能力高于空白组(P < 0.05)但低于阳性 脂多糖组;酶解液浓度高于 0.3 mg/mL 时,生成 NO 能力显著高于阳性脂多糖组(P < 0.01)。在方格星 虫酶解液浓度为 0.9 mg/mL 的时候生成 NO 能力为 56.2 μmol/L ,高于波纹巴非蛤酶解产物 [20],但是低 于牡蛎酶蛋白解液的超滤组分 [15]。 凡有一个标记相同字母即为差异不具统计学意义(P > 0.05)。 Same letters indicated no significant difference (P >0.05) 图 12 酶解液对腹腔巨噬细胞生成 NO 的影响 Fig.12 Effect of the enzymatic hydrolysates NO secretion ability in peritoneal macrophages 3 结论 1)通过比较不同蛋白酶对方格星虫的酶解效 果,,最终确定动物水解蛋白酶和风味蛋白酶同时添 加对方格星虫进行酶解;通过响应面分析,,最终优 化的条件为:加酶量 5 000 U/g ,液料比为 4 ∶ 1,时间 5.2 h ,水解度为 38.92%。 2)方格星虫酶解液的蛋白质量浓度为 0.9mg/mL 时,与阳性对照组(ConA )相比,能够显 著增加脾淋巴细胞的增殖能力(30.57%);在蛋白 质量浓度为 0.3~0.9mg/mL 时,与阳性对照组 (LPS )相比,能够显著提高腹腔巨噬细胞吞噬中 性红和生成 NO 的能力,因此方格星虫酶解液对免 疫细胞具有促进作用。 参 考 文 献 [1] 李凤鲁 ,庆兰 ,贵田 ,等 .中国沿海方格星虫属(星虫 动物门)的研究 [J].青岛海洋大学学报 ,1990,20(1):93-99. [2] BASSIT R A, SAWADA L A, BACURAU R F, et al. The effect of BCAA supplementation upon the immune response of triathletes [J]. Medicine &Science in Sports & Exercise, 2000, 32(7): 1214-1219. [3] ZHANG Q, DONG L F, TONG T, et al. Polysaccharides in Sipunculus nudus : extraction condition optimization and antioxidant activities[J]. JournalofOceanUniversityofChina, 2017,16(1):74-80. [4] 李珂娴 ,沈先荣 ,何颖 ,等 .方格星虫多糖对小鼠免疫 功能的影响 [J].中国海洋药物 , 2012, 31(1): 46-49. [5] ZHANG C X, DAI Z R, CAI Q X. Anti-inflammatory andanti-nociceptiveactivitiesof Sipunculusnudus L. extract[J]. Journal of Ethnopharmacology, 2011, 137(3):1177-1182. [6] LI N, SHEN X R, LIU Y M, et al. Isolation, characterization, and radiation protection of Sipunculus nudus L. polysaccharide[J]. International Journal of Biological Macromolecules, 2016, 83: 288-296. [7] SUJ,JIANGLL,WUJN,etal.Anti-tumorand anti-virus activity of polysaccharides extracted from Sipunculus nudus (SNP) on Hepg2.2.15[J]. International Journal of Biological Macromolecules, 2016, 87: 597-602. [8] 李江峰 ,葛卫红 ,沈先荣 ,等 .星虫多糖抗疲劳作用实 验研究 [J].中国实验方剂学杂志 ,2012, 18(23):212-215. [9] 蒋定文 ,沈先荣 ,贾福星 ,等 .海洋星虫提取物的营养 分析及免疫调节作用的初步观察 [J].中国生化药物杂 志 , 2004, 25(2): 96-97. [10] 张桂和 ,赵谋明 ,巫光宏 .方格星虫酶解物成分分析 及其抗氧化作用 [J].食品与生物技术学报 ,2007,26(3): 80-84. [11] 朱银玲 ,李思东 ,方富永 .方格星虫多肽的酶解法制 备工艺优化与抗氧化作用研究 [J].化学通报 ,2012,75(7): 642-647. [12] 中国国家标准化管理委员会 .GB/T5009.5-2016.食品 中蛋白质的测定方法 [S].北京 :中国标准出版社 ,2016:1-7. [13] 王永华 .食品分析 [M].北京 ,中国轻工业出版社 ,2012. [14] KLIMETZEKV,REMOLDHG.Themurinebone marrow macrophage, a sensitive indicator cell for murine migration inhibitory factor and a new method for theirharvest[J].CellularImmunology,1980,53(2):257-266. [15] 李婉 ,曹文红 ,章超桦 ,等 .牡蛎酶解产物的组成特点 及其体外免疫活性 [J]. 食品工业科技 , 2017,38(16):35-42. [16] 陈海燕 ,郑惠娜 ,曹文红 ,等 .响应面法优化波纹巴 非蛤肌肉蛋白酶解工艺条件 [J].食品工业科技 ,2016,37(15): 218-224. [17] 李侠 ,张利宽 ,刘春萌 ,等 .响应面法优化荞麦蛋白 酶解工艺 [J].食品科学 , 2012, 33(22): 145-148. [18] 杨小军 ,左伟勇 ,陈伟华 ,等 .灌喂大豆蛋白胃蛋白 酶酶解物对大鼠免疫功能的影响 [J].畜牧兽医学报 ,2005, 36(4): 348-351. [19] YANG R Y, ZHANG Z F, PEI X R, et al. Immunomodulatory effects of marine oligopeptide preparation from Chum Salmon ( Oncorhynchusketa ) in mice[J]. Food Chemistry, 2009, 113(2): 464-470. [20] 何小庆 .波纹巴非蛤活性肽的酶法制备及其免疫活性 的研究 [D].湛江:广东海洋大学 , 2014. [21] 邓志程 .马氏珠母贝全脏器免疫活性肽的制备及其免 疫活性的研究 [D].湛江:广东海洋大学 , 2015.
确定




还剩6页未读,是否继续阅读?
中国格哈特为您提供《方格星虫(沙虫)总氮和非蛋白氮含量的检测》,该方案主要用于其他水产制品中理化分析检测,参考标准《GB 5009.5 食品安全国家标准 食品中蛋白质的测定》,《方格星虫(沙虫)总氮和非蛋白氮含量的检测》用到的仪器有格哈特全自动凯氏定氮仪VAPODEST 450、格哈特快速干燥仪STL56、格哈特红外加热消解快速消化系统TTs125、格哈特强力高重现振荡器LS500/RO500、格哈特维克松废气废物处理涤气系统VS、德国移液器MM、凯氏定氮催化剂5.0g K2SO4+0.5g CuSO4 x 5H2O
该厂商其他方案
更多
















