
方案详情
文
异形胞(heterocyst)某些丝状蓝藻(如束毛藻、鱼腥藻、念珠藻等)所特有的变态营养细胞,是由普通营养细胞在一定的条件下尤其是氮素营养缺乏时分化而成。异形胞一般与营养细胞同形,单个地间生,一条藻丝上往往有数个异形细胞。异形胞与营养细胞的主要形态区别是:个体大,细胞壁厚,细胞质中的颗粒物质溶解成颗粒状态,颜色呈淡黄绿色或呈透明状
方案详情

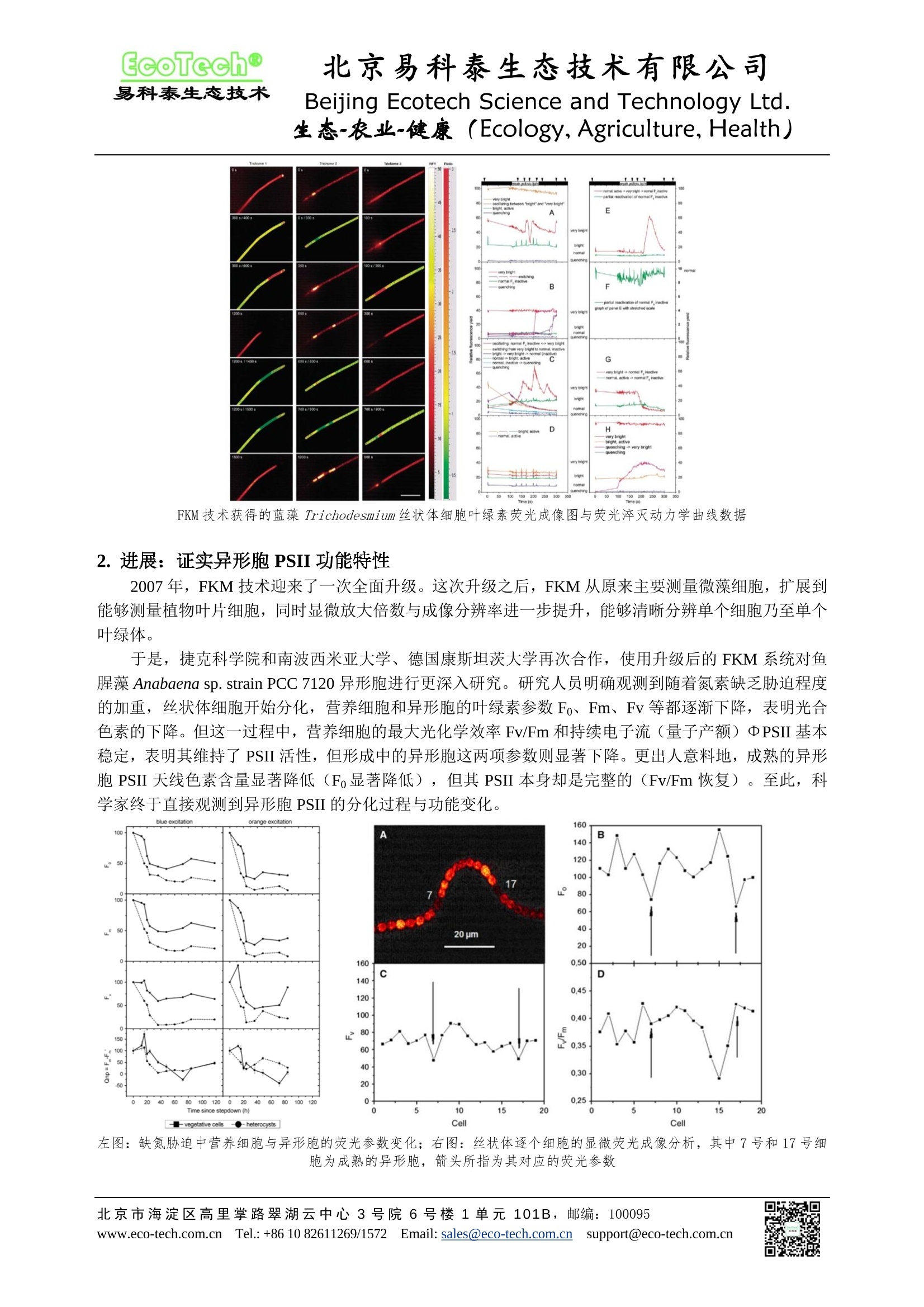
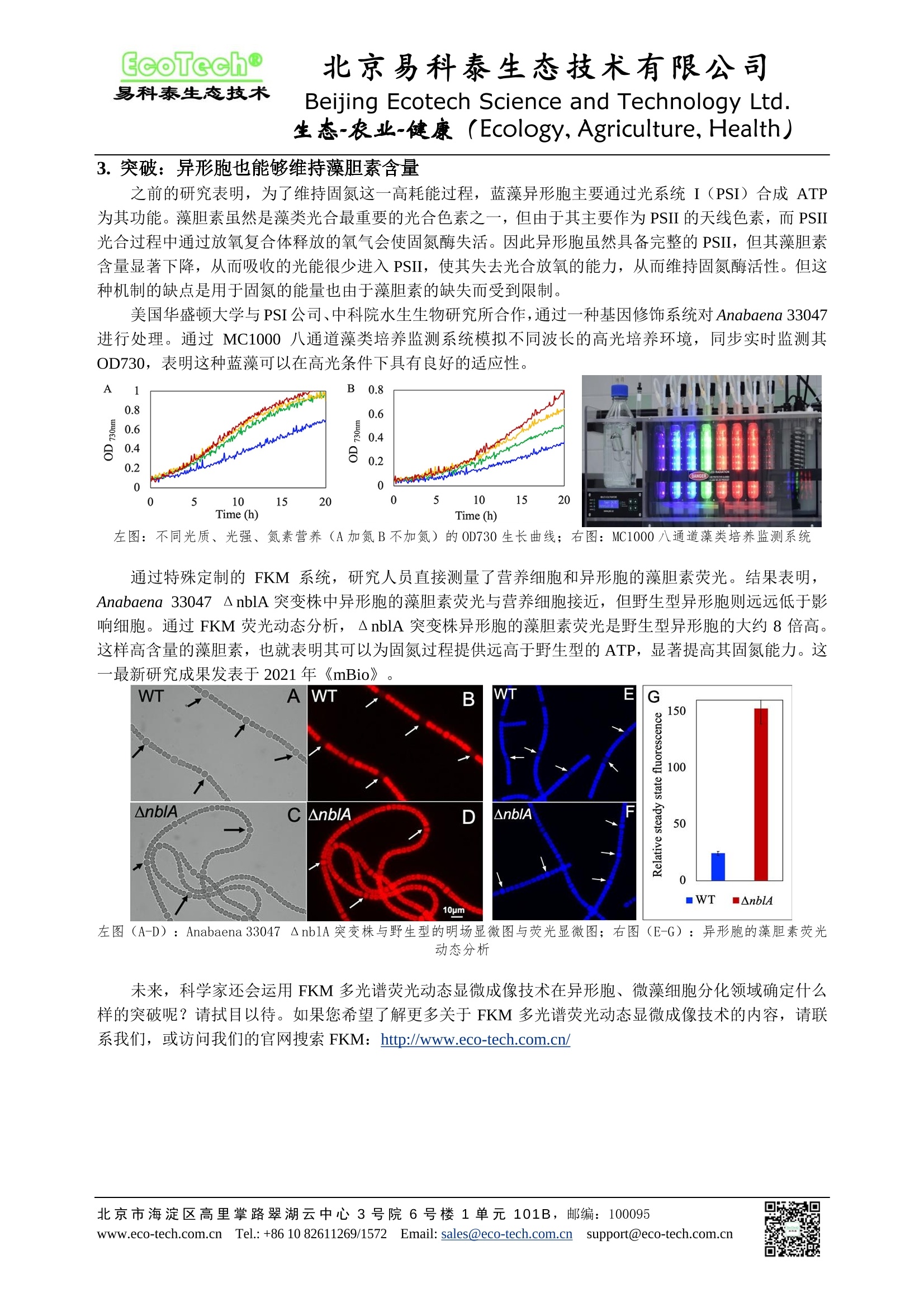
EcoTech@易科泰生态技术 北京易科泰生态技术有限公司Beijing Ecotech Science and Technology Ltd. 北京易科泰生态技术有限公司 Beijing Ecotech Science and Technology Ltd. 生态-农业-健康(Ecology, Agriculture, Health) FKM 多光谱荧光动态显微成像技术:蓝藻异形胞光合特性研究 异形胞 (heterocyst)某些丝状蓝藻(如束毛藻、鱼腥藻、念珠藻等)所特有的变态营养细胞,是由普通营养细胞在一定的条件下尤其是氮素营养缺乏时分化而成。异形胞一般与营养细胞同形,单个地间性, 一条藻丝上往往有数个异形细胞。异形胞与营养细胞的主要形态区别是:个体大,细胞壁厚,细胞质中的颗粒物质溶解成颗粒状态,颜色呈淡黄绿色或呈透明状。 而最为关键的生理功能区别有两点: 异形胞能进行固氮作用,在其高含量固氮酶的催化下,将空气中的Nz 转变为 NH, NH, 进而形成氨基酸。 异形胞藻胆素含量显著低于营养细胞。 正是基于这两点,则引出了科学家的两点疑惑: ● 早期研究证实,蓝藻在固氮过程中也是存在光合放氧的,但固氮酶会被氧氧不可逆地抑制。蓝藻如何保护固氮酶不被光合作用放出的氧气破坏? ● 如何直接观测异形胞与营养细胞光合特性的差异? 从21世纪之初,随着 FKM 多光谱荧光动态显微成像技术的提出和逐渐完善,科学家对蓝藻异形形光合特性的研究达到前人所不能企及的高度,甚至取得了突破性的进展。本文通过相关文献案例展示这—一研究发展的过程: FKM 多光谱荧光动态显微成像系统 北京易科泰生态技术有限公司 Beijing Ecotech Science and Technology Ltd.生态-农业-健康((Ecology,Agriculture, Health) 1.开端:证实固氮和光合作用的时空隔离 FKM 多光谱荧光动态显微成像技术于2000年正式提出并实用化,美国罗格斯大学 Berman-Frank与德国康斯坦茨大学、捷克微生物研究所合作利用 FKM 技术对束毛藻 Trichodesmium strain IMS101丝状藻的光合特性进行研究,对比固氮酶的活性与分布,发现固氮和光合作用从时间和空间两方面被隔离开了。他们推测在光合放氧进化的早期阶段,固氮酶是厌氧异养机制的一个电子受体,而光系统I(PSI)为固氮提供了厌氧的微环境。这一研究成果发表于2001年《Science》。 A.阿拉弗拉海的Trichodesmium spp. B.使用荧光显微镜和荧光二级抗体Alexa-350(分子探针)观察到的固氮酶在藻丝上的分布C.用一级抗体标记固氮酶并通过共聚焦激光显微镜获取的图像 D.采集自阿拉弗拉海的 T. erythraeum, 褐色斑点表示固氮最旺盛的 13:30-14:30细胞内产生的H202的分布E到H. Trichodesmium IMS101 的叶绿素荧光动力学显微成像E和G. 光周期早期(00:00-04:00)的藻丝,此时的固氮作用很弱F和H.高固氮作用时的藻丝(进入光周期后5-7小时)E和F.相对叶绿素荧光产额成像图,图中可见在对应时间里正常和明亮的藻丝(比如具有高荧光产额但 Fv/Fm 很低的藻丝)G和H. PSII 效率Fv/Fm 在藻丝上的假彩色二维分布图 之后,他们又合作进井更加深入的研究。通过 FKM 技术获得的叶绿素荧光成像图与荧光淬灭动力学曲线数据,再次表明束毛藻光合作用与固氮的协同作用涉及光合活性状态可逆变化的复杂时空格局。这些活性状态提供了通过 PSII 的电子传输进行固氮所需的协调和微调,并将光合放氧对固氮酶的抑制作用降至最低。这一研究发表于 2004年《Plant Physiology》。 在这一研究结果通过叶绿素荧光参数最小荧光 Fo、可变荧光 Fv 等,已经表明进行固氮的蓝藻细胞其 PSII 活性已经极低,进而丧失光合放氧能力。研究者也推测固氮与光合的时空分隔可能与异形胞有关。但此时的 FKM技术尚不完善,获得的显微荧光成象图不能明确区分丝状体上的单个细胞,因此也没能获得进一步的支持证据。 ( 北京市海淀区高里掌路翠湖云中心3号院6号楼1单元101B,邮编:100095 ) ( www.eco-tech.com.c n1 Tel.:+86 10 82611269/1572 E mail: sales@eco-te ch .com.cn s upport@eco-tech.com.cn ) 北京易科泰生态技术有限公司 Beijing Ecotech Science and Technology Ltd.生态-农业-健康((Ecology,Agriculture, Health) mei ne FKM 技术获得的蓝藻 Trichodesmium丝状体细胞叶绿素荧光成像图与荧光淬灭动力学曲线数据 2. 进展:证实异形形 PSII功能特性 2007年, FKM 技术迎来了一次全面升级。这次升级之后, FKM 从原来主要测量微藻田胞,扩展到能够测量植物叶片细胞,同时显微放大倍数与成像分辨率进一步提升,能够清晰分辨单个细胞乃至全个叶绿体。 于是,捷克科学院和南波西米亚大学、德国康斯坦茨大学再次合作,使用升级后的 FKM 系统对鱼腥藻 Anabaena sp. strain PCC 7120 异形胞进行更深入研究。研究人员明确观测到随着氮素缺乏胁迫程度的加重,丝状体细胞开始分化,营养细胞和异形胞的叶绿素参数 Fo、Fm、Fv 等都逐渐下降,表明光合色素的下降。但这一过程中,营养细胞的最大光化学效率 Fv/Fm 和持续电子流(量子产额) DPSII基本稳定,表明其维持了 PSII活性,但形成中的异形胞这两项参数则显著下降。更出人意料地,成熟的异形胞 PSII 天线色素含量显著降低(Fo显著降低),但其PSII本身却是完整的(Fv/Fm恢复)。至此,科学家终于直接观测到异形胞 PSII 的分化过程与功能变化。 blue excitati angeexcitation 左图:缺氮胁迫中营养细胞与异形胞的荧光参数变化;右图:丝状体逐个细胞的显微荧光成像分析,其中7号和17号号胞为成熟的异形胞,箭头所指为其对应的荧光参数 ( 北京市海淀区高里掌路翠湖云中心3号院6号楼1单元101B,邮编:100095 www.eco-tech.com.c nl Tel.:+86 10 82611269/1572 E mail: sales@eco-te ch .com.cn s upport@eco-tech.com.cn ) 北京易科泰生态技术有限公司 Beijing Ecotech Science and Technology Ltd.生态-农业-健康((Ecology,Agriculture, Health) 3.突破:异形胞也能够维持藻胆素含量 之前的研究表明,为了维持固氮这一高耗能过程,蓝藻异形胞主要通过光系统I(PSI)合成 ATP为其功能。藻胆素虽然是藻类光合最重要的光合色素之一,但由于其主要作为 PSII的天线色素,而PSII光合过程中通过放氧复合体释放的氧气会使固氮酶失活。因此异形胞虽然具备完整的 PSII, 但其藻胆素含量显著下降,从而吸收的光能很少进入 PSII,使其失去光合放氧的能力,从而维持固氮酶活性。但这种机制的缺点是用于固氮的能量也由于藻胆素的缺失而受到限制。 美国华盛顿大学与PSI公司、中科院水生生物研究所合作,通过一种基因修饰系统对 Anabaena 33047进行处理。通过 MC1000 八通道藻类培养监测系统模拟不同波长的高光培养环境,同步实时监测其OD730,表明这种蓝藻可以在高光条件下具有良好的适应性。 左图:不同光质、光强、氮素营养(A加氮B不加氮)的OD730生长曲线;右图: MC1000八通道藻类培养监测系统 通过特殊定制的 FKM 系统,研究人员直接测量了营养细胞和异形胞的藻胆素荧光。结果表明,Anabaena 33047 △nblA 突变株中异形胞的藻胆素荧光与营养细胞接近,但野生型异形胞则远远低于影响细胞。通过 FKM 荧光动态分析,△ nblA 突变株异形胞的藻胆素荧光是野生型异形胞的大约8倍高。这样高含量的藻胆素,也就表明其可以为固氮过程提供远高于野生型的 ATP, 显著提高其固氮能力。这一最新研究成果发表于2021年《mBio》。 左图(A-D): Anabaena 33047AnblA突变株与野生型的明场显微图与荧光显微图;右图(E-G):异形胞的藻胆素荧光动态分析 未来,科学家还会运用 FKM 多光谱荧光动态显微成像技术在异形胞、微藻细胞分化领域确定什么样的突破呢?请拭目以待。如果您希望了解更多关于 FKM 多光谱荧光动态显微成像技术的内容,请联系我们,或访问我们的官网搜索 FKM: http://www.eco-tech.com.cn/ ( 北京市海淀区高里掌路翠湖云中心3号院6号楼1单元101B, 邮编:100095 ) 生态-农业-健康: ((Ecology,Agriculture,Health) 小球衣藻叶绿素荧光显微成像分析,可见不同细胞之间的差异及叶绿素在细胞中的分布:左:最小荧光Fo;中:最大荧光Fm;右:最大光化学效率 Fv/Fm ( 参考文献: ) ( 1. B erman-Frank I, e t al. 2001. Segregation of Nitrogen Fixation and Oxygenic Photosynthesis in the MarineCyanobacterium Trichodesmium. Science, 294: 1534- 1 537 ) ( 2. Kipper H, F e rimazova N, Setlik I, e t a l . 2004. Traffic Lights in Trichodesmium. R e gulation o f Photosynthesis for Nitrogen Fixation Studied by C h lorophyll F l uorescence Ki n etic Mi c roscopy. Pla n tPhysiology, 135:2120-2133 ) 3. Ferimazova N, et al. 2013. Regulation of photosynthesis during heterocyst differentiation in Anabaena sp.strain PCC 7120 investigated in vivo at single-cell level by chlorophyll fluorescence kinetic microscopy.Photosynthesis Research, 116(1): 79-91 4. Bandyopadhyay A, et al. 2021. Antenna Modification Leads to Enhanced Nitrogenase Activity in a HighLight-Tolerant Cyanobacterium.mBio, 12(6): e03408-21 北京易科泰生态技术公司提供藻类培养与表型研究全面技术方案: ● AquaPen、FluorCam 藻类叶绿素荧光/多光谱荧光技术 SL3500、AlgaeTron/FytoScope 智能 LED 光源与生长箱 SpectraPen/PolyPen、Specim 高光谱测量技术 FKM多光谱荧光动态显微成像系统 FMT150 藻类培养与在线监测系统 MC1000 8 通道藻类培养系统 ET-PSI多功能藻类培养与在线监测系统 AlgaTechQ高通量藻类表型成像分析平台 ( 北京市海淀区高里掌路翠湖云中心3号院6号楼1单元101B, 邮编:100095 ) 北京市海淀区高里掌路翠湖云中心号院号楼单元,邮编:ww.eco-tech.com.cn lTel.: +mail:sales@eco-tech.com.cnsupport@eco-tech.com.cn 异形胞(heterocyst)某些丝状蓝藻(如束毛藻、鱼腥藻、念珠藻等)所特有的变态营养细胞,是由普通营养细胞在一定的条件下尤其是氮素营养缺乏时分化而成。异形胞一般与营养细胞同形,单个地间生,一条藻丝上往往有数个异形细胞。异形胞与营养细胞的主要形态区别是:个体大,细胞壁厚,细胞质中的颗粒物质溶解成颗粒状态,颜色呈淡黄绿色或呈透明状。 而最为关键的生理功能区别有两点:1.异形胞能进行固氮作用,在其高含量固氮酶的催化下,将空气中的N2转变为NH3,NH4+,进而形成氨基酸。2.异形胞藻胆素含量显著低于营养细胞。正是基于这两点,则引出了科学家的两点疑惑:3.早期研究证实,蓝藻在固氮过程中也是存在光合放氧的,但固氮酶会被氧气不可逆地抑制。蓝藻如何保护固氮酶不被光合作用放出的氧气破坏?4.如何直接观测异形胞与营养细胞光合特性的差异?从21世纪之初,随着FKM多光谱荧光动态显微成像技术的提出和逐渐完善,科学家对蓝藻异形胞光合特性的研究达到前人所不能企及的高度,甚至取得了突破性的进展。本文通过相关文献案例展示这一研究发展的过程: 1. 开端:证实固氮和光合作用的时空隔离FKM多光谱荧光动态显微成像技术于2000年正式提出并实用化,美国罗格斯大学Berman-Frank与德国康斯坦茨大学、捷克微生物研究所合作利用FKM技术对束毛藻Trichodesmium strain IMS101丝状藻的光合特性进行研究,对比固氮酶的活性与分布,发现固氮和光合作用从时间和空间两方面被隔离开了。他们推测在光合放氧进化的早期阶段,固氮酶是厌氧异养机制的一个电子受体,而光系统I(PSI)为固氮提供了厌氧的微环境。这一研究成果发表于2001年《Science》。 之后,他们又合作进行更加深入的研究。通过FKM技术获得的叶绿素荧光成像图与荧光淬灭动力学曲线数据,再次表明束毛藻光合作用与固氮的协同作用涉及光合活性状态可逆变化的复杂时空格局。 这些活性状态提供了通过PSII的电子传输进行固氮所需的协调和微调,并将光合放氧对固氮酶的抑制作用降至最低。这一研究发表于2004年《Plant Physiology》。在这一研究结果通过叶绿素荧光参数最小荧光F0、可变荧光Fv等,已经表明进行固氮的蓝藻细胞其PSII活性已经极低,进而丧失光合放氧能力。研究者也推测固氮与光合的时空分隔可能与异形胞有关。但此时的FKM技术尚不完善,获得的显微荧光成像图不能明确区分丝状体上的单个细胞,因此也没能获得进一步的支持证据。 2. 进展:证实异形胞PSII功能特性2007年,FKM技术迎来了一次全面升级。这次升级之后,FKM从原来主要测量微藻细胞,扩展到能够测量植物叶片细胞,同时显微放大倍数与成像分辨率进一步提升,能够清晰分辨单个细胞乃至单个叶绿体。于是,捷克科学院和南波西米亚大学、德国康斯坦茨大学再次合作,使用升级后的FKM系统对鱼腥藻Anabaena sp. strain PCC 7120异形胞进行更深入研究。研究人员明确观测到随着氮素缺乏胁迫程度的加重,丝状体细胞开始分化,营养细胞和异形胞的叶绿素参数F0、Fm、Fv等都逐渐下降,表明光合色素的下降。但这一过程中,营养细胞的最大光化学效率Fv/Fm和持续电子流(量子产额)ΦPSII基本稳定,表明其维持了PSII活性,但形成中的异形胞这两项参数则显著下降。更出人意料地,成熟的异形胞PSII天线色素含量显著降低(F0显著降低),但其PSII本身却是完整的(Fv/Fm恢复)。至此,科学家终于直接观测到异形胞PSII的分化过程与功能变化。 3. 突破:异形胞也能够维持藻胆素含量之前的研究表明,为了维持固氮这一高耗能过程,蓝藻异形胞主要通过光系统I(PSI)合成ATP为其功能。藻胆素虽然是藻类光合最重要的光合色素之一,但由于其主要作为PSII的天线色素,而PSII光合过程中通过放氧复合体释放的氧气会使固氮酶失活。因此异形胞虽然具备完整的PSII,但其藻胆素含量显著下降,从而吸收的光能很少进入PSII,使其失去光合放氧的能力,从而维持固氮酶活性。但这种机制的缺点是用于固氮的能量也由于藻胆素的缺失而受到限制。美国华盛顿大学与PSI公司、中科院水生生物研究所合作,通过一种基因修饰系统对Anabaena 33047进行处理。通过MC1000八通道藻类培养监测系统模拟不同波长的高光培养环境,同步实时监测其OD730,表明这种蓝藻可以在高光条件下具有良好的适应性。 通过特殊定制的FKM系统,研究人员直接测量了营养细胞和异形胞的藻胆素荧光。结果表明,Anabaena 33047 ΔnblA突变株中异形胞的藻胆素荧光与营养细胞接近,但野生型异形胞则远远低于影响细胞。通过FKM荧光动态分析,ΔnblA突变株异形胞的藻胆素荧光是野生型异形胞的大约8倍高。这样高含量的藻胆素,也就表明其可以为固氮过程提供远高于野生型的ATP,显著提高其固氮能力。这一最新研究成果发表于2021年《mBio》。 未来,科学家还会运用FKM多光谱荧光动态显微成像技术在异形胞、微藻细胞分化领域确定什么样的突破呢?请拭目以待。如果您希望了解更多关于FKM多光谱荧光动态显微成像技术的内容,请联系我们。 参考文献:1.Berman-Frank I, et al. 2001. Segregation of Nitrogen Fixation and Oxygenic Photosynthesis in the Marine Cyanobacterium Trichodesmium. Science, 294: 1534-15372.Küpper H, Ferimazova N, Šetlík I, et al. 2004. Traffic Lights in Trichodesmium. Regulation of Photosynthesis for Nitrogen Fixation Studied by Chlorophyll Fluorescence Kinetic Microscopy. Plant Physiology, 135: 2120-21333.Ferimazova N, et al. 2013. Regulation of photosynthesis during heterocyst differentiation in Anabaena sp. strain PCC 7120 investigated in vivo at single-cell level by chlorophyll fluorescence kinetic microscopy. Photosynthesis Research, 116(1): 79-914.Bandyopadhyay A, et al. 2021. Antenna Modification Leads to Enhanced Nitrogenase Activity in a High Light-Tolerant Cyanobacterium. mBio, 12(6): e03408-21 北京易科泰生态技术公司提供藻类培养与表型研究全面技术方案:1.AquaPen、FluorCam藻类叶绿素荧光/多光谱荧光技术2.SL3500、AlgaeTron/FytoScope智能LED光源与生长箱3.SpectraPen/PolyPen、Specim高光谱测量技术4.FKM多光谱荧光动态显微成像系统5.FMT150藻类培养与在线监测系统6.MC1000 8通道藻类培养系统7.ET-PSI多功能藻类培养与在线监测系统8.AlgaTech®高通量藻类表型成像分析平台
确定



还剩3页未读,是否继续阅读?
北京易科泰生态技术有限公司为您提供《蓝藻异形胞中光合作用检测方案(恒温器)》,该方案主要用于其他中植物生理检测,参考标准--,《蓝藻异形胞中光合作用检测方案(恒温器)》用到的仪器有AG 130-ECO藻类生长室、AquaPen手持式藻类荧光测量仪、AlgaTech®高通量藻类表型成像分析平台、FMT150藻类培养与在线监测系统、MC1000 8通道藻类培养与在线监测系统
该厂商其他方案
更多













