方案详情
文
流式样本在进行检测之前,需要对细胞样本进行前处理,传统离心操作对细胞活性、细胞保留率影响较大,实验可重复性难以保证。层流洗涤方法彻底颠覆了传统方法,细胞免受离心带来的机械损伤,细胞活性更高、保留率更高,实验可重复性也更高。
方案详情

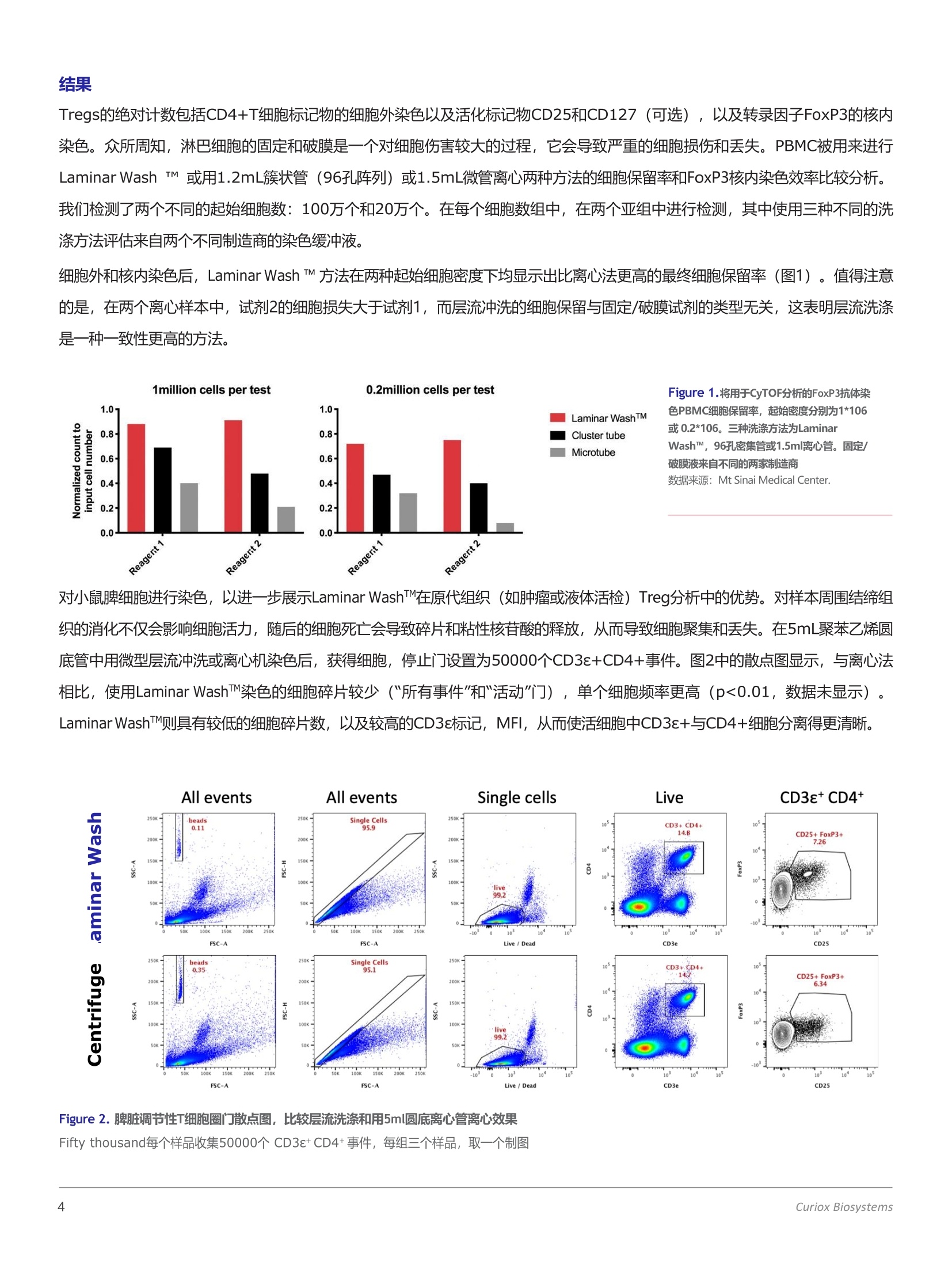
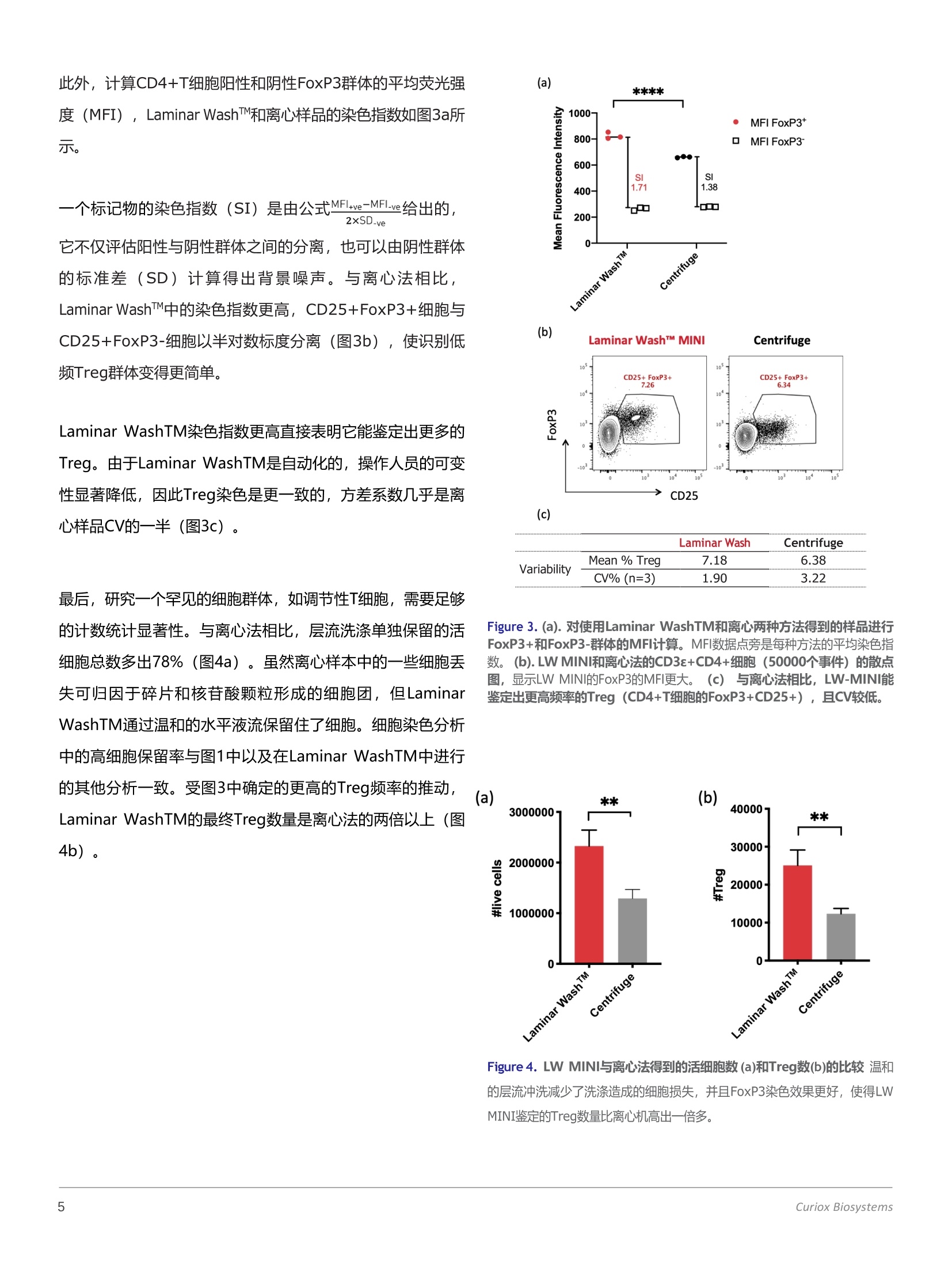
CURIOXBIOLOGY ATITS BEST 使用Laminar WashMINI进行免疫分型和FoxP3核内染色 调节性T细胞在免疫肿瘤学中的意义 调节性T细胞(Treg) 通过抑制对新抗原的反应而成为免疫稳态的重要介质。由于它们参与免疫抑制,肿瘤中Treg的高浸润与预后不良有关。因此, Treg的频率通常作为疫苗或治疗研究成功的指标。近年来,由于Treg中高表达的生物标志物如免疫检查点分子、趋化因子受体和代谢物等, Treg已成为治疗靶点。研究这一稀有细胞群所面临的一大挑战,是伤害性较强的固定和渗透试剂需要进入细胞核才能暴露FoxP3转录因子,但这样便会导致细胞死亡。在这个应用说明中,我们证明了LaminarWash MINI通过温和的自动清洗,去除了操作员的变异性,在FoxP3染色过程中保留了更多的细胞总数。LW-MINI制备的脾细胞在没有离心所产生的机械应力的情况下,表现出较高的FoxP3平均荧光强度(MFI),与非Treg细胞的分离也较好。总的来说,与离心机相比,LW-MINI鉴定出的Treg数量是离心机的两倍多。 LAMINAR WASHTM MINI Laminar Wash TM MINI是一种16喷嘴清洗系统,吏使用层流方法,以5uL/s的速度缓慢地向每个孔中添加80uL的洗涤缓冲液,并抽吸以留下25pL的剩余体积。 Laminar Wash TM与微型系统相对应的板材是一种“无壁”孔板,它的微孔经亲水材料处理,而周围区域涂有疏水膜。每个微孔都有两个微卫星孔,分别用于分配和抽吸喷嘴,这有助于层流清洗,而不会干扰已沉淀的细胞。 在使用离心法的传统流式细胞术方案中,细胞经过多次洗涤循环,然后再悬浮颗粒,这可能会使细胞暴露于机械应力下。离心法费时费力,并且不可避免地会导致操作人员之间的差异。使用Laminar Wash (LW) MINI,细胞在没有额外压力的情况下进行温和的清洗,从而可以更高效地保留细胞以进行收集和细胞分选。此外,细胞表面标记的表达是不变的,而未结合的抗体能被有效地去除,从而产生更可靠和更好的可预处理数据。 层流洗涤TM MINI是一种16喷嘴清洗系统,它使用层流方法,以5pL/s的速度缓慢地向每个井添加80pL的洗涤缓冲液,并抽吸,留下25pL的剩余体积。 试剂: 100 mL 含1%吐温20的70%酒精((用于开关机) 100 mL 含1%吐温20的超纯水(用于开关机) 100mL含1%BSA的FACS缓冲液 配制表面染色抗体混合液: 按下表用FACS稀释抗鼠抗体,具体稀释度以每孔加25ul为准 表1:表面染色抗体 标记物 染料 克隆 制造商 目录编号. 每个样品的体积 (uL) Viability Aqua Invitrogen L34957 0.05 CD3E PerCP- 17A2 eBioscience 46-0032- 0.5 eFluor710 82 CD4 PE GK1.5 eBioscience 12-0041- 0.5 82 CD25 PE-Cy7 PC61.5 eBioscience 25-0251- 0.5 82 配制eBioscience FoxP3/转录因子破膜/固定缓冲液(ThermoFisher): 工作液按将15ul破膜固定母液稀释到45ul破膜/固定稀释液中进行配制,最终每孔需60ul(略高于实际用量)。 配制eBioscience FoxP3/转录因子破膜/固定洗液(ThermoFisher): 工作液按制造商提供的方法稀释十倍,本实验需要不到100ml破膜/固定吸液。 配制核内染色抗体 按下表用1X破膜/固定洗液稀释抗鼠抗体,具体稀释度以每孔加25ul为准 表 2: Intracellular Antibody核内染色抗体 标记物 染料 克隆 制造商 目录编号. 每个样品的体积(uL) FoxP3 BV421 MF-14 Biolegend 126419 1 CountBrightTM 流式专用绝对计数磁珠(ThermoFisher) 灌注LAMINAR WASHTM MINI: 为了启动和维护仪器需要,必须进行灌注程序。灌注程序在每天工作一开始时进行,每个灌注步骤需要大约30毫升的缓冲液,因此需要提前准备足够的缓冲液。 1. 用含1%吐温20的70%酒精执行一次清洗灌注程序 2. 用含1%吐温20的纯水执行一次清洗灌注程序 3. 用所需的洗涤缓冲液执行一次清洗灌注程序 关闭LAMINAR WASHTM MINI: 为了确保正确的维护仪器,必须在每天工作结束后正确关闭仪器。 1. 用含1%吐温20的纯水执行一次清洗灌注程序 2. 用含1%吐温20的70%酒精执行一次清洗灌注程序 3. 用空气执行一次清洗灌注程序,排空仪器内部管路 LAMINAR WASHMINI工作流程 ·向Laminar WashTM MINI16白板的孔中加入 25ul细胞悬液,每孔约2百万细胞 ·小心地从吸液卫星孔吸吸10ul残留液体,振荡孔 板。加入55ul破膜/固定液 ·轻柔混匀5-6次。 室温避光孵育至少40分钟 ·用破膜洗涤缓冲液灌注Laminar WashTM MINI ·将16孔板放入机器中,确保需要清洗的那一排对准置样 。每次洗涤完成后将剩余25ul体积 ·配制核内染色抗体混合液2,每孔需要25ul ·室温避光孵育至少40分钟 ·将16孔板放入机器中,确保需要清洗的那一排对准置样平台的箭头 ·设置循环数为9,初始体积50ul ·开始洗涤1 。每次洗涤完成后将剩余25ul体积 样品已经可以上机读数了 1每个清洗周期向每个孔中分配高达80pl的缓冲液,并吸入55pl,剩余体积为25pl。例如,在初始体积为“50pl”的9次清洗循环中,第一次清洗循环将向孔中添加额外的30pl缓冲液,使体积达到80pl,并吸入55pl,剩余体积为25pl。第二次清洗循环进行到第九次清洗循环,清洗机将 55pl 洗涤缓冲液分配到每孔中,使容量达到80pl,并吸入55pl,留下25pl的残余体积。 结果 Tregs的绝对计数包括CD4+T细胞标记物的细胞外染色以及活化标记物CD25和CD127(可选),以及转录因子FoxP3的核内染色。众所周知,淋巴细胞的固定和破膜是一个对细胞伤害较大的过程,它会导致严重的细胞损伤和丢失。PBMC被用来进行Laminar Wash TM 或用1.2mL簇状管(96孔阵列)或1.5mL微管离心两种方法的细胞保留率和FoxP3核内染色效率比较分析。我们检测了两个不同的起始细胞数:100万个和20万个。在每个细胞数组中,在两个亚组中进行检测,其中使用三种不同的洗涤方法评估来自两个不同制造商的染色缓冲液。 细胞外和核内染色后, Laminar Wash TM 方法在两种起始细胞密度下均显示出比离心法更高的最终细胞保留率(图1)。值得注意的是,在两个离心样本中,试剂2的细胞损失大于试剂1,而层流冲洗的细胞保留与固定/破膜试剂的类型无关,这表明层流洗涤是一种一致性更高的方法。 1million cells per test 0.2million cells per test Figure 1.将用于CyTOF分析的FoxP3抗体染1.0)= 101Laminar WashTM色PBMC细胞保留率,起始密度分别为1*1060.8·或0.2*106。三种洗涤方法为LaminarCluster tubeMicrotubeWashTM, 96孔密集管或1.5ml离心管。固定/0.6-c破膜液来自不同的两家制造商N0.4 数据来源: Mt Sinai Medical Center.nl: c0.2·2-0.0Reagert 1 Reagent 2 Reagert 1 Reagert 2 对小鼠脾细胞进行染色,以进一步展示Laminar WashTM在原代组织(如肿瘤或液体活检) Treg分析中的优势。对样本周围结缔组织的消化不仅会影响细胞活力,随后的细胞死亡会导致碎片和粘性核苷酸的释放,从而导致细胞聚集和丢失。在5mL聚苯乙烯圆底管中用微型层流冲洗或离心机染色后,获得细胞,停止门设置为50000个CD3E+CD4+事件。图2中的散点图显示,与离心法相比,使用Laminar WashTM染色的细胞碎片较少(所有事件"和"活动"门),单个细胞频率更高 (p<0.01,数据未显示)。Laminar WashTM则具有较低的细胞碎片数,以及较高的CD3e标记, MFI, 从而使活细胞中CD3e+与CD4+细胞分离得更清晰。 Figure 2. 脾脏调节性T细胞圈门散点图,比较层流洗涤和用5ml圆底离心管离心效果 Fifty thousand每个样品收集50000个 CD3e+CD4+事件,每组三个样品,取一个制图 此外,计算CD4+T细胞阳性和阴性FoxP3群体的平均荧光强度(MFI), Laminar WashTM和离心样品的染色指数如图3a所 一个标记物的染色指数(SI) 是由公式MF+ve-MFl-ve给出的, 2xSD-ve 它不仅评估阳性与阴性群体之间的分离,也可以由阴性群体的标准差(SD)计算得出背景噪声。与离心法相比,Laminar WashTM中的染色指数更高, CD25+FoxP3+细胞与CD25+FoxP3-细胞以半对数标度分离(图3b),使识别低频Treg群体变得更简单。 Laminar WashTM染色指数更高直接表明它能鉴定出更多的Treg。由于Laminar WashTM是自动化的,操作人员的可变性显著降低,因此Treg染色是更一致的,方差系数几乎是离心样品CV的一半(图3c)。 最后,研究一个罕见的细胞群体,如调节性T细胞,需要足够的计数统计显著性。与离心法相比,层流洗涤单独保留的活细胞总数多出78%(图4a)。虽然离心样本中的一些细胞丢失可归因于碎片和核苷酸颗粒形成的细胞团,但LaminarWashTM通过温和的水平液流保留住了细胞。细胞染色分析中的高细胞保留率与图1中以及在Laminar WashTM中进行 的其他分析一致。受图3中确定的更高的Treg频率的推动,Laminar WashTM的最终Treg数量是离心法的两倍以上(图4b)。 CV% (n=3) 1.90 3.22 Figure 3. (a).对使用Laminar WashTM和离心两种方法得到的样品进行FoxP3+和FoxP3-群体的MFI计算。MFI数据点旁是每种方法的平均染色指数。(b).LWMINI和离心法的CD3s+CD4+细胞(50000个事件)的散点图, 显示LW MINI的FoxP3的MFI更大。。(c)与离心法相比,LW-MINI能鉴定出更高频率的Treg (CD4+T丁胞的FoxP3+CD25+), 且CV较低。 Figure 4. LW MINI与离心法得到的活细胞数(a)和Treg数(b)的比较温和的层流冲洗减少了洗涤造成的细胞损失,并且FoxP3染色效果更好,使得LWMINI鉴定的Treg数量比离心机高出一倍多。 本应用说明中的数据表明,层流冲洗是一种温和的冲洗方法,它不仅保留了更多的总细胞数,而且提高了对具有挑战性的核内标记物(如FoxP3)的染色指数。这使得Treg细胞能更好地从其他CD4+T细胞中分离出来,并增加调节性T细胞的计数。在生物标志物的研究和Tregs治疗效果的准确测定中,鉴定出的Treg数目越多,具有更大的统计学意义。通过层流冲洗系统,细胞不受离心和人为的细胞重悬导致的机械应力,从而保持了更高的生存能力和表位保存。我们还证明了LaminarWash TM实验流程的调整能够处理完整的表面和核内染色过程,提高荧光数据质量,在免疫学研究中具有重要价值。 uriox Biosystems Laminar Wash™ 层流洗涤是Curiox的核心技术,利用创新的样品清洗方法与自动化操作相结合,层流洗涤技术实现了对传统离心洗涤方法的全方位超越。其主要的突出优势有:1 温和洗涤,使细胞免受离心力带来的压力,细胞活性更高;2 保留率高,对稀有细胞和细胞数较少的样本,层流洗涤依然保持高保留率;3 洗涤干净,层流过程持续不断地将碎片杂质带走,洗涤效果更好;4 可重复性高,标准化的洗涤流程取代手动离心操作,结果高度可重复;5 自动化处理,预设标准洗涤流程,轻松设置参数,自动化一键操作;6 生物安全性高,小型化的设计使其可置于生物安全柜中,安全性更高。
确定




还剩4页未读,是否继续阅读?
盛涵生物科技(上海)有限公司为您提供《细胞样品中层流洗涤检测方案(流式/细胞样本前处理)》,该方案主要用于其他中分离纯化检测,参考标准--,《细胞样品中层流洗涤检测方案(流式/细胞样本前处理)》用到的仪器有Curiox 层流洗涤HT2000、Curiox 层流洗涤MINI1000
相关方案
更多











