方案详情
文
针对 HUPO 磷酸肽挑战赛,使用 AgilentAssayMAP Bravo 平台和 LC/Q-TOF 系统进行自动化磷酸肽富集以实现定性和定量分析。
执行 CID 肽鉴定实验,在“磷酸肽”样品中鉴定出 437 种特有肽段,其中包括94 种磷酸肽。鉴定出 HUPO 序列表中的所有 89 种非磷酸肽。ECD 实验基于 89个非磷酸肽序列确定了 96 种磷酸肽的磷酸化位点。还将序列表中未列出的其余肽返回给 HUPO。
在富集的“磷酸肽-酵母”样品中,鉴定出 287 中特有肽段,其中包括 264 种特有磷酸肽。富集的总体选择性约为 92.0%。此外,从富集的“磷酸肽-酵母”样品中仍鉴定出加入酵母中 96 种磷酸肽中的95 种。与开展本研究中的其他实验室相比,安捷伦从富集样品中回收的磷酸肽数量最多。
方案详情

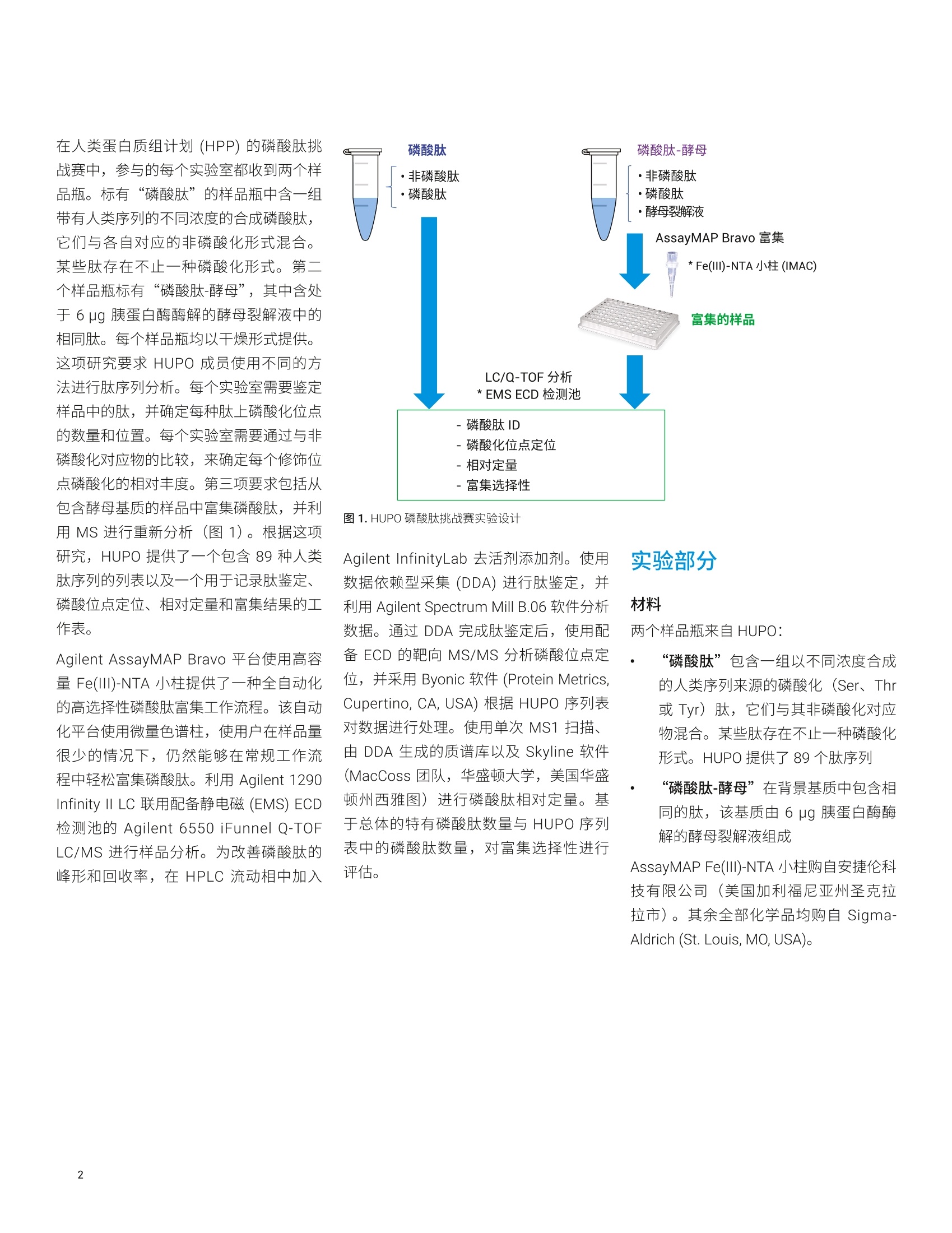
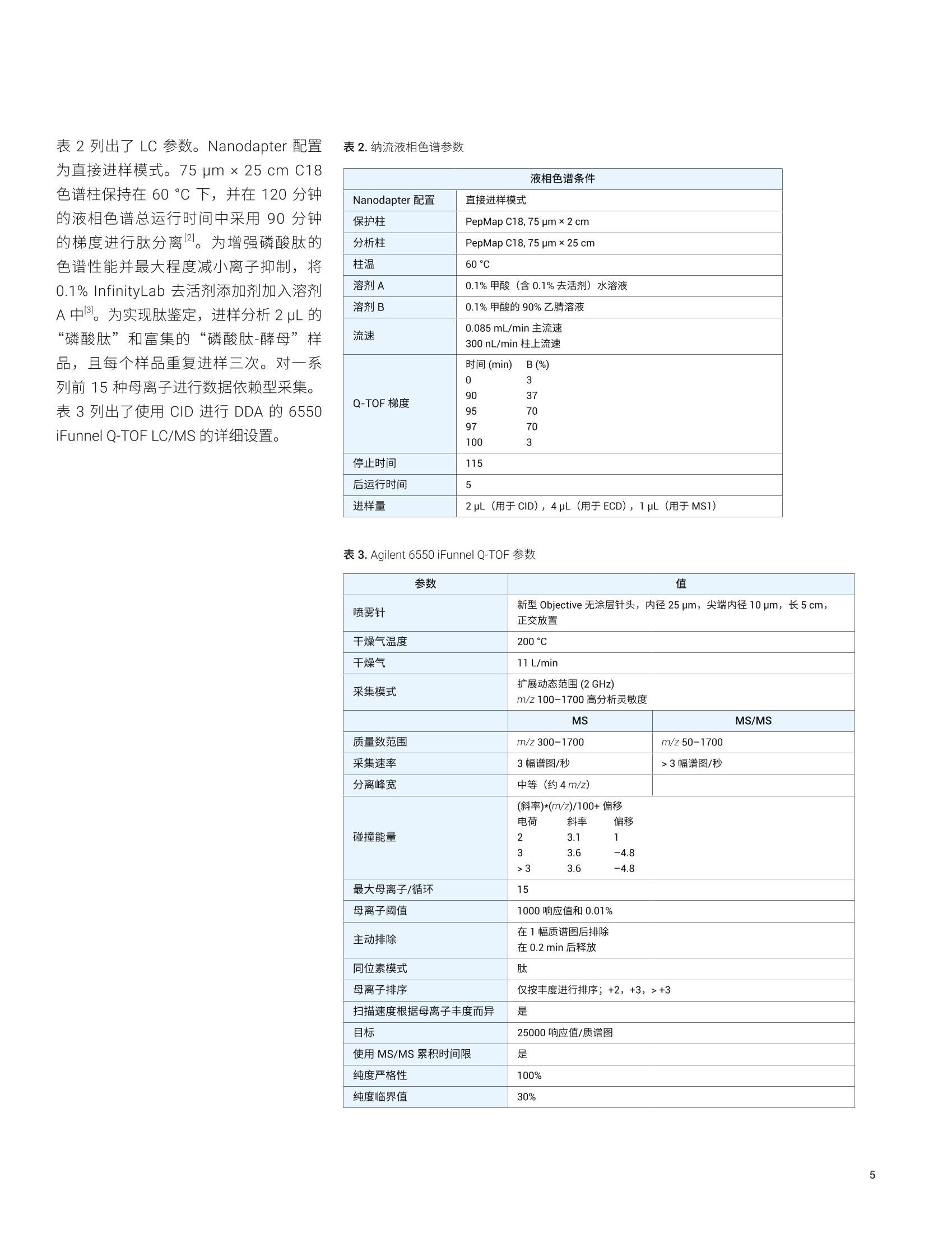
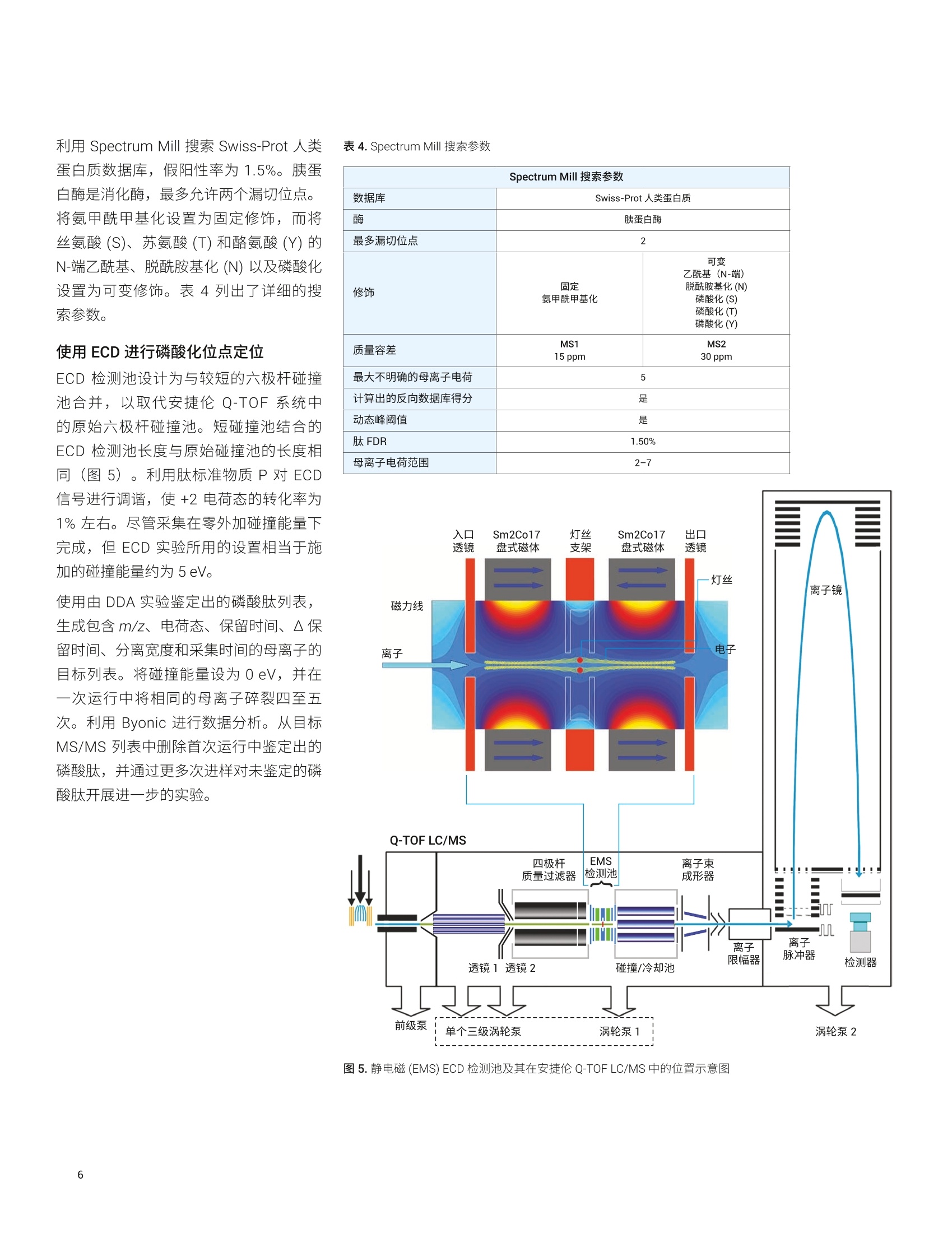
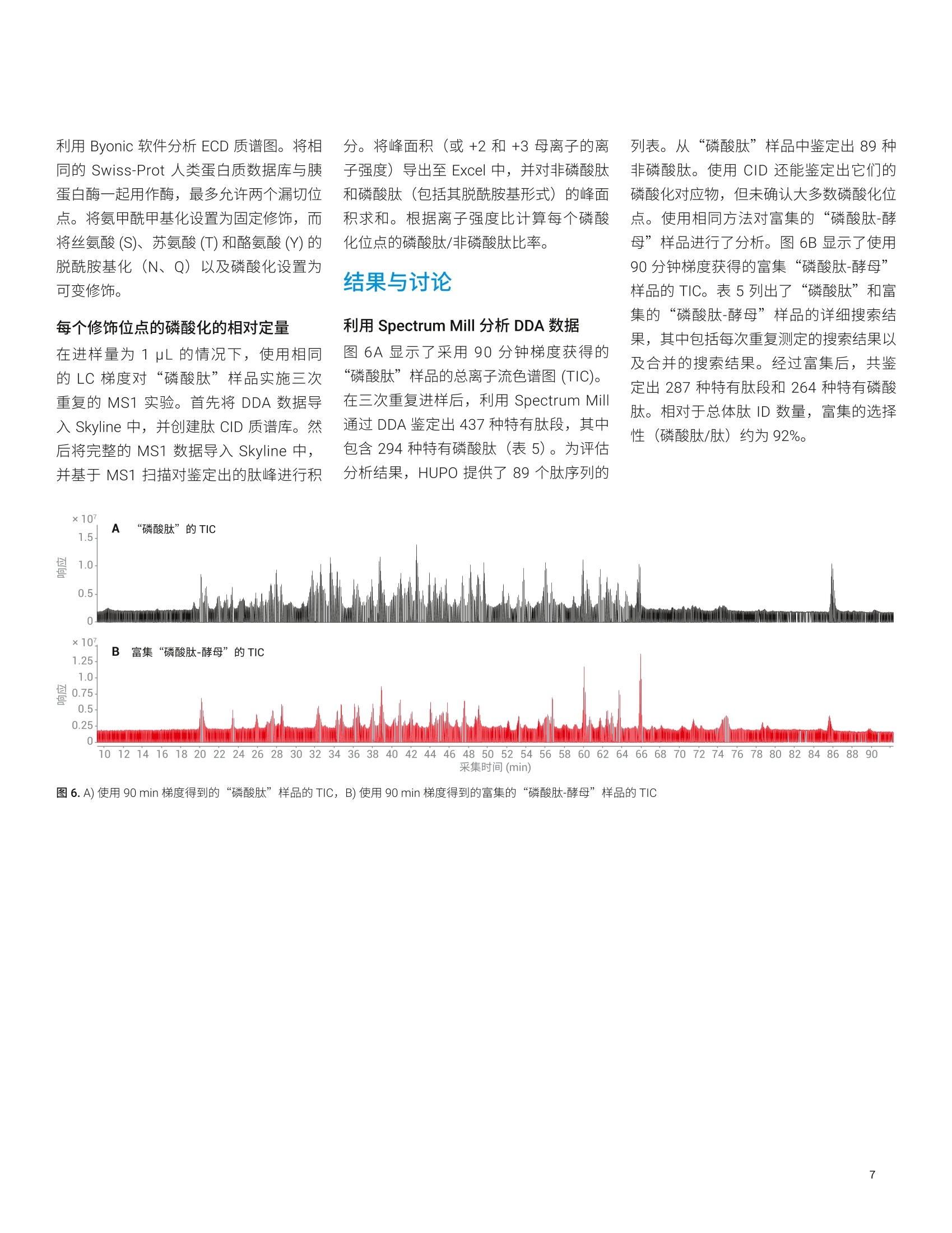
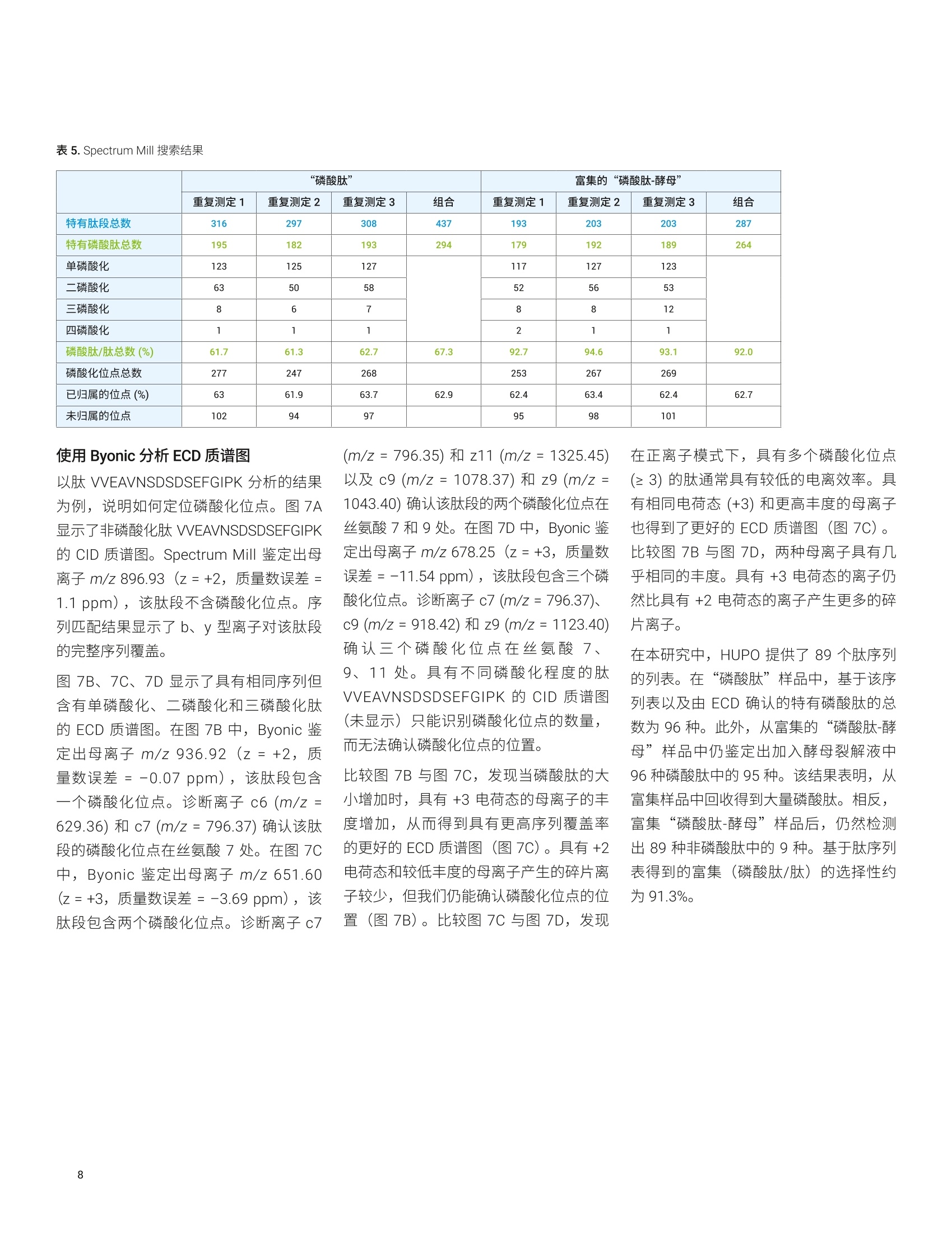
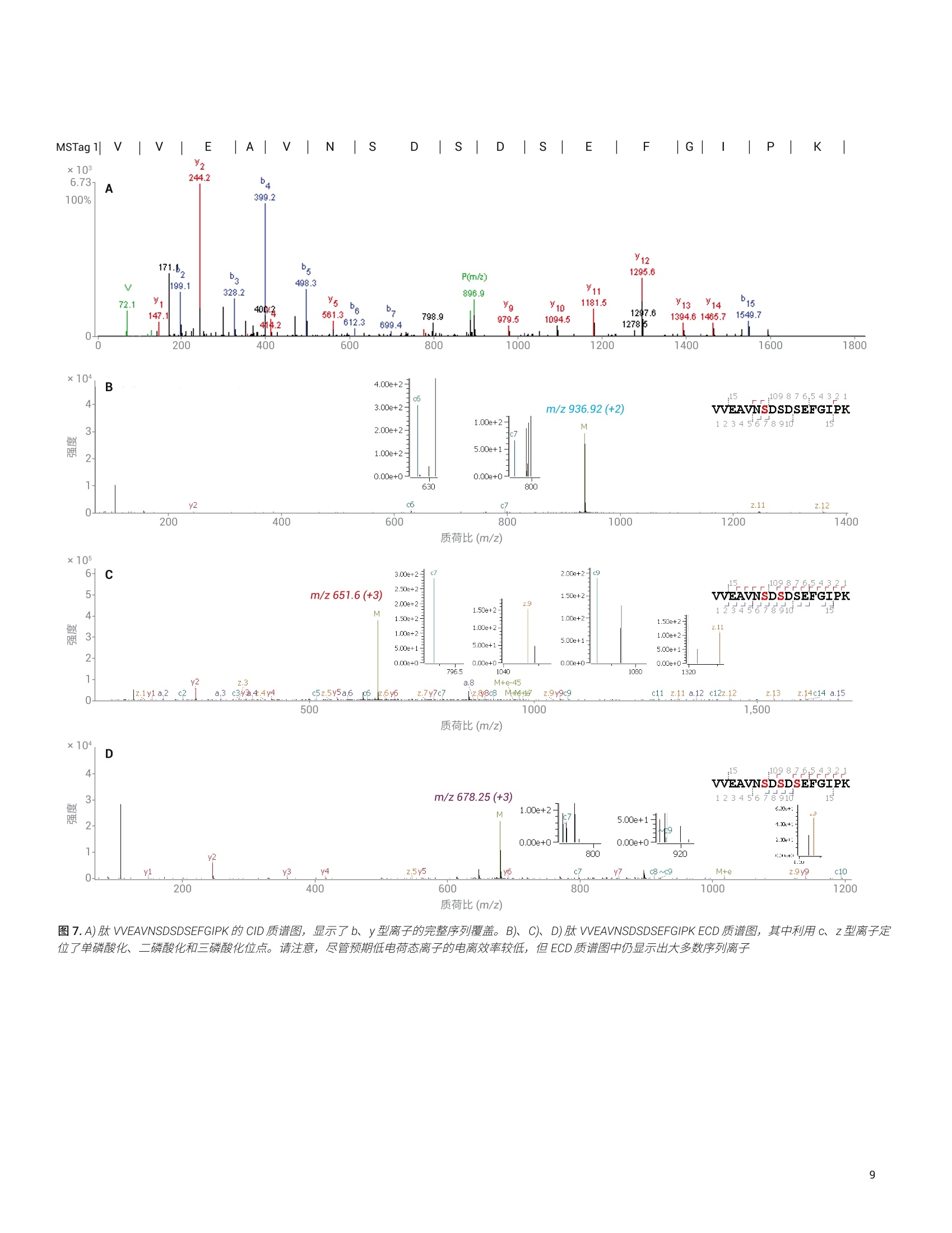
Shuai Wu, Kenneth Newton, ( L i nfeng Wu, Jordy J. Hsiao ) ( 安捷伦科技有限公司, ) ( 美国加利福尼亚州圣克拉拉市 ) 一种用于磷酸肽鉴定和磷酸化位点定位的新型自动化、高选择性磷酸肽富集方法 由于手动样品前处理的重现性和选择性容易变化,因此磷酸肽富集是 LC/MS分析中最具挑战性的样品前处理步骤之一。多种因素导致磷酸肽样品的 LC/MS 分析可能具有挑战性,其中包括: HPLC 系统表面或溶剂中的金属离子可能形成磷酸肽-金属离子络合物,这将严重抑制磷酸肽峰。这种效应会严重影响磷酸肽鉴定,尤其是多磷酸化肽的鉴定 磷酸肽的电离效率是另一个经常论及的问题。在与非磷酸化肽的复杂混合物中,磷酸肽的电离效率要低得多 磷酰基基团是不稳定的翻译后修饰(PTM), 在使用 CID 进行碎裂时通常以磷酸形式被消除。这种磷酸中性丢失通常是主要的碎裂模式,导致肽主链碎裂中缺少位点特异性信息,使得磷酸肽中的磷酸化位点难以定位 在人类蛋白质组计划(HPP)的磷酸肽挑战赛中,参与的每个实验室都收到两个样品瓶。标有“磷酸肽”的样品瓶中含一组带有人类序列的不同浓度的合成磷酸肽,它们与各自对应的非磷酸化形式混合。某些肽存在不止一种磷酸化形式。第二个样品瓶标有“磷酸肽-酵母”,其中含处于6 pg胰蛋白酶酶解的酵母裂解液中的相同肽。每个样品瓶均以干燥形式提供。这项研究要求 HUPO 成员使用不同的方法进行肽序列分析。每个实验室需要鉴定样品中的肽,并确定每种肽上磷酸化位点的数量和位置。每个实验室需要通过与非磷酸化对应物的比较,来确定每个修饰位点磷酸化的相对丰度。第三项要求包括从包含酵母基质的样品中富集磷酸肽,并利用 MS 进行重新分析(图1)。根据这项研究, HUPO 提供了一个包含89种人类肽序列的列表以及一个用于记录肽鉴定、磷酸位点定位、相对定量和富集结果的工作表。 Agilent AssayMAP Bravo 平台使用高容量 Fe(ⅢII)-NTA 小柱提供了一种全自动化的高选择性磷酸肽富集工作流程。该自动化平台使用微量色谱柱,使用户在样品量很少的情况下,仍然能够在常规工作流程中轻松富集磷酸肽。利用 Agilent 1290Infinity II LC 联用配备静电磁 (EMS) ECD检测池的 Agilent 6550 iFunnel Q-TOFLC/MS 进行样品分析。为改善磷酸肽的峰形和回收率,在 HPLC 流动相中加入 图 1.HUPO 磷酸肽挑战赛实验设计 材料 两个样品瓶来自HUPO: “磷酸肽”包含一组以不同浓度合成的人类序列来源的磷酸化 (Ser、Thr或 Tyr) 肽,它们与其非磷酸化对应物混合。某些肽存在不止一种磷酸化形式。HUPO提供了89个肽序列 “磷酸肽-酵母”在背景基质中包含相同的肽,该基质由6 ug 胰蛋白酶酶解的酵母裂解液组成 AssayMAP Fe(III)-NTA 小柱购自安捷伦科技有限公司(美国加利福尼亚州圣克拉拉市)。其余全部化学品均购自 Sigma-Aldrich (St. Louis, MO,USA). 使用 AssayMAP Bravo 进行磷酸肽富集和净化 将“磷酸肽-酵母”样品瓶复溶于 100 uL80% ACN (含0.1%TFA))中。将样品超声处理2分钟,然后转移至96孔 PCR板的位置A1。 利用 Agilent AssayMAP 磷酸肽富集2.0版应用程序,通过 Fe(III)-NTA 小柱进行自动化磷酸肽富集。图2显示了用户界面和应用程序设置。将一根 Fe(III)-NTA小柱预转移至A1的台板位置2。根据实验室器皿表选择实验室器皿,不同的是在台板位置4和9处使用 LoBind 96 Eppendorf板。在 300 pL/min 的高流速下,用100 pL 50% 的 ACN (含 0.1%TFA) 灌注小柱。随后,使用含0.1% TFA 的80%ACN (与结合缓冲液的溶剂相同)对小柱进行平衡(表1)。将样品加载到小柱上是至关重要的一步。根据我们之前的研究,将流速设置为3.0uL/min,以便提供足够长的时间高效结合磷酸肽。上样后,采用包含0.1% TFA 的 80%ACN对内部小柱进行洗脱。用20 pL 1%氢氧化铵(pH约11)将富集的磷酸肽直接洗脱到包含80 uL 2.5% 甲酸的 LoBind PCR 板中(表1和图2)。 图2.AssayMAP Bravo 磷酸肽富集2.0版应用程序 Deck Layout 1. Wash Station 2. Cartridges 3. 0rganic Waste 4. Sample 5. Priming & 6. Elution Buffer Syringe Wash Buffer 7.Flow Through 8. Equilibration &9. Eluate Collection Cartridge Wash Collection Buffer Labware Table Deck Location Labware Type 1 96AM Wash Station 2 96AM Cartridge & Tip Seating Station 3 12 Column, Low Profle Reservoir, Natural PP 4 96 Eppendorf 30129300, PCR, Ful Skirt, PolyPro 5 96 Greiner 650201_U-Bottom, Clear PolyPro 6 96 Greiner 650201_U-Bottom, Clear PolyPro 7 96 Eppendorf 30129300, PCR, Ful Skirt, PolyPro 8 96 Greiner 650201_U-Bottom, Clear PolyPro 9 96 Eppendorf 30129300, PCR, Ful Skirt, PolyPro 表1.使用AssayMAP Bravo 的磷酸肽富集和净化方案 磷酸肽富集 肽段净化 Affinity 基质 IMAC 反相 树脂体积 5pL 5 pL 担体 Fe(III)-NTA, 100 nmol Fe(IIl) C18 灌注缓冲液 50%ACN (含0.1%TFA) 水溶液 50%ACN (含0.1%TFA)水溶液 平衡缓冲液 80%ACN (含0.1%TFA) 水溶液 0.1%TFA 水溶液 上样缓冲液 80%ACN (含0.1%TFA) 水溶液 甲酸铵水溶液 上样体积 100 pL 100 pL 上样流速 3pL/min 3 pL/min 清洗缓冲液1 80%ACN (含0.1%TFA) 水溶液 0.1%TFA 水溶液 清洗体积1 50 pL 50 pL 清洗次数1 1 1 洗脱缓冲液1 1%氢氧化铵 70% ACN (含0.1%TFA)水溶液 洗脱体积 1 20 pL 20 pL 现有采集体积 80 pL OpL 利用 Agilent AssayMAP 肽净化2.0版应用程序对C18小柱富集的磷酸肽进行脱盐(图3)。将一根C18小柱预转移至A1的台板位置2。根据实验室器皿表选择实验室器皿,不同的是在台板位置9处使用 LoBind 96 Eppendorf 板。将富集的磷酸肽板设置在台板位置4处。用100 pL50% ACN(含0.1%TFA)的水溶液灌注 C18小柱,用 50 pL 0.1% TFA进行平衡,在3 uL/min 的流速下加载富集的磷酸肽样品,用 50 uL 0.1% TFA 进行清洗,然后在 5 pL/min 的流速下用20 pL 70% ACN (含0.1%TFA) 进行洗脱。将样品置于SpeedVac 真空浓缩仪(赛默飞世尔科技有限公司,美国马萨诸塞州沃尔瑟姆)中在室温下干燥,复溶于25 uL的10%ACN(含0.1%FA)中,并超声处理2分钟。用25 uL 0.1% FA 水溶液进一步稀释样品,使最终样品处于 50 uL 5%ACN (含0.1% FA) 中。 使用数据依赖型采集进行肽鉴定将“磷酸肽”样品复溶于 25pL 10% ACN(含0.1% FA))中。将样品瓶涡旋混合,并超声处理2分钟。用 25 pL 0.1%FA进一步稀释样品,使最终样品处于50pL5% ACN (含0.1%FA)中。通过与 Agilent Infinity UHPLC Nanodapter联用, 将 1290 Infinity ⅡI液相色谱系统转换为纳流液相色谱系统。将该纳流液相色谱系统连接至安捷伦纳流喷雾 ESI 离子源, 并与 Agilent 6550 iFunnel Q-TOFLC/MS联用进行肽鉴定(图4)。 图3.Agilent AssayMAP Bravo肽净化2.0版应用程序 表2列出了LC 参数。Nanodapter 配置为直接进样模式。75 um x 25 cm C18色谱柱保持在60°℃下,并在120分钟的液相色谱总运行时间中采用90分钟的梯度进行肽分离2。为增强磷酸肽的色谱性能并最大程度减小离子抑制,将0.1%InfinityLab 去活剂添加剂加入溶剂A中3。为实现肽鉴定,进样分析2pL的“磷酸肽”和富集的“磷酸肽-酵母”样品,且每个样品重复进样三次。对一系列前15种母离子进行数据依赖型采集。表3列出了使用 CID 进行 DDA 的6550 表2.纳流液相色谱参数 iFunnel Q-TOF LC/MS 的详细设置。 液相色谱条件 Nanodapter 配置 直接进样模式 保护柱 PepMap C18,75 pm×2 cm 分析柱 PepMap C18,75 pm×25 cm 柱温 60°℃ 溶剂A 0.1%甲酸(含0.1%去活剂)水溶液 溶剂B 0.1%甲酸的90%乙青溶液 流速 0.085 mL/min 主流速 300 nL/min 柱上流速 Q-TOF梯度 时间(min) B(%) 0 3 90 3795 7097 70 100 3 停止时间 115 后运行时间 5 进样量 2 pL (用于 CID), 4pL (用于ECD),1pL(用于MS1) 表 3. Agilent 6550 iFunnel Q-TOF 参数 参数 值 喷雾针 新型 Objective 无涂层针头,内径25pm, 尖端内径10 pm, 长5 cm,正交放置 干燥气温度 200°C 干燥气 11 L/min 采集模式 扩展动态范围(2 GHz) m/z 100-1700 高分析灵敏度 MS MS/MS 质量数范围 m/z 300-1700 m/z50-1700 采集速率 3幅谱图/秒 >3幅谱图/秒 分离峰宽 中等(约4m/z) 碰撞能量 (斜率)*(m/z)/100+偏移 电荷 斜率 偏移 2 3.1 1 3 3.6 -4.8 >3 3.6 -4.8 最大母离子/循环 15 母离子阈值 1000响应值和0.01% 主动排除 在1幅质谱图后排除 在0.2 min 后释放 同位素模式 肽 母离子排序 仅按丰度进行排序;+2,+3,>+3 扫描速度根据母离子丰度而异 是 目标 25000响应值/质谱图 使用 MS/MS 累积时间限 是 纯度严格性 100% 纯度临界值 30% 利用 Spectrum Mill 搜索 Swiss-Prot人类蛋白质数据库,假阳性率为1.5%。胰蛋白酶是消化酶,最多允许两个漏切位点。将氨甲酰甲基化设置为固定修饰,而将丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)的N-端乙酰基、脱酰胺基化(N)以及磷酸化设置为可变修饰。表4列出了详细的搜索参数。 使用 ECD 进行磷酸化位点定位 ECD 检测池设计为与较短的六极杆碰撞池合并,以取代安捷伦 Q-TOF 系统中的原始六极杆碰撞池。短碰撞池结合的ECD 检测池长度与原始碰撞池的长度相同(图5)。利用肽标准物质P 对ECD信号进行调谐,使+2电荷态的转化率为1%左右。尽管采集在零外加碰撞能量下完成,但ECD 实验所用的设置相当于施加的碰撞能量约为5eV。 使用由 DDA 实验鉴定出的磷酸肽列表,生成包含m/z、电荷态、保留时间、△保留时间、分离宽度和采集时间的母离子的目标列表。将碰撞能量设为OeV, 并在一次运行中将相同的母离子碎裂四至五次。利用 Byonic 进行数据分析。从目标MS/MS列表中删除首次运行中鉴定出的磷酸肽,并通过更多次进样对未鉴定的磷酸肽开展进一步的实验。 Spectrum Mill 搜索参数 数据库 Swiss-Prot 人类蛋白质 酶 胰蛋白酶 最多漏切位点 2 修饰 固定氨甲酰甲基化 可变 乙酰基(N-端)脱酰胺基化(N) 磷酸化(S) 磷酸化(T)磷酸化(Y) 质量容差 MS115 ppm MS2 30 ppm 最大不明确的母离子电荷 5 计算出的反向数据库得分 是 动态峰阈值 是 肽FDR 1.50% 母离子电荷范围 2-7 图5.静电磁(EMS) ECD 检测池及其在安捷伦 Q-TOF LC/MS中的位置示意图 利用 Byonic 软件分析 ECD 质谱图。将相同的 Swiss-Prot 人类蛋白质数据库与胰蛋白酶一起用作酶,最多允许两个漏切位点。将氨甲酰甲基化设置为固定修饰,而将丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)的脱酰胺基化(N、Q)以及磷酸化设置为可变修饰。 每个修饰位点的磷酸化的相对定量 在进样量为1pL的情况下,使用相同的LC梯度对“磷酸肽”样品实施三次重复的 MS1 实验。首先将 DDA 数据导入 Skyline 中,并创建肽 CID 质谱库。然后将完整的 MS1 数据导入 Skyline 中,并基于 MS1扫描对鉴定出的肽峰进行积 分。将峰面积(或+2和+3母离子的离子强度)导出至 Excel中,并对非磷酸肽和磷酸肽(包括其脱酰胺基形式)的峰面积求和。根据离子强度比计算每个磷酸化位点的磷酸肽/非磷酸肽比率。 利用 Spectrum Mill 分析 DDA数据 图6A 显示了采用90分钟梯度获得的 “磷酸肽”样品的总离子流色谱图 (TIC)。在三次重复进样后,利用Spectrum Mill通过 DDA 鉴定出437种特有肽段,其中包含294种特有磷酸肽(表5)。为评估分析结果, HUPO 提供了89个肽序列的 列表。从人“磷酸肽”样品中鉴定出89种非磷酸肽。使用 CID 还能鉴定出它们的磷酸化对应物,但未确认大多数磷酸化位点。使用相同方法对富集的“磷酸肽-酵母”样品进行了分析。图6B显示了使用90分钟梯度获得的富集“磷酸肽-酵母”样品的 TIC。表5列出了“磷酸肽”和富集的“磷酸肽-酵母”样品的详细搜索结果, 其中包括每次重复测定的搜索结果以及合并的搜索结果。经过富集后,共鉴定出287种特有肽段和264种特有磷酸肽。相对于总体肽ID数量,富集的选择性(磷酸肽/肽)约为92%。 采集时间 (min) 图6.A)使用 90 min 梯度得到的“磷酸肽”样品的 TIC, B)使用 90 min 梯度得到的富集的“磷酸肽-酵母”样品的 TIC “磷酸肽” 富集的“磷酸肽-酵母” 重复测定1 重复测定2 重复测定3 组合 重复测定1 重复测定2 重复测定3 组合 特有肽段总数 316 297 308 437 193 203 203 287 特有磷酸肽总数 195 182 193 294 179 192 189 264 单磷酸化 123 125 127 117 127 123 二磷酸化 63 50 58 52 56 53 三磷酸化 8 6 7 8 8 12 四磷酸化 1 1 1 2 1 1 磷酸肽/肽总数(%) 61.7 61.3 62.7 67.3 92.7 94.6 93.1 92.0 磷酸化位点总数 277 247 268 253 267 269 已归属的位点(%) 63 61.9 63.7 62.9 62.4 63.4 62.4 62.7 未归属的位点 102 94 97 95 98 101 使用 Byonic 分析 ECD质谱图 以肽 VVEAVNSDSDSEFGIPK 分析的结果为例,说明如何定位磷酸化位点。图7A显示了非磷酸化肽 VVEAVNSDSDSEFGIPK的 CID质谱图。 Spectrum Mill 鉴定出母离子m/z 896.93(Z=+2,质量数误差=1.1 ppm),该肽段不含磷酸化位点。序列匹配结果显示了b、y型离子对该肽段的完整序列覆盖。 图 7B、7C、7D 显示了具有相同序列但含有单磷酸化、二磷酸化和三磷酸化肽的 ECD质谱图。在图 7B 中, Byonic 鉴定出母离子 m/z 936.92(z=+2,质量数误差=-0.07 ppm),该肽段包含一个磷酸化位点。诊断离子 c6 (m/z=629.36) 和 c7 (m/z = 796.37)确认该肽段的磷酸化位点在丝氨酸7处。在图7C中, Byonic 鉴定出母离子 m/z 651.60(z=+3,质量数误差=-3.69 ppm),该肽段包含两个磷酸化位点。诊断离子c7 (m/z=796.35) 和 z11 (m/z=1325.45)以及c9 (m/z=1078.37)和 z9 (m/z=1043.40)确认该肽段的两个磷酸化位点在丝氨酸7和9处。在图7D中, Byonic 鉴定出母离子 m/z 678.25(z=+3,质量数误差=-11.54 ppm), 该肽段包含三个磷酸化位点。诊断离子 c7 (m/z=796.37)、c9 (m/z=918.42) 和 z9 (m/z = 1123.40)确认三个磷酸化位点在丝氨酸7、9、11处。具有不同磷酸化程度的肽VVEAVNSDSDSEFGIPK 的 CID 质谱图(未显示)只能识别磷酸化位点的数量,而无法确认磷酸化位点的位置。 比较图7B与图7C, 发现当磷酸肽的大小增加时,具有+3电荷态的母离子的丰度增加,从而得到具有更高序列覆盖率的更好的 ECD质谱图(图7C)。具有+2电荷态和较低丰度的母离子产生的碎片离子较少,但我们仍能确认磷酸化位点的位置(图7B)。比较图7C与图7D, 发现 在正离子模式下,具有多个磷酸化位点(≥3)的肽通常具有较低的电离效率。具有相同电荷态(+3)和更高丰度的母离子也得到了更好的 ECD 质谱图(图7C)。比较图7B与图7D,两种母离子具有几乎相同的丰度。具有+3电荷态的离子仍然比具有+2电荷态的离子产生更多的碎片离子。 在本研究中, HUPO 提供了89个肽序列的列表。在“磷酸肽”样品中,基于该序列表以及由 ECD 确认的特有磷酸肽的总数为96种。此外,从富集的“磷酸肽-酵母”样品中仍鉴定出加入酵母裂解液中96种磷酸肽中的95种。该结果表明,从富集样品中回收得到大量磷酸肽。相反,富集 “磷酸肽-酵母”样品后,仍然检测出89种非磷酸肽中的9种。基于肽序列表得到的富集(磷酸肽/肽)的选择性约为91.3%。 V13 1 P K D s| D s | E F ¥14 1600 ×104 B- 4.00e+2- c6 10987654321 4 3.00e+2-7 m/z 936.92 (+2) VVEAVNSDSDSEFGIPK 1.00e+2- 3- 2.00e+2- M 12345678910 15 c7 5.00e+1- 5.00e+1 1.00+: 0.00e+0 0.00e+0 2.30-1: z.5y5 18~c9 z.9y9 200 400 600 800 1000 1200 质荷比(m/z) 图7.A)肽 VVEAVNSDSDSEFGIPK 的 CID 质谱图,显示了b、y型离子的完整序列覆盖。B)、C)、D)肽 VVEAVNSDSDSEFGIPK ECD 质谱图,其中利用c、z型离子定位了单磷酸化、二磷酸化和三磷酸化位点。请注意,尽管预期低电荷态离子的电离效率较低,但ECD质谱图中仍显示出大多数序列离子 肽磷酸化的相对定量 图8显示了具有不同磷酸化程度的肽VVEAVNSDSDSEFGIPK 的提取离子色谱图(EIC)。使用 C18色谱柱和90分钟梯度,所有肽均得到充分分离。对于二磷酸肽和三磷酸肽,将脱酰胺化磷酸肽的离子强度与原始磷酸肽的离子强度加和。基于离子强度计算磷酸肽/非磷酸肽的相对丰度。对于肽 VVEAVNSDSDSEFGIPK,如果非磷酸肽的丰度为1.00,则单磷酸肽、二磷酸肽和三磷酸肽的比率分别为0.03、4.71和0.02,如图8所标注。基于磷酸肽/非磷酸肽的比率,计算“磷酸肽”样品中所有96种磷酸肽的每个修饰位点的磷酸化相对丰度。注意,这一相对定量未考虑到不同肽种类的不同电离效率。它仅仅比较了不同肽的离子强度。 针对 HUPO 磷酸肽挑战赛,使用 AgilentAssayMAP Bravo 平台和 LC/Q-TOF 系统进行自动化磷酸肽富集以实现定性和定量分析。 执行 CID 肽鉴定实验,在“磷酸肽”样品中鉴定出437种特有肽段,其中包括294种磷酸肽。鉴定出 HUPO序列表中的所有89种非磷酸肽。 ECD 实验基于89个非磷酸肽序列确定了96种磷酸肽的磷酸化位点。还将序列表中未列出的其余肽返回给 HUPO。 在富集的“磷酸肽-酵母”样品中,鉴定 出287中特有肽段,其中包括264种特有 磷酸肽。富集的总体选择性约为92.0%。 此外,从富集的“磷酸肽-酵母”样品中仍鉴定出加入酵母中96种磷酸肽中的95种。与开展本研究中的其他实验室相比,安捷伦从富集样品中回收的磷酸肽数量最多。 Russell, J. D.; Murphy, S. Agilent ( AssayMAP Bravo TechnologyEnables Reproducible AutomatedPhosphopeptide Enrichment fromComplex Mixtures Using High-Capacity Fe (ⅢII)-NTA Cartridges (Agilent AssayMAP Bravo 技术采用高容量 Fe (ⅢII)-NTA 小柱实现复杂混合物中可重现的自动化磷酸肽富 集),安捷伦科技公司应用简报,出版号5991-6073EN, 2 016 ) ( 2. Wu, S.; Wu, L. Human Breast CancerCell Line Phosphoproteome Revealedby an Automated and Highly Selective Enrichment Workflow (利用自动化、高选择性富集工作流程揭示人乳腺癌细胞系磷酸化蛋白质组),安捷伦科技公司应用简报,出版号5994-0315EN,2018 ) ( Hsiao, J. J. et al., ImprovedLC/MS Methods for the Analysisof Metal-Sensitive Analytes U sing Medronic Acid a s a Mobile Phase Additive. Anal. Chem. 2018,90(15), 9457-9464 ) VVEAVNSDSDSEFGIPK 图8.所有 VEVEAVNSDSDSEFGIPK 肽的 EIC, 其中标注出磷酸肽/非磷酸肽的比率 查找当地的安捷伦客户中心: www.agilent.com www.agilent.com/chem/contactus-cn 免费专线: 仅限研究使用。不可用于诊断目的。 800-820-3278,400-820-3278(手机用户) 本文中的信息、说明和指标如有变更,恕不另行通知。 联系我们: LSCA-China_800@agilent.com @安捷伦科技(中国)有限公司,2019 在线询价: ( 2019年8月26日, 中国出版 ) 5994-1235ZHCN www.agilent.com/chem/erfq-cn 针对 HUPO 磷酸肽挑战赛,使用 AgilentAssayMAP Bravo 平台和 LC/Q-TOF 系统进行自动化磷酸肽富集以实现定性和定量分析。执行 CID 肽鉴定实验,在“磷酸肽”样品中鉴定出 437 种特有肽段,其中包括94 种磷酸肽。鉴定出 HUPO 序列表中的所有 89 种非磷酸肽。ECD 实验基于 89个非磷酸肽序列确定了 96 种磷酸肽的磷酸化位点。还将序列表中未列出的其余肽返回给 HUPO。在富集的“磷酸肽-酵母”样品中,鉴定出 287 中特有肽段,其中包括 264 种特有磷酸肽。富集的总体选择性约为 92.0%。此外,从富集的“磷酸肽-酵母”样品中仍鉴定出加入酵母中 96 种磷酸肽中的95 种。与开展本研究中的其他实验室相比,安捷伦从富集样品中回收的磷酸肽数量最多。
确定




还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《“磷酸肽”样品中肽段检测方案(移液工作站)》,该方案主要用于生物药品药物研发中含量测定检测,参考标准--,《“磷酸肽”样品中肽段检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 6550A iFunnel Q-TOF 液质联用系统、Agilent 1290 Infinity II 液相色谱系统
相关方案
更多
该厂商其他方案
更多