方案详情
文
本应用简报介绍了使用 AgilentxCELLigence 仪器,评估 Vero E6 细胞和HEK 293 细胞由水泡性口炎病毒 (VSV)介导的细胞病变实验。该方案能够鉴定细胞增殖动力学,以及不同细胞接种密度下病毒感染的最佳时间点。该实验克服了单点空斑实验的诸多局限,并为 RTCA 能够实现全面且可靠的病毒细胞致病性评估提供了直接的证据。
方案详情

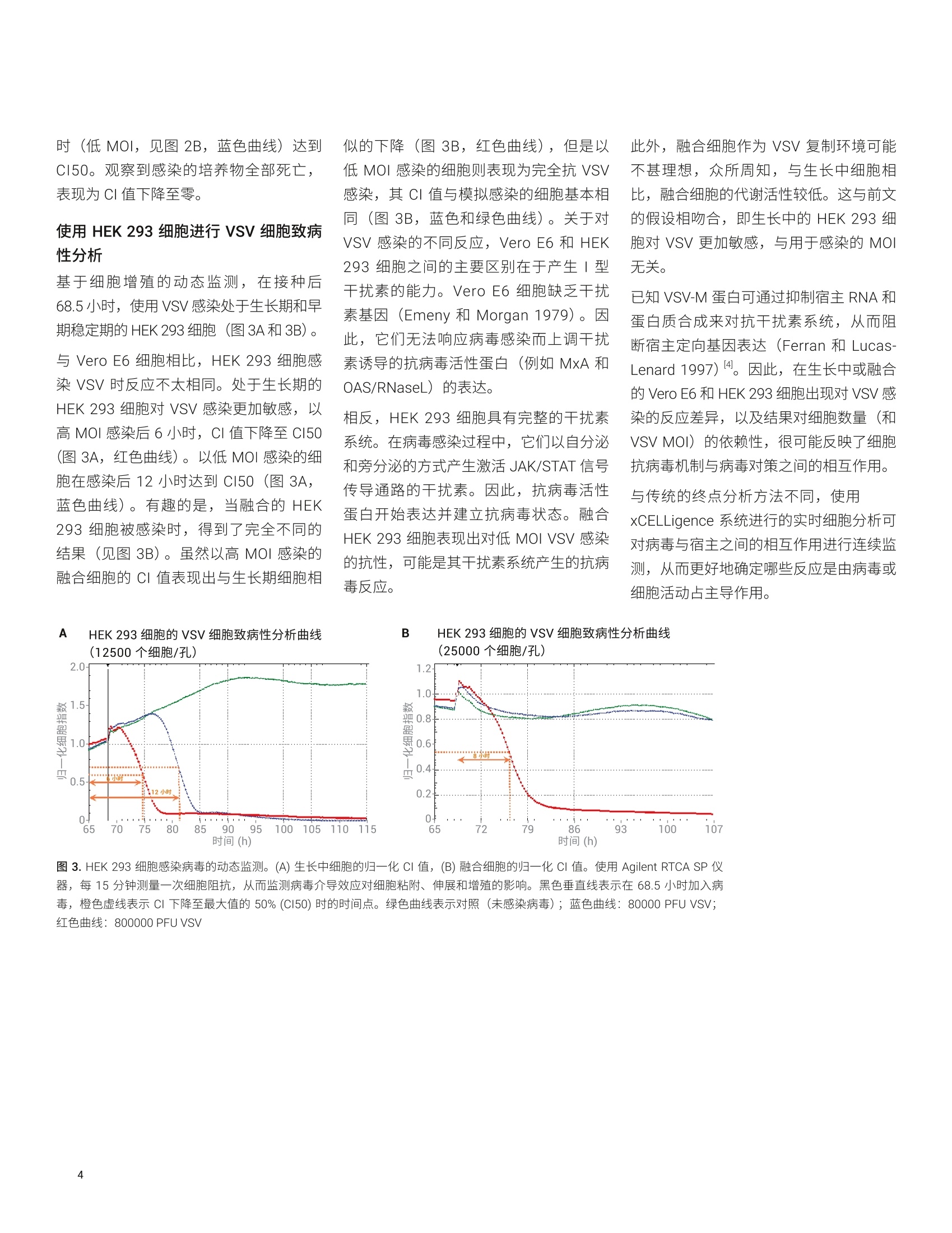
应用简报 Agilent细胞分析Trusted Answers Agilent xCELLigence 实时细胞分析检测病毒介导的细胞致病性的新方法 作者 前言 安捷伦科技有限公司 病毒研究最重要的步骤之一是测量病毒介导的细胞病变效应 (CPE)。空斑实验可直接读出样品中感染性病毒颗粒的数量/浓度,因此一直是定量分析 CPE 的金标准。在该项技术中,使用不同稀释倍数的病毒感染融合单层宿主细胞,然后使用半固体材料(例如稀琼脂糖凝胶)将其覆盖。当受感染细胞裂解时,覆盖材料可防止释放的病毒颗粒扩散通过培养基并感染远端位点。但是,子代病毒颗粒可以进入邻近细胞。通过这种方式,随后的几轮感染和裂解只能在二维平面上横向伸展,在原本融合的成片细胞中央产生透明的无细胞的空斑。根据不同的宿主细胞类型和病毒,空斑的准确识别与计数可能需要使用结晶紫等染料对细胞进行染色。 利用病毒的连续稀释,可实现极低的感染复数(MOI)。在这种情况下,每个细胞只会被一个病毒颗粒感染。通过孔内空斑数量以及制备病毒接种液的稀释倍数,可计算得出初始样品中病毒的浓度(滴度)。滴度通常表示为单位体积内空斑形成单位(PFUs)数量。 取决于所研究的病毒和宿主细胞,病毒空斑可以在任意位置形成,并且需要几天到几周的时间才能被检测到。单一时间点的终点空斑实验无法提供有关 CPE 发生或病毒介导的细胞毒性动力学的信息。此外,不同的细胞类型和细胞密度,以及病毒株、血清型和突变会导致空斑形成速率和大小发生巨大变化。因此,单个实验终点的选择不当可能导致病毒滴度和杀伤能力的计算不准确。通过目视检查来确定空斑并人工计数也具有主观性,会导致结果差异大。 最近关于溶瘤病毒 (Dyer et al., 2017 和Fajardo et al.,2017)2和癌症疫苗 (Crosset al., 2015 和 Pham et al.,2014)的同行评审研究表明, Agilent xCELLigence 实时细胞分析 (RTCA) 系统是一款功能强大的工具,通过简单流程评估病毒滴度和细胞毒性动力学,操作简单,读取迅速且具有较高的可重复性。 RTCA 检测利用嵌入在微板孔底部的微电子生物传感器,实现对细胞活动(例如病毒介导的细胞杀伤)的动态、实时、无标记和无损的分析。由于 RTCA 分析过程未使用琼脂糖覆盖,因此裂解细胞释放的子代病毒可以在培养基里自由扩散,感染远处的靶细胞。病毒在整个孔中毫不受限的伸展使得所有细胞可快速裂解,相比空斑实验能更快完成病毒滴度定量分析。 xCELLigence 仪器的阻抗测量按用户设置的频率进行自动记录,并由 xCELLigence软件通过细胞指数(CI)的无量纲参数进行绘图。 使用 xCELLigence RTCA 系统监测病毒介导的细胞致病性的主要优势在于: 无标记:无需染料 快速:10秒内完成整个96孔板的读取 实时:定量监测快速(数小时)和缓慢(几天到几周) CPE 简单的工作流程:无需凝胶浇注。仅需将病毒加到宿主细胞中 准确、精准且较高重复性 自动化数据绘图:直观的xCELLigence 软件可实现简便的数据显示和客观分析,消除了空斑实验中常见的主观数据读数 本应用简报介绍了使用 AgilentxCELLigence 仪器,评估 Vero E6 细胞和HEK 293细胞由水泡性口炎病毒(VSV)介导的细胞病变实验。该方案能够鉴定细胞增殖动力学,以及不同细胞接种密度下病毒感染的最佳时间点。该实验克服了单点空斑实验的诸多局限,并为 RTCA 能够实现全面且可靠的病毒细胞致病性评估提供了直接的证据。 细胞 在37℃和5%CO,培养箱中对细胞进行培养。购自 ATCC 的 Vero E6 是一种缺乏1型干扰素基因的非洲绿猴肾细胞系。 购自Microbix Biosystems 的 HEK 293 是 一种具有完整干扰素系统的人胚肾细胞系。两种贴壁细胞系均采用添加了10%胎牛血清、2 mmol/L 谷氨酰胺和1%青霉素/链霉素的 Dulbecco 改良 Eagle 培养基 (DMEM)进行维持培养。 病毒 在37℃、含 5% CO,的条件下,于 VeroE6细胞中加入印第安纳血清型水泡性口炎病毒 (VSV)进行培养和滴定。 细胞增殖分析 为了进行实时细胞分析,首先将100 uL生长培养基添加到 Agilent E-Plate 96 的每个孔,获取背景读数。其次,将每种细胞类型连续1:1稀释的七种不同细胞数(50000-781个细胞/孔)重悬于 100 uL培养基中,然后接种至 E-Plate 96 中。将含有细胞的 E-Plate 在室温下温育30分钟,然后放置在细胞培养箱里的 RTCA SP检测台上。使用 RTCA SP 仪器每30分钟监测一次细胞粘附、伸展和增殖情况。通过 RTCA 软件将 E-Plate 96 每个孔中细胞的测量阻抗信号自动转化为CI 值。 评估病毒介导的细胞致病性 进行病毒研究时,将各细胞系以25000个细胞/孔和12500个细胞/孔的密度分别接种至 E-Plate 96 的每个孔中。在20.5小时(Vero E6 细胞)和68.5小时(HEK 293细胞)后,当细胞达到融合(25000个细胞/孔)或仍处于生长期 (12500个细胞/孔)时,使用水泡性口炎病毒 (VSV)感染细胞。从 RTCA SP 检测台取出 E-Plate 96,将重悬于 10 pL 培养基的800000(高MOI) 或 80000(低MOI)PFU VSV 至加至孔中。在8个孔里只加入10 uL 生长培养基进行模拟感染作为对照。然后立即将 E-Plate 96 放回培养箱中的 RTCA SP检测台上,每15分钟测量一次CI值,持续检测190个小时。 细胞增殖的动态监测 为确定病毒感染的最佳时间点,使用 VeroE6 和 HEK 293 细胞进行细胞增殖分析。Vero E6 细胞病毒感染的合适时间点确定为20.5小时, HEK 293 细胞为 68.5 小时(图1A和1B)。在这些时间点时,使 用12500个细胞接种的情况下细胞处于生长期,而使用25000个细胞接种的情况下细胞处于早期稳定期。因此,对处于生长期或早期稳定期的细胞监测了病毒细胞致病性。 使用 Vero E6 细胞进行 VSV细胞致病性分析 基于细胞增殖的动态监测,在接种后20.5小时,使用 VSV 以两种不同的 MOI感染处于生长期和早期稳定期的 Vero E6细胞。 当 Vero E6 细胞在生长期感染 VSV 时,用于感染的病毒数量与病毒介导的细胞病变效应的发生时间之间具有明确的相关性(图2)。以低 MOI (80000 PFU VSV) 感染 后,细胞继续生长15小时(图2A, 蓝色曲线),与模拟感染的细胞(图2A,绿色曲线)情况相似。随后,CI值下降,表明 VSV 复制导致细胞开始死亡。与之相反,模拟感染的细胞继续生长。感染后24小时,CI值下降到最大值的50%(CI50), 然后继续下降至零,表明感染培养物中的细胞全部死亡。相比之下,以高MOI (800000 PFU VSV) 感染的 VeroE6细胞的CI值在感染后4小时开始下降(图2A,红色曲线),并在11小时后达到 CI50。 当融合的 Vero E6 细胞被感染时,结果也非常相似(图2B)。分别在感染后10小时(高MOI,见图2B,红色曲线)和19小 图1.细胞增殖的动态监测。将细胞接种至 Agilent E-Plate 96 中,通过测量 CI 值对其进行连续监测,从而确定加入病毒的合适时间点(生长期或早期稳定期)。使用Agilent RTCA SP仪器,每30分钟对 (A) Vero E6细胞和(B) HEK293细胞的粘附、伸展和增殖情况进行一次动态监测。彩色曲线表示在 E-Plate 96中每孔接种的不同细胞数(从左到右):红色,50000;绿色,25000;蓝色,12500;品红色,6250;青色,3125;珊瑚色,1562;深绿色,781;橄榄绿,培养基对照(无细胞) A Vero E6 细胞的 VSV 细胞致病性分析曲线 B Vero E6 细胞的 VSV 细胞致病性分析曲线 图 2. Vero E6 细胞感染 VSV 的动态监测。(A)生长中细胞的归一化细胞指数(CI)值,(B)融合细胞的归一化CI 值。使用 Agilent RTCA SP 仪器,每15分钟测量一次细胞阻抗,从而监测病毒介导效应对细胞粘附、伸展和增殖的影响。在20.5小时加入病毒,用黑色垂直线表示。橙色虚线表示CI值下降至最大值的50%(CI50)时的时间点。绿色曲线:对照(未感染病毒);蓝色曲线:80000 PFU VSV;红色曲线:800000 PFUVSV 时(低MOI,见图2B, 蓝色曲线)达到CI50。观察到感染的培养物全部死亡,表现为CI 值下降至零。 使用 HEK 293 细胞进行 VSV 细胞致病 性分析基于细胞增殖的动态监测,在接种后68.5小时,使用 VSV 感染处于生长期和早期稳定期的 HEK 293细胞(图3A和3B)。与 Vero E6 细胞相比, HEK 293细胞感染 VSV 时反应不太相同。处于生长期的HEK 293 细胞对 VSV 感染更加敏感,,1以高MOI 感染后6小时,CI 值下降至 CI50(图3A,红色曲线)。以低 MOI 感染的细胞在感染后12小时达到 CI50(图 3A,蓝色曲线)。有趣的是,当融合的 HEK293细胞被感染时,得到了完全不同的结果(见图3B)。虽然以高MOI感染的融合细胞的CI 值表现出与生长期细胞相 似的下降(图3B,红色曲线),但是以低 MOI 感染的细胞则表现为完全抗 VSV感染,其CI 值与模拟感染的细胞基本相同(图3B,蓝色和绿色曲线)。关于对VSV 感染的不同反应, Vero E6 和 HEK293细胞之间的主要区别在于产生Ⅰ型干扰素的能力。 Vero E6细胞缺乏干扰素基因 (Emeny 和 Morgan 1979)。因此,它们无法响应病毒感染而上调干扰素诱导的抗病毒活性蛋白(例如MxA 和OAS/RNaseL) 的表达。 相反, HEK 293 细胞具有完整的干扰素系统。在病毒感染过程中,它们以自分泌和旁分泌的方式产生激活 JAK/STAT信号传导通路的干扰素。因此,抗病毒活性蛋白开始表达并建立抗病毒状态。融合HEK 293细胞表现出对低 MOI VSV 感染的抗性,可能是其干扰素系统产生的抗病毒反应。 此外,融合细胞胞为 VSV 复制环境可能不甚理想,众所周知,与生长中细胞相比,融合细胞的代谢活性较低。这与前文的假设相吻合,即生长中的HEK 293细胞对 VSV 更加敏感,与用于感染的 MOI无关。 已知 VSV-M 蛋白可通过抑制宿主 RNA 和蛋白质合成来对抗干扰素系统,从而阻断宿主定向基因表达 (Ferran 和 Lucas-Lenard 1997)4。因此,在生长中或融合的Vero E6 和 HEK 293 细胞出现对 VSV感染的反应差异,以及结果对细胞数量(和VSVMOI)的依赖性,很可能反映了细胞抗病毒机制与病毒对策之间的相互作用。 与传统的终点分析方法不同,使用 XCELLigence 系统进行的实时细胞分析可对病毒与宿主之间的相互作用进行连续监测,从而更好地确定哪些反应是由病毒或细胞活动占主导作用。 A HEK 293 细胞的 VSV 细胞致病性分析曲线 B HEK 293细胞的 VSV细胞致病性分析曲线 图 3. HEK 293 细胞感染病毒的动态监测。(A)生长中细胞的归一化CI值,(B)融合细胞的归一化CI值。使用 Agilent RTCA SP 仪器,每15分钟测量一次细胞阻抗,从而监测病毒介导效应对细胞粘附、伸展和增殖的影响。黑色垂直线表示在68.5小时加入病毒,橙色虚线表示CI下降至最大值的50%(CI50)时的时间点。绿色曲线表示对照(未感染病毒);蓝色曲线:80000 PFU VSV;红色曲线:800000 PFU VSV ( 参考文献 ) ( 1. Cross et al. Therapeutic DNAVaccination Against ColorectalCancer by T argeting the MYBOncoprotein. Clin Trans l Immunology2015,4(1), e30 ) ( 2. D yer e t al.Oncolytic Group B Adenovirus Enadenotucirev Mediates Non-Apoptotic Cell Death withMembrane Disruption and Release ofInflammatory Mediators. MolecularTherapy:O n colytics 2 0 17, Vol. 4, 18-30 ) ( 3. Emeny, J. M.; Morgan, M.J. Regulation of the Interferon System: Evidence that Vero Cells Have a Genetic Defect in Interferon Production. J. Gen. Virol . 1979,43(1), 247-252 ) 4. Ferran, M. C.; Lucas-Lenard, J. M.The Vesicular Stomatitis Virus MatrixProtein Inhibits Transcription fromthe Human Beta Interferon Promoter.J. Virol.1997,71(1),371-377 ( F ajardo et al. Oncolytic AdenoviralDelivery of an EGFR-TargetingT cell Engager Improves AntitumorEfficacy.2017. doi: 10.1158/0008- 5472.CAN-16-1708 ) ( 6. P ham et al. A Simple In Vitro Method f or Evaluating Dendritic Cell - BasedVaccinations. Onco T argets T her. 2014,7,1455-64 ) ( 7. Lebourgeois et al. Development o f a Real-Time Cell Analysis (RTCA) Method as a Fast and Accurate Method for Detecting InfectiousParticles of the Adapted Strain ofHepatitis A Virus. Front Cell Infect Microbiol. 2018 Sep 25,8,335 ) ( 8. Thieulent et al. Screening andEvaluation of Antivira l CompoundsAgainst Equid Alpha-HerpesvirusesUsing an Impedance-Based CellularAssay. Virology 2019 J an 2, 526, 105-116 ) www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 C安捷伦科技(中国)有限公司,2019 2019年11月1日,中国出版 5994-1062ZHCNAN9 DE.5630092593 本应用简报介绍了使用 AgilentxCELLigence 仪器,评估 Vero E6 细胞和HEK 293 细胞由水泡性口炎病毒 (VSV)介导的细胞病变实验。该方案能够鉴定细胞增殖动力学,以及不同细胞接种密度下病毒感染的最佳时间点。该实验克服了单点空斑实验的诸多局限,并为 RTCA 能够实现全面且可靠的病毒细胞致病性评估提供了直接的证据。
确定




还剩3页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《病毒介导细胞中致病性检测方案(细胞定量分析)》,该方案主要用于其他中致病性检测,参考标准--,《病毒介导细胞中致病性检测方案(细胞定量分析)》用到的仪器有Agilent xCELLigence RTCA DP实时无标记细胞分析仪、Agilent xCELLigence RTCA MP实时无标记细胞分析仪
相关方案
更多
该厂商其他方案
更多











