
方案详情
文
本文采用 Agilent 7800 ICP-MS 与高基质进样系统 (HMI) 相结合,建立了对酱油中的 26 种元素进行分析的 ICP-MS 方法。此方法参照《食品安全国家标准食品中多元素的测定》 (GB 5009.268-2016),绝大部分元素回收率结果在 90.0%–110.0% 的范围内。各元素长期测试稳定性良好,2 小时内各元素 RSD < 3%,完全满足酱油样品多元素检测的要求。本文采用 Agilent 7800 ICP-MS 与高基质进样系统 (HMI) 相结合,建立了对酱油中的 26 种元素进行分析的 ICP-MS 方法。此方法参照《食品安全国家标准食品中多元素的测定》 (GB 5009.268-2016),绝大部分元素回收率结果在 90.0%–110.0% 的范围内。各元素长期测试稳定性良好,2 小时内各元素 RSD < 3%,完全满足酱油样品多元素检测的要求。
方案详情

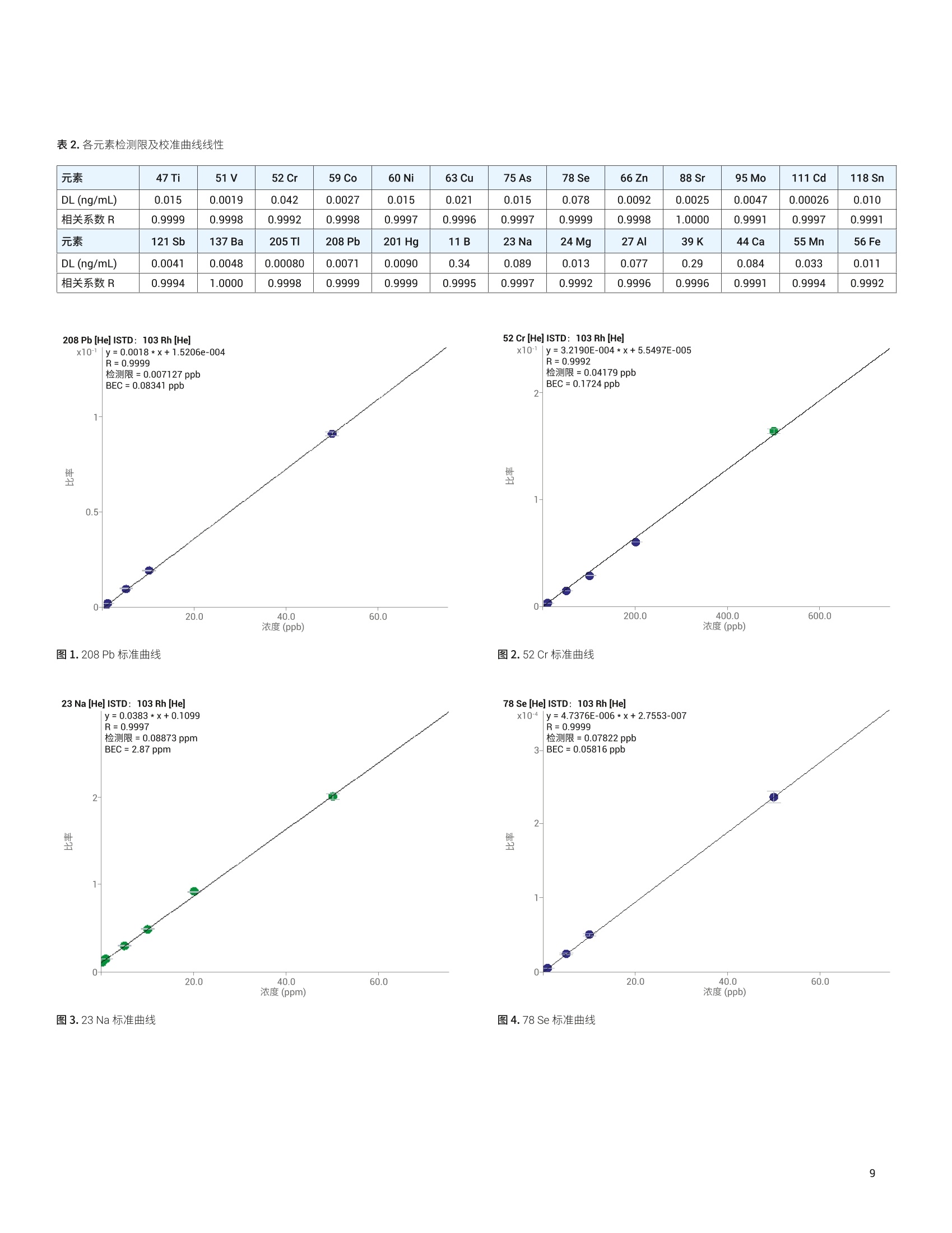
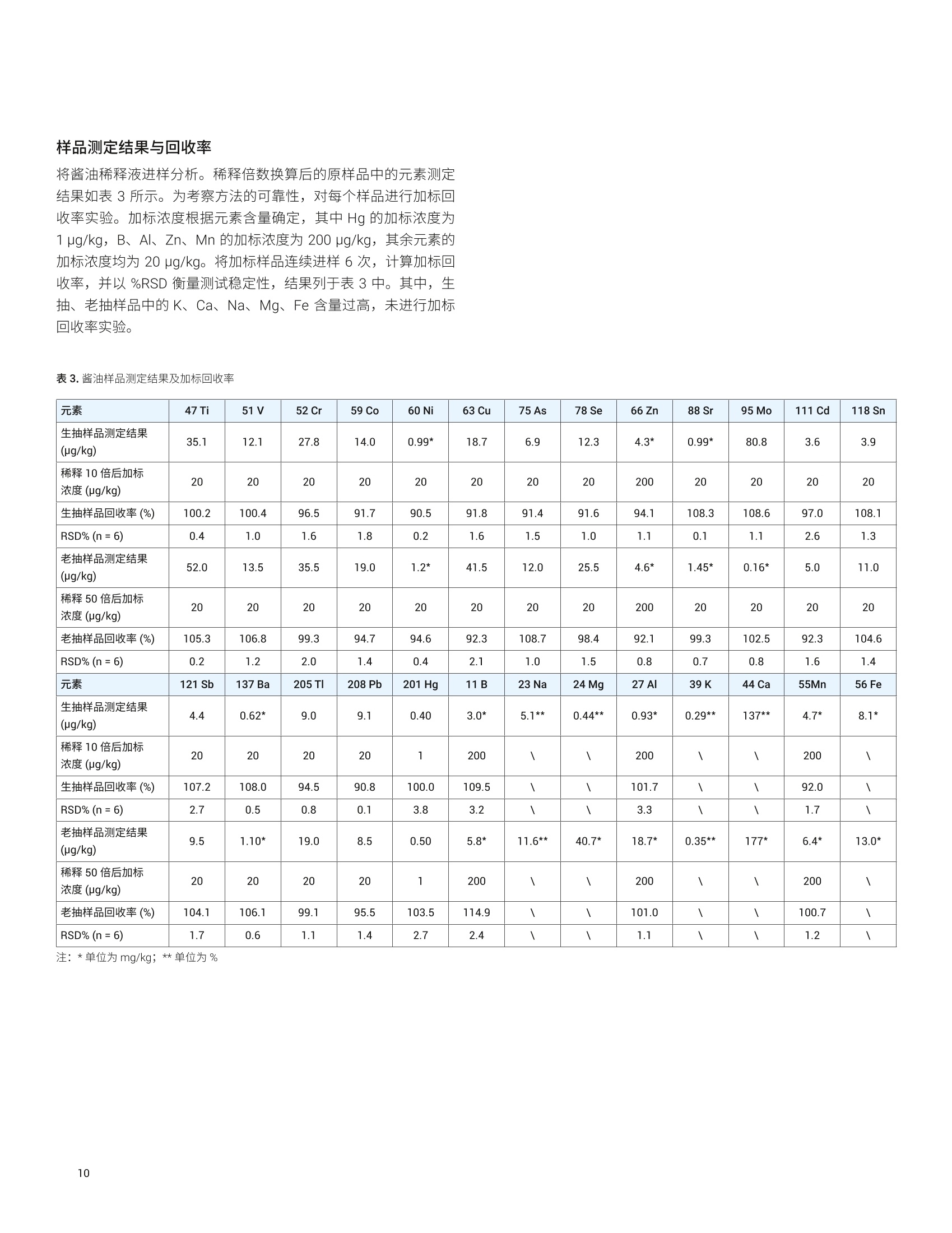
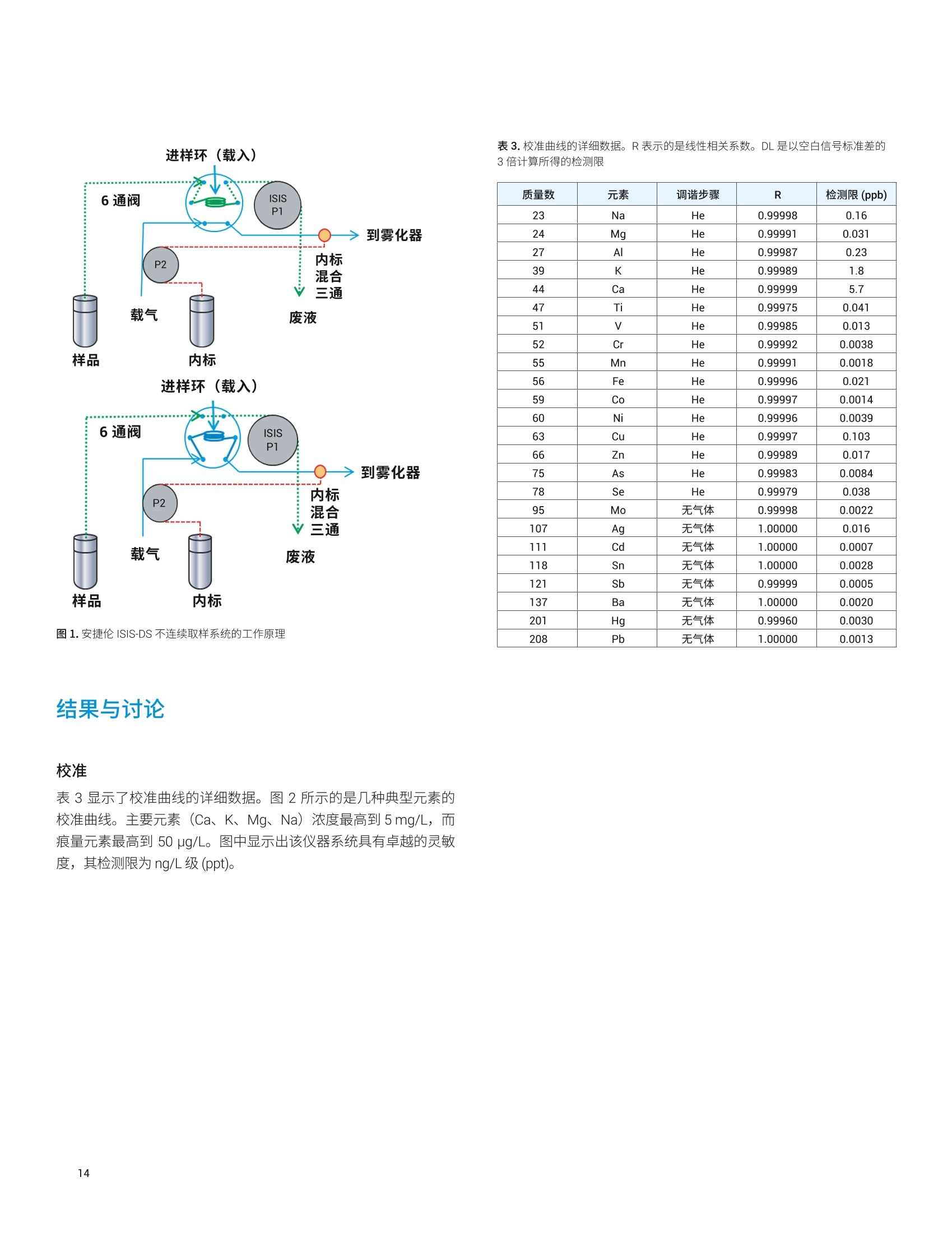
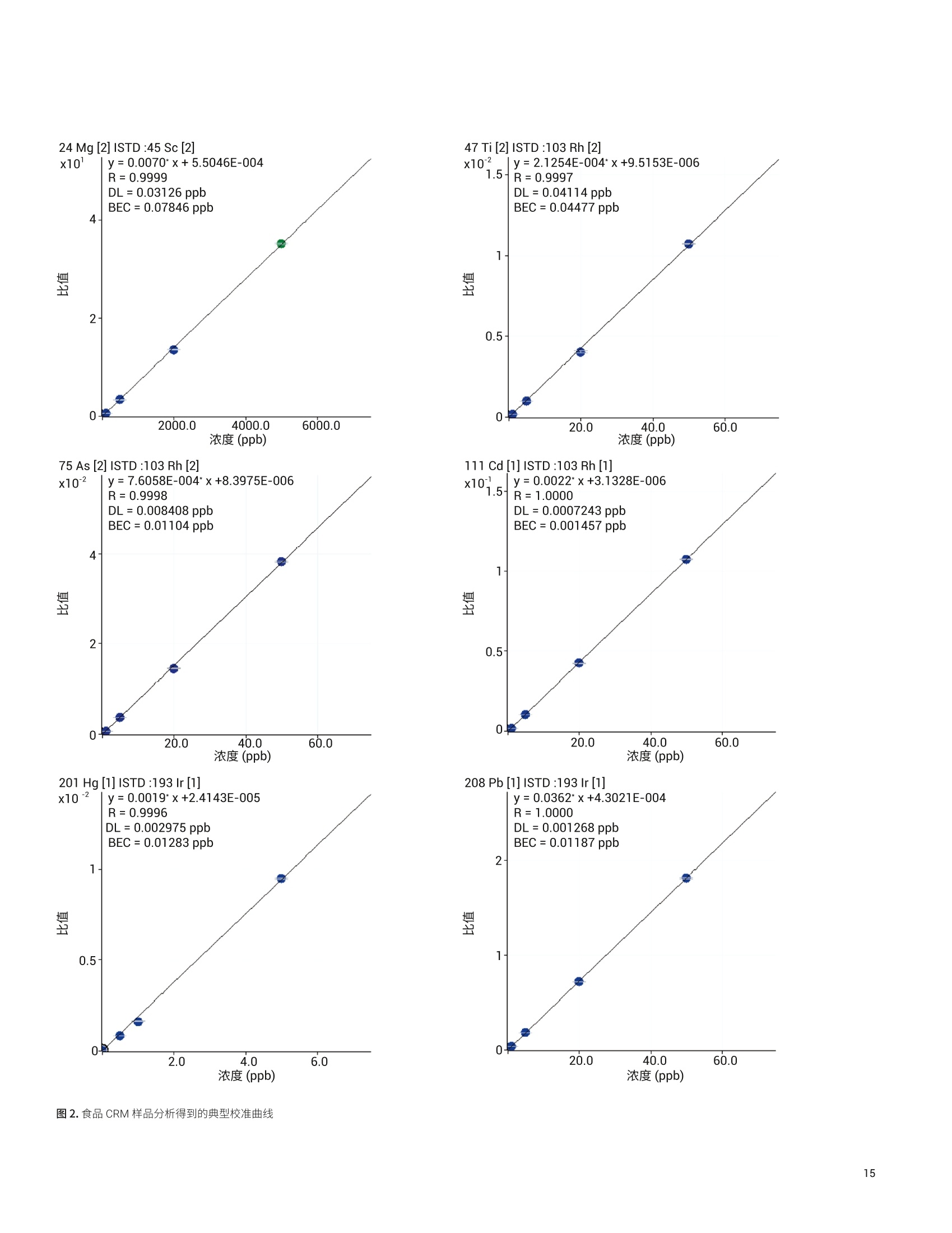
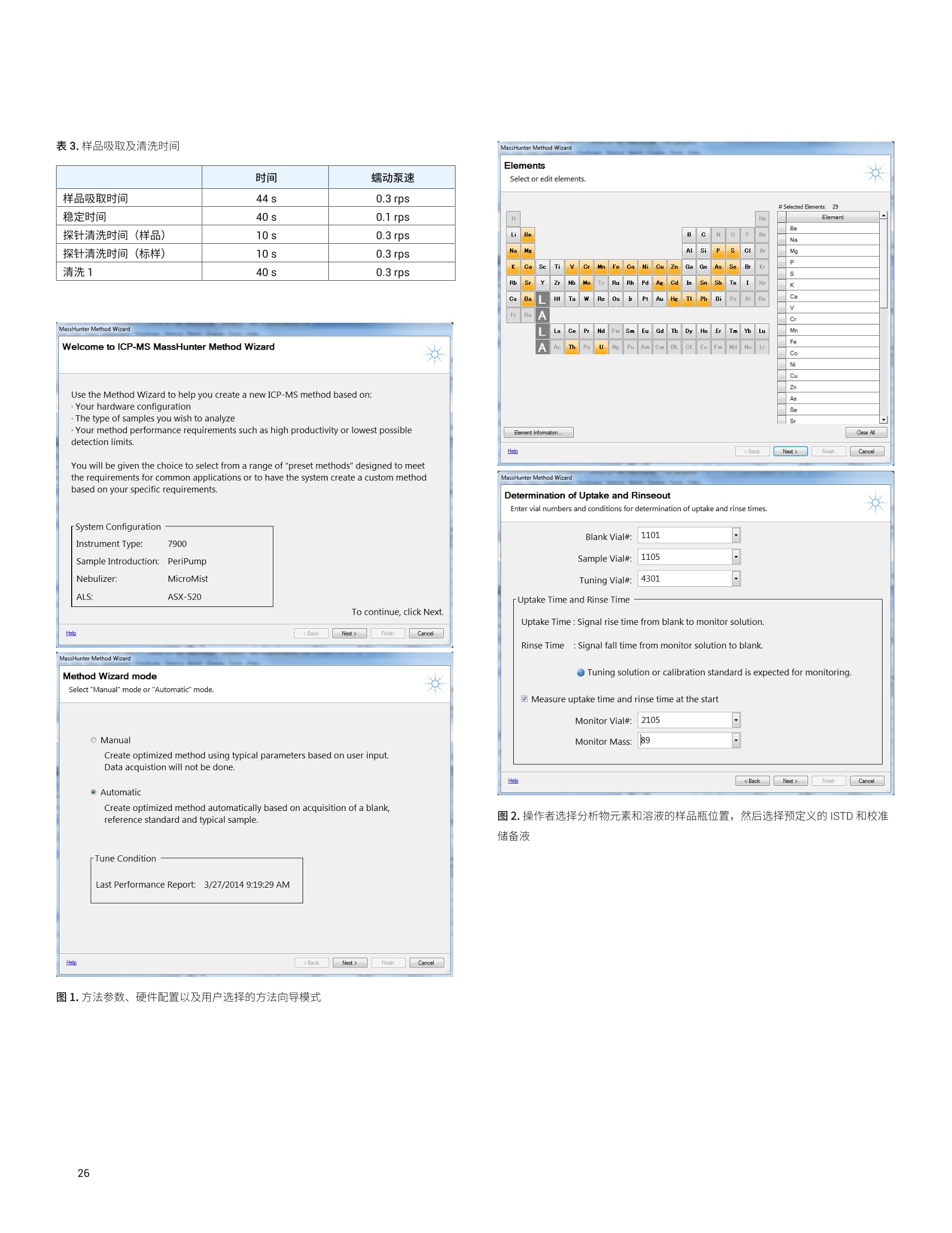
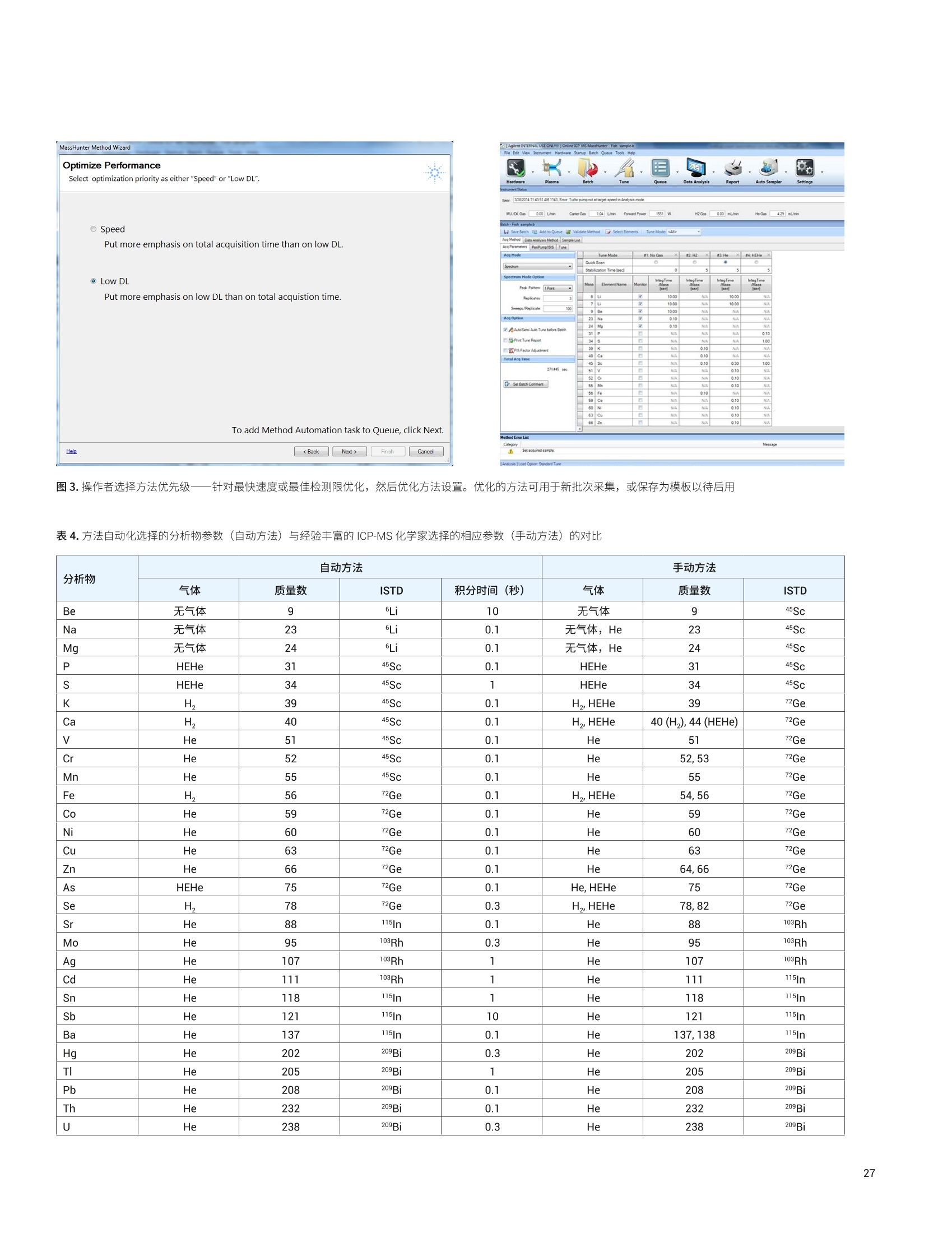
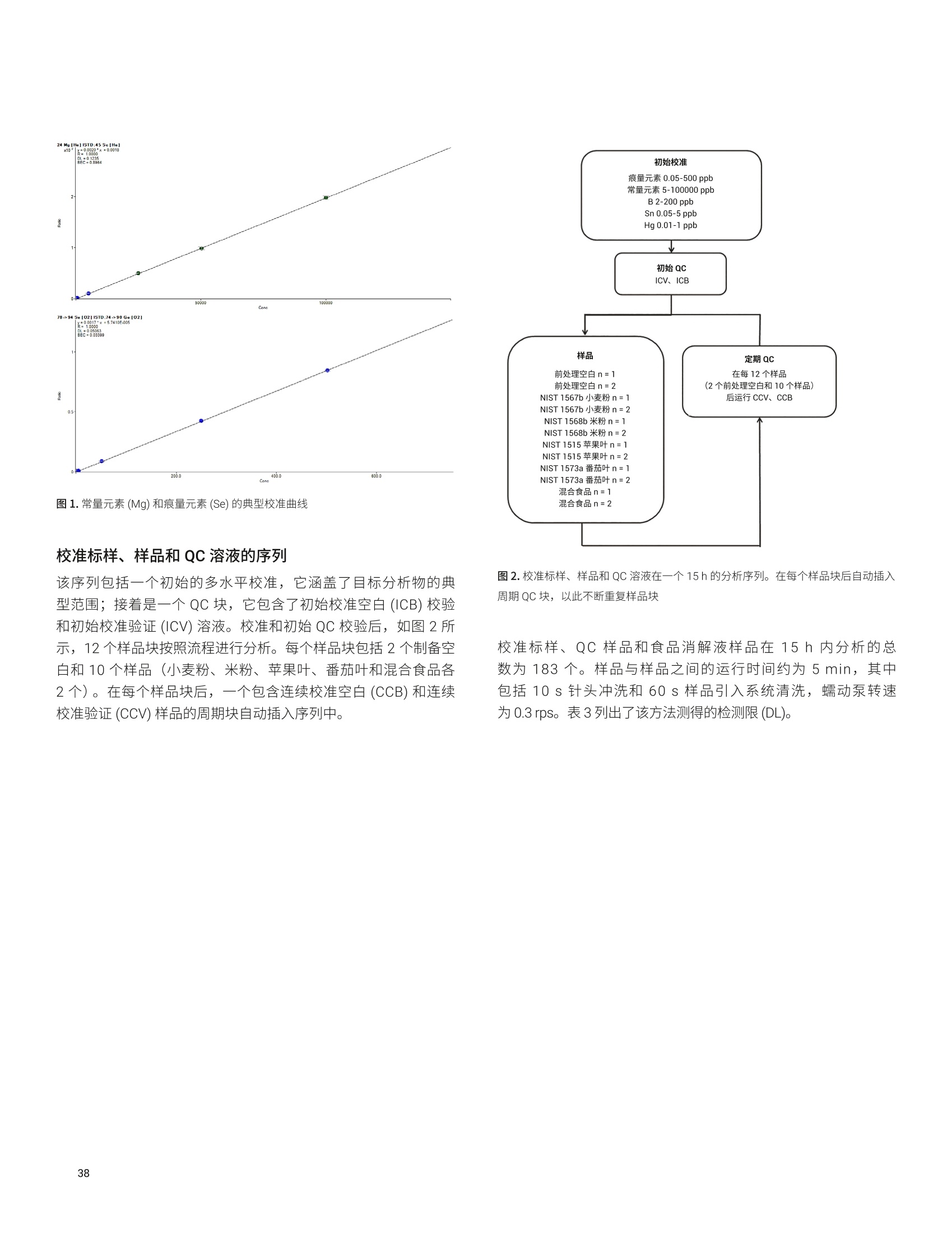
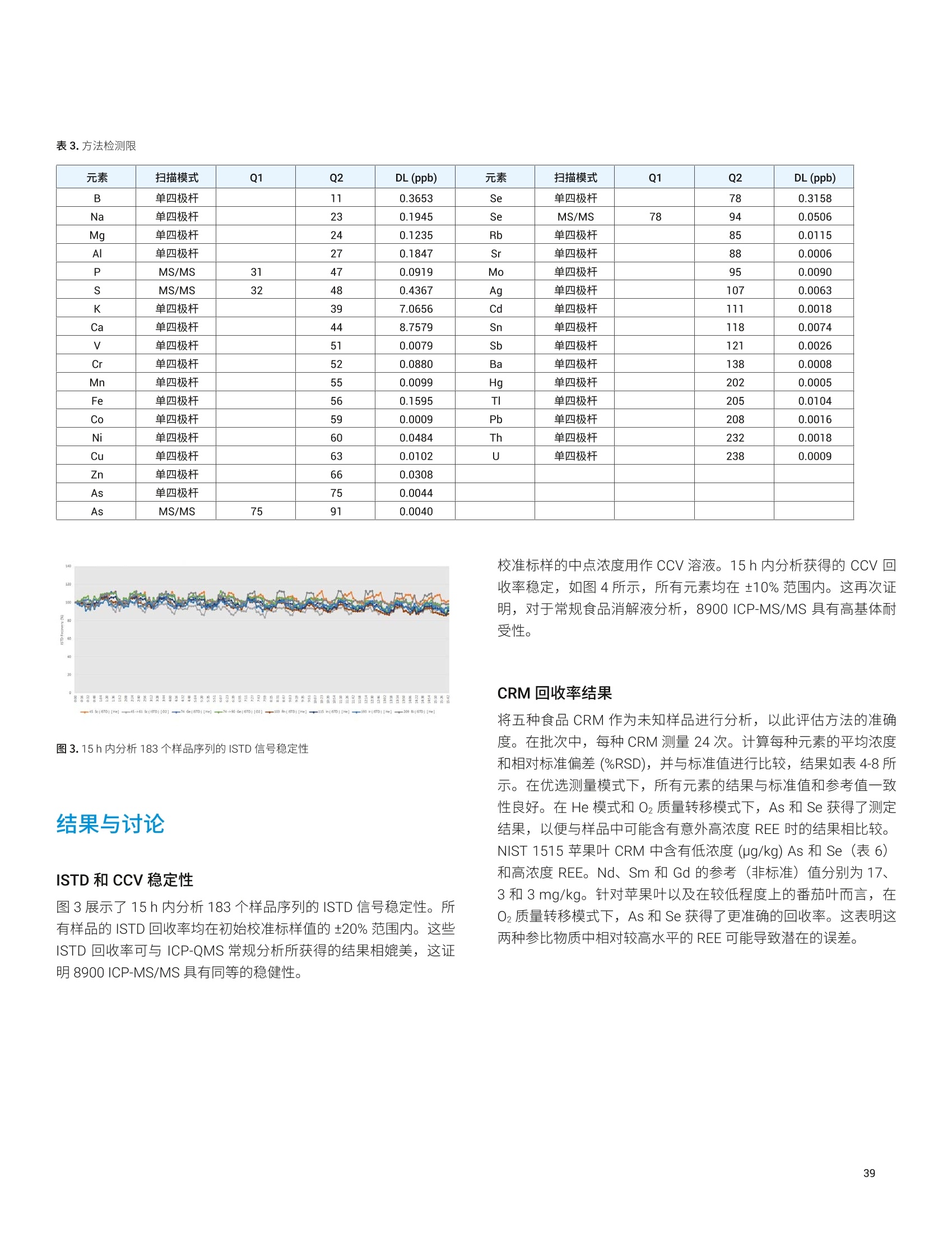
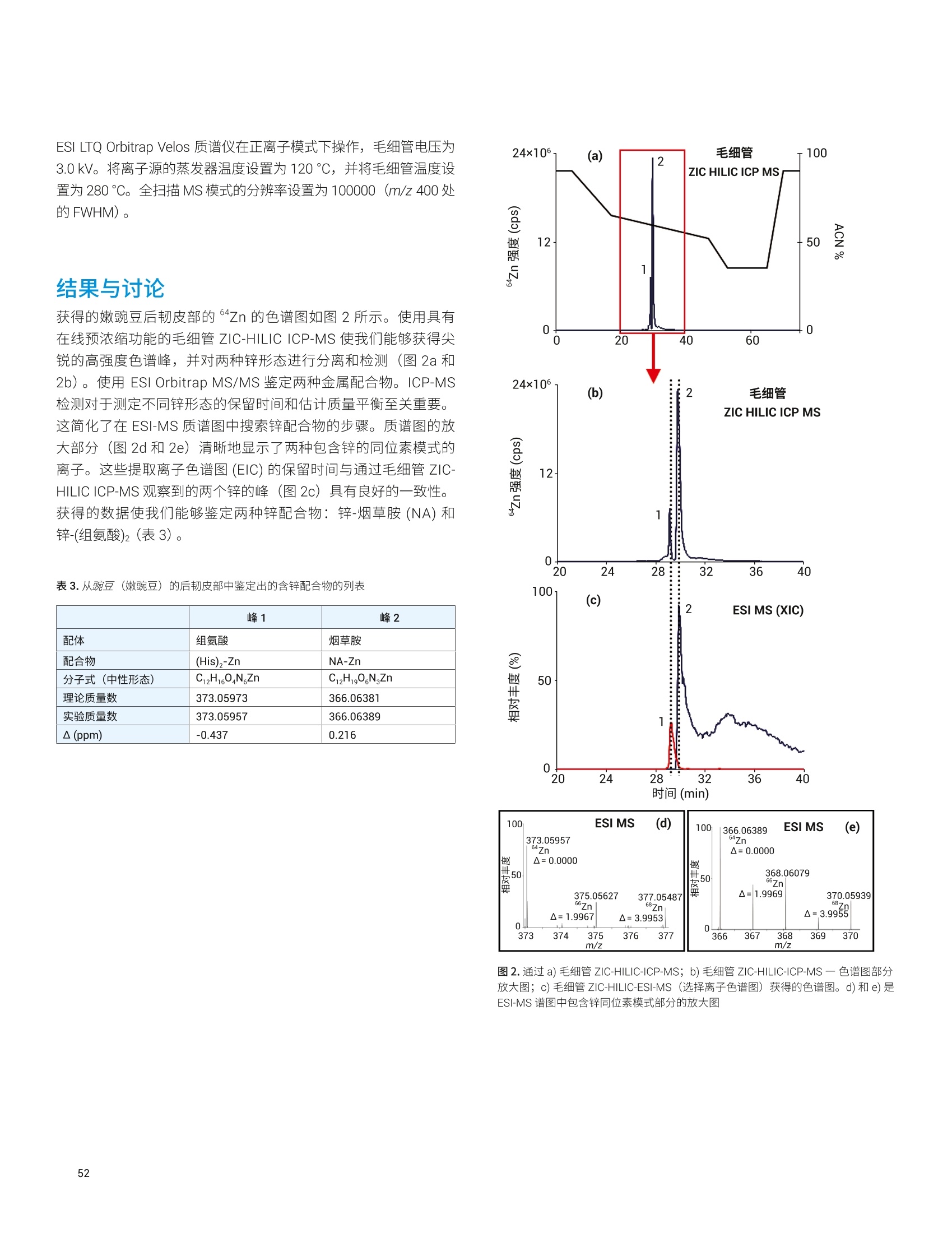
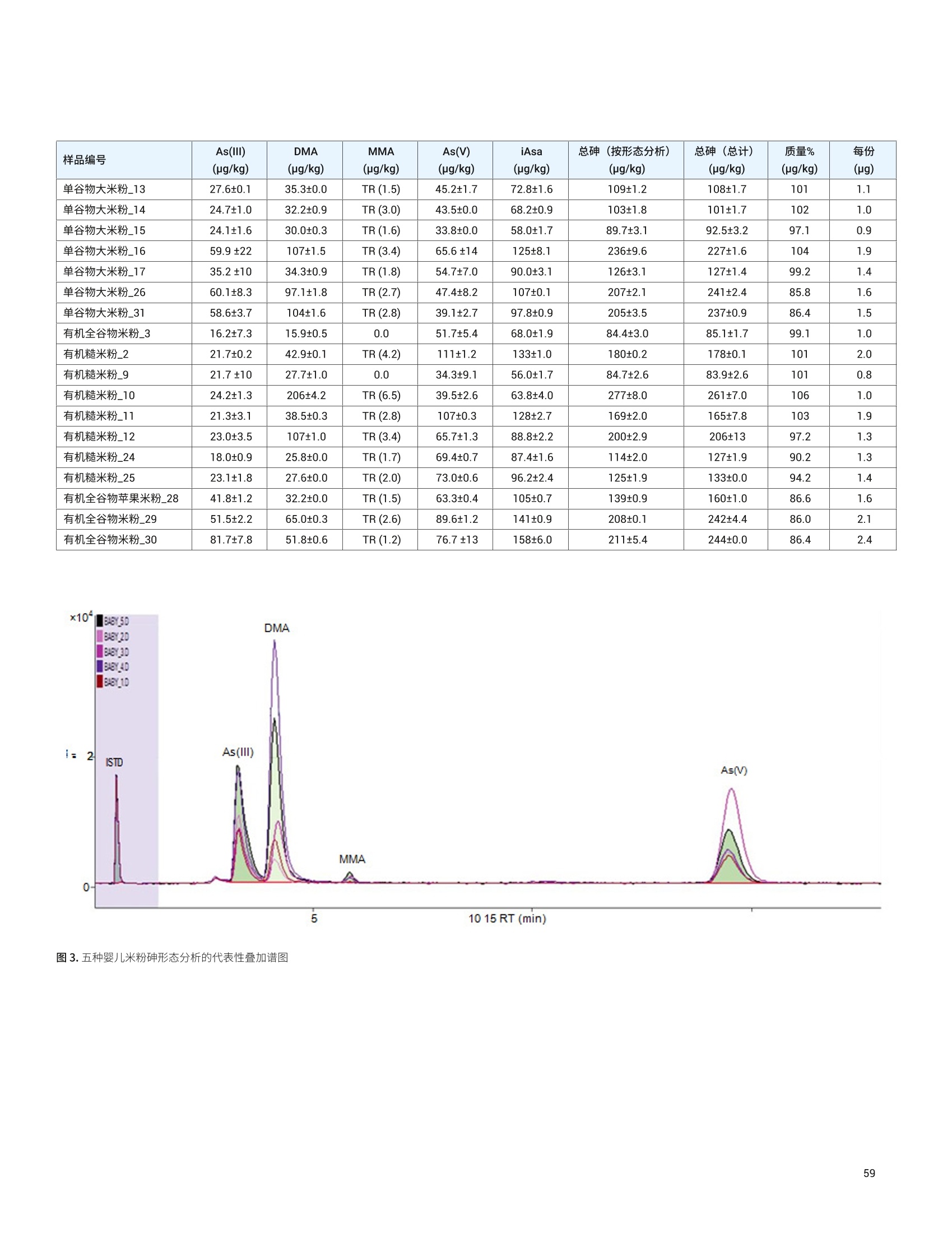
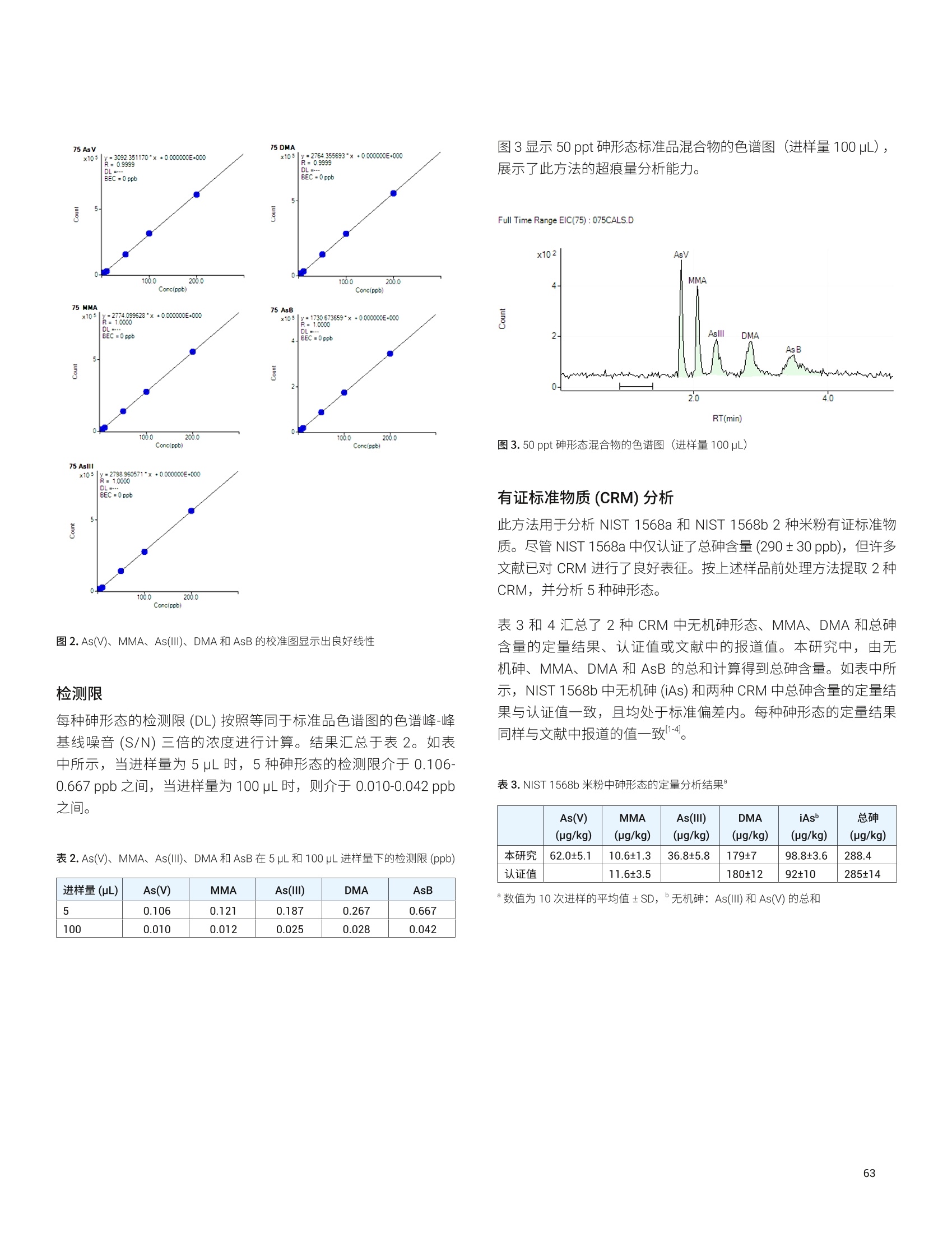
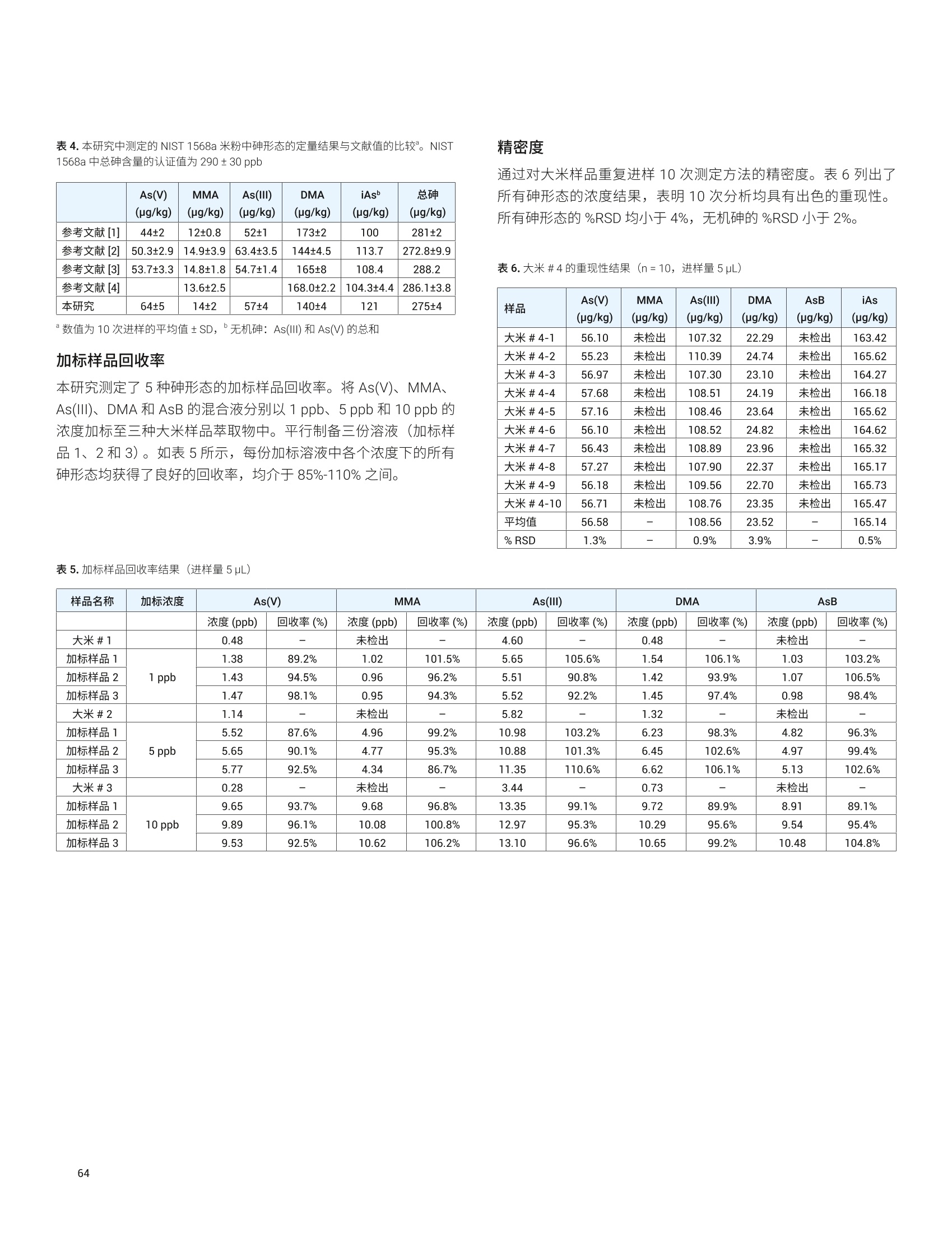
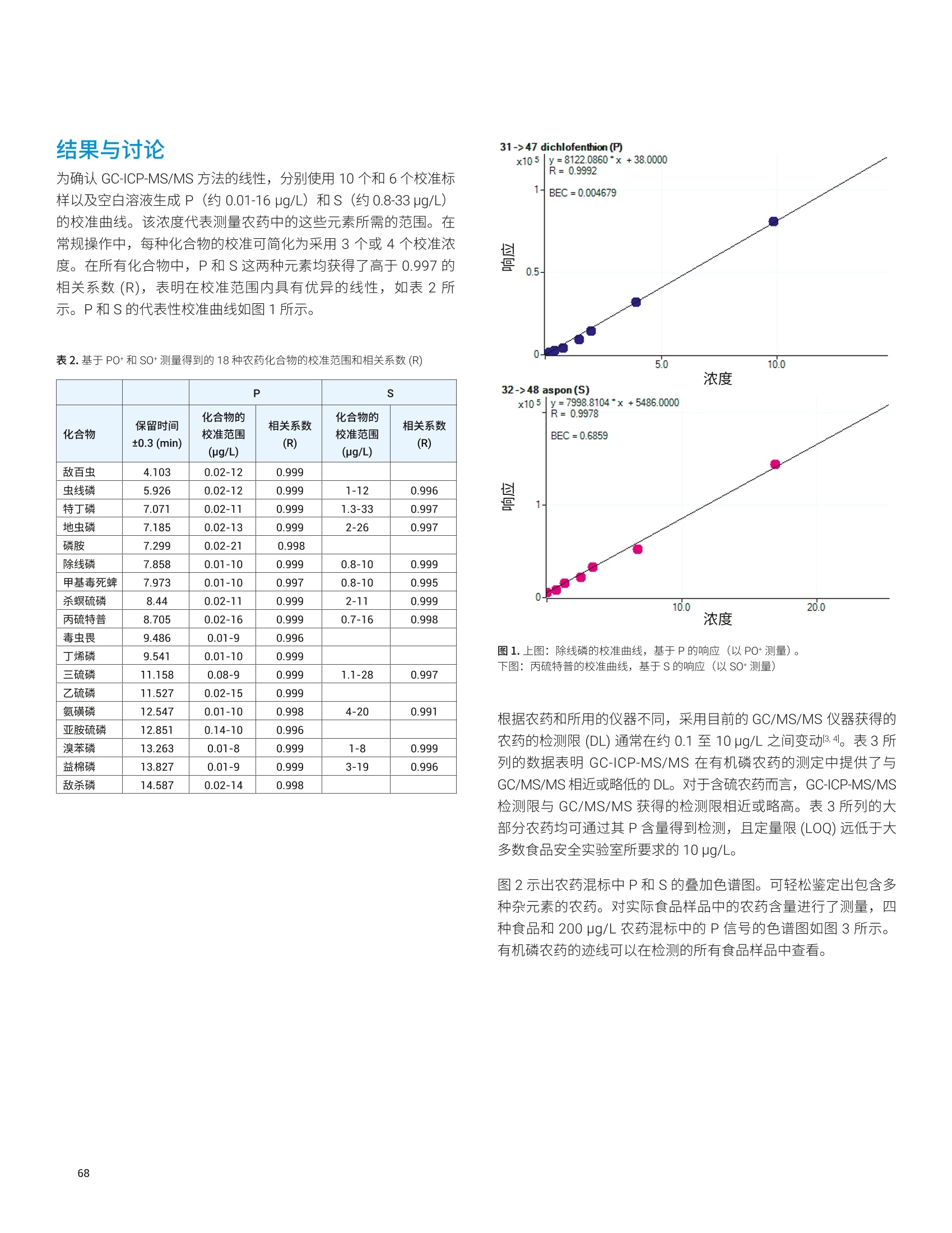
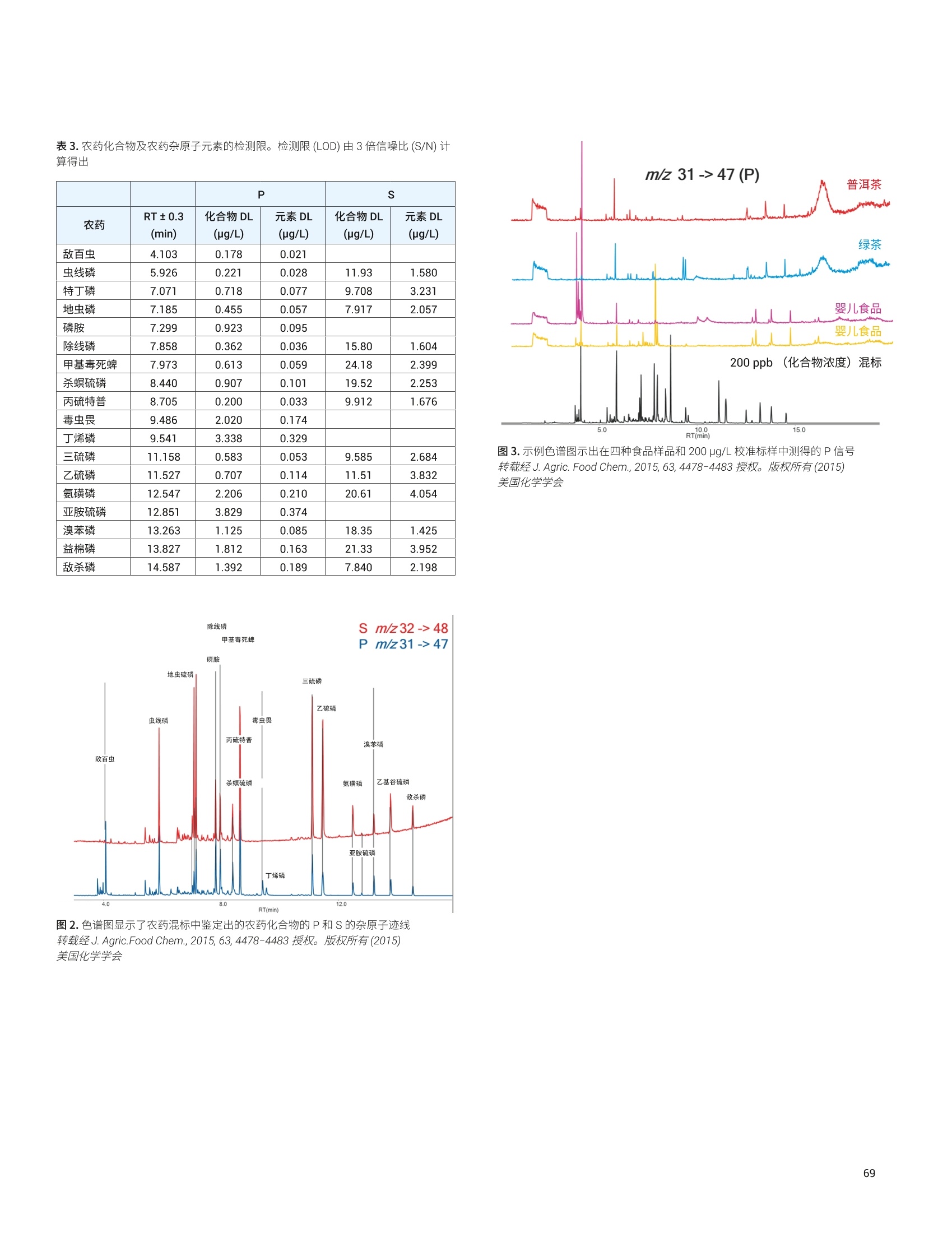
目录 前言 前言 2 安捷伦 ICP-MS 在食品检测领域中的应用优势 3 安捷伦 ICP-MS 产品在食品多元素检测领域中的应用文集 6 使用气溶胶稀释进样-Agilent 7800 ICP-MS 检测酱油中的26种元素 / 增强 ICP-MS对食品样品的分析能力 12 采用 ICP-MS 的集成进样系统-不连续进样 (ISIS-DS) 对茶叶浸泡液中的13种痕量元素进行直接分析 18 应用带方法自动化功能的 Agilent 7900 ICP-MS 对食品 CRM 中的痕量金属组分进行常规测定 23 使用 Agilent 7900 ICP-MS 对牛奶和奶粉进行常规的高通量多元素分析 30 MS/MS 模式下运行的 Agilent 8900 ICP-MS/MS 在日常食品分析中的尤势 35 安捷伦 ICP-MS 产品在食品形分分析领域中的应用文集 应用 HPLC-ICP-MS联用技术进行食品中汞形态分析的优势 通过毛细管 HPLC-ICP-MS 分析微升体积的植物汁液中锌的形态 50 使用 HPLC-ICP-MS对婴儿米粉中的无机砷进行形态分析 54 使用HPLC-ICP-MS快速测定精白米中的五种砷形态 61 利用基于 GC-ICP-MS/MS 的磷和硫检测方法测定食品中的农药 66 采用 Agilent 8800 ICP-MS/MS 通过 HPLC-ICP-MS联机进行苹果汁中 砷的形态分析 71 使用氢化物发生法-ICP-MS 高通量测定大米中的无机砷 78 安捷伦 ICP-MS 产品在食品溯源、蛋白质组学等领域中的应用文集8 应用一种新的毛细管 HPLC-ICP-MS接口进行富硒酵母中含硒蛋白的鉴定采用ICP-MS软件测定储存温度和包装对葡萄酒中痕量金属成分的影响 89 葡萄园产地和酿酒厂对红葡萄酒元素特征的影响 94 电感耦合等离子体质谱仪 (ICP-MS) 自问世以来已经历35年的发展与完善。相对于石墨炉原子吸收法, ICP-MS 具有灵敏度高、涵盖元素范围广、多元素分析、线性范围宽和干扰少等特点,非常适合用于多元素分析。在分析痕量元素的同时,其分析范围可拓宽至常量元素,大大提高了检测效率和样品通量,是食品样品中多元素分析的理想选择。ICP-MS 自商品化以来,以其快速、精准、灵敏的特点,迅速成为欧美众多检测机构和企业进行元素分析的主要手段。 食品营养物质、食品安全是公众一直关心的热点问题之一。近年来,在食品领域,我国 ICP-MS检测相关国家标准相继继布实施,为ICP-MS 在食品及包装材料检测提供了更多的标准方法支持,元素分析方法也已经逐渐由化学分析法、原子吸法收和原子荧光法过渡到电感耦合等离子体光谱与质谱法,使检测元素范围和检测方法的灵敏度能够满足逐渐严格的食品安全限量要求。 在食品安全国家标准方面,2016年国家实施了食品安全国家标准 GB 5009.11-2014 食品中总砷及无机砷的测定和 GB 5009.17-2014 食品中总汞及有机汞的测定;又于2017年6月实施了食品安全国家标准 GB 5009.268-2016 食品中多元素的测定。在食品包装材料方面,于2017年4月生效的 GB 31604.49-2016 等一系列系列国家标准中,加入了用 ICP-MS法测定食品接触材料中重金属含量或重金属迁移量的内容。 除常规的食品重金属污染、营养多元素检测的需求外,目前很多实验室越来越多关注形态分析、产地溯源、真伪鉴别、食品安全风险评估和预警、食品组学等方面的研究。 安捷伦 ICP-MS 无论在全球或中国的市场占有率都是第一。对于食品相关分析中,安捷伦对复杂基体样品、元素范围宽等问题提供独特的解决方案;在特定食品产地溯源、高价值食品真伪鉴别方面,安捷伦独特的分析手段和软件服务能够帮助您实现目标;针对当下热议的 ICP-MS 联用技术对食品中重金属形态分析,安捷伦经过近10年积累的大量应用数据,针对不同基体与 LC、GC、激光剥蚀,甚至电泳技术的联用技术不断进行更新。此外,由于安捷伦独特的串接 ICP-MS产品 ICP-MS/MS, 将高基体样品的检测灵敏度提高到了一个新的高度,满足了某些存在特殊干扰的应用或要求更高灵敏度的特定元素分析需求。在有机物检测领域,随着如利用 GC 与 ICP-MS/MS联用技术对痕量有机磷和有机硫农药进行高灵敏度以及高选择性的检测, HPLC 与 ICP-MS 联用技术与有机质谱配合研究富硒蛋白鉴定等等生物研究领域的应用不断推出, ICP-MS 乃至 ICP-MS/MS的应用范围也在不断被刷新。 对于 ICP-MS 的研发工作,安捷伦在30年间一直引领创新,在应用研发也积累了大量经验。无论在您的检测还是科研的工作中,安捷伦都能助您实现成就。 食品样品具有基质组成复杂、元素浓度范围宽等特点,给此类样品的元素分析带来极大挑战。利用传统 ICP-MS 进行分析时,往往存在结果准确度和分析效率不佳的情况。安捷伦ICP-MS 凭借众多成熟先进的专利技术,能够有效帮助用户解决这些可能面临的困难。 高效去除干扰 食品样品类型复杂带来的一个突出问题是不同样品中受干扰的元素不同,且干扰物质的来源也不同。例如,在对饮用水的分析中,砷元素测定几乎不存在质谱干扰;而在对富含氯盐的海产品分析中,氯和氩元素可能会在等离子体中结合并电离成为分子离子,从而干扰砷元素的测定。理论上,每种元素几乎都会存在3到5种多原子质谱干扰。因此,能够应对不同基质带来的各种质谱干扰的通用型技术是提高分析效率和分析准确度的关键。 安捷伦 ICP-MS配备经过15年逐步优化的ORS" 第四代八极杆碰撞反应池,借助八极杆强大的离子约束传输功能和专利屏蔽矩 STS 技术的离子动能约束功能,可很大程度发挥氦气碰撞模式中的动能歧视效果,完全消除不同基质中多原子质谱干扰。即使同时分析多种基质差异巨大的食品样品,您只需设定一种分析方法即可获得所有元素的准确测定结果。 高基质耐受性 食品行业中需要分析的样品类型非常广泛,涵盖从几乎不含可溶性固体的饮用水到盐度极高的酱油,从基质单一的食品原料、食品添加剂到基质复杂的海产品、腌制食品。不同类型的食品经过消解后,消解液中的可溶性固体含量量(俗称盐度)及其元素组成差异极大。因此在 ICP-MS 中进样时,样品溶液的雾化效率不同,相同元素在不同样品基质中的电离效率也不同,直接导致了测定结果回收率参差不齐。 使用常规 ICP-MS分析基质不同的食品样品时,必须先按照基质对样品进行分类,并相应地设置不同的测定条件和分析方法。还需要对高基质样品(如酱油和海产品等)进行不同比例的稀释,以减轻基质效应对回收率的影响。整个分析过程不但效率低下,还可能在手动稀释中从试剂或器皿中引入污染。 此外,在利用 LC 和 ICP-MS 联用技术分析时,梯度洗脱提高了 LC 分析的速度和效率,但梯度洗脱的缓冲盐浓度变化对 ICP-MS 的耐高盐性能提出了较高的要求。 安捷伦 ICP-MS 高基质进样系统(HMI)或超高基质进样系统(UHMI),可轻松解决复杂基体的样品带来的基质效应。通过软件自动优化 HMI 稀释倍数,利用高纯气体,对整批混合样品进行在线稀释,极大增强了直接分析复杂基体的样品的能力。耐受总盐度(TDS) 可达3%(HMI), 甚至25%(UHMI), 而传统仪器 TDS 耐受力<0.2%。 该系统能够实现不经稀释而直接进样分析复杂基体的样品(如保健品、海产品、腌制食品、调味品等),避免了繁琐的样品分类和手动稀释操作,极大提高了您的工作效率。气体稀释的手段相对于传统水稀释,也大大降低了水带来的氧化物干扰,从而降低检测限。 HMI 气溶胶稀释 不同基质效应引起的信号漂移 实现高样品通量和分析效率 安捷伦 ICP-MS 独特的集成样品引入系统(ISIS)-不连续进样(DS)模式能够很大程度提高复杂基体的样品的分析效率。不仅使运行时间和样品负载量大大降低,而且改善了长期基质耐受性,在不损失数据质量的前提下降低了分析成本。 同时分析常量和痕量元素 安捷伦 ICP-MS 配置同步双模式检测器和独有的高速放大器。其检测器提供了涵盖超过10个数量级浓度的线性动态范围,在无需调节任何离子透镜参数、四极杆分辨率或检测器电压的情况下,即可检测浓度从亚 ppt 至高达10000 ppm 的样品。 强大软件功能 安捷伦 ICP-MS 配备强大的全新 MassHunter 软件平台以及成熟的适用于食品安全国标测试方法的 e-Method,方便用户直接调用,简化了方法开发流程。 LC 与 ICP-MS 联用技术需要仪器间协同工作,安捷伦系统采用新一代 MassHunter平台,将 LC的控制和色谱数据处理模块完美集成到 ICP-MS 的软件平台中。无需切换界面,即可在同一软件中进行联用方法的分析。 MassHunter 软件集成液相控制功能模块 安捷伦 ICP-MS 产品在食品多元素检测领域中的应用文集 应用简报 Agilent食品检测与农业Trusted Answers 使用气溶胶稀释进样-Agilent 7800ICP-MS 检测酱油中的26种元素 作者 摘要 吴丹 北京化工大学 郭伟、冯旭、吴春华 本文采用 Agilent 7800 ICP-MS 与高基质进样系统 (HMI)相结合,建立了对酱油中的26种元素进行分析的 ICP-MS 方法。此方法参照《食品安全国家标准食品中多元素的测定》(GB 5009.268-2016),绝大部分元素回收率结果在90.0%-110.0%的范围内。各元素长期测试稳定性良好,2小时内各元素RSD<3%, 完全满足酱油样品多元素检测的要求。 酱油是一种常用的调味品。 《食品国家安全标准食品中污染物限量》(GB 2762-2017) 要求对酱油中的铅(Pb)、砷(As)等重金属进行检测,并规定了相应的污染物限量。2017年6月23日起实施的《食品安全国家标准食品中多元素的测定》 (GB5009.268-2016)中推荐使用 ICP-MS 对酱油等调味品中的金属元素进行测定。 酱油产品基质复杂,总溶解固体量 (TDS) 通常高达10%以上,其中包括 Na、K、Mg、Ca、Fe 等无机盐类以及蛋白质、氨基酸、脂肪等有机成分。复杂 TDS 基质对 ICP-MS 信号存在明显的抑制作用,对 ICP-MS 的基质耐受性带来极大的挑战。酱由中大量溶解性固体及由此产生的碳可能沉积到雾化器喷嘴和取样锥孔,导致响应信号强度降低,并对仪器产生一定损害。高浓度无机盐类等物质不仅会引起严重的电离抑制,而且会产生多原子离子干扰,例如23NaCl和4Ca1o对60Ni的干扰,以及“CaCl、4ArCl对75As的干扰等。在对酱油等调味品的分析中,传统上采用酸消解法进行样品前处理,这种方法耗时又费力2.3。安捷伦 ICP-MS 配备的高基质进样系统 (HMI) 或超高基质进样系统 (UHMI) 可轻松消除高基质样品带来的基质效应。通过软件自动优化 HMI或 UHMI稀释倍数,利用高纯气体对整批混合样品进行在线稀释,能够极大增强直接分析高盐复杂样品的能力。利用HMI 可耐受 TDS高达3%,利用 UHMI 可耐受 TDS 含量可达25%, 而传统 ICP-MS 的基质耐受能力仅为 TDS<0.2%。 根据 GB 5009.268-2016中推荐的仪器参数,可采用配备低温雾化室的安捷伦 ICP-MS。该系统的低温雾化室能够将温度精确控制在2℃,有助于更稳定地控制气溶胶,并最大程度避免了因引入等离子体中的大量水汽,而造成等离子温度下降。 GB 5009.268-2016 对大部分元素的分析推荐采用碰撞反应池。安捷伦 ICP-MS 第四代八极杆碰撞反应池 (ORS)借助八极杆强大的离子约束传输功能和采用专利屏蔽屏 (STS) 技术的离子动能约束功能,能够充分发挥氦气碰撞模式中的动能歧视效果,完全消除不同基质中的多原子质谱干扰。 本文参照 GB 5009.268-2016,利用 Agilent 7800 ICP-MS 的 HMI功能对酱油样品中的B、Na、Mg、Al、K、Ca、Ti、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Se、Sr、Mo、Cd、Sn、Sb、Ba、Hg、TI、Pb等26种元素进样分析,可获得准确可靠的测定结果。 试剂和样品 实验样品:市售的生抽酱油及老抽酱油。 硝酸:优级纯; 超纯水:标准品购于安捷伦科技有限公司。所有器皿在使用之前均用5%硝酸浸泡过夜。 仪器和设备 采用配备标准镍锥、玻璃同心雾化器和 HMI气溶胶稀释组件的Agilent 7800 ICP-MS, 配备 MassHunter 4.3。 标准溶液配制 利用安捷伦科技公司提供的 Li、Sc、Ge、Rh、In、Tb、Lu 和 Bi等8种元素浓度为 1000 pg/mL单元素标准溶液,使用含5% HNOs配制成浓度为 1.0 pg/mL的内标混合溶液。使用5% HCI溶液对安捷伦公司 Hg 元素标品品进行适当稀释,从而得到浓度分别为0.1 ng/mL、0.5 ng/mL、1 ng/mL、2 ng/mL 的系列 Hg元素标准 溶液;按照上述方法,使用5%HNO, 溶液对安捷伦公司单元素标准品进行适当稀释,从而得到其其25种元素的混合标准溶液系列。对于K、Na、Ca、Mg、Fe等5个元素,浓度分别为 0.05 ug/mL、0.1 pg/mL、0.5 pg/mL、1 pg/mL、5 pg/mL、10 ug/mL、20 pg/mL、50 ug/mL;其它元素浓度为: 0.5 ng/mL、1 ng/mL、5 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、500 ng/mL。 样品前处理 采用质量法稀释,取生抽酱油 1.0g于塑料离心管中,利用5%HNO溶液定容至10.0g;取老抽酱油0.2g,利用5% HNO溶液定容至10.0 g, 混匀待测。 ICP-MS 条件 表 1.ICP-MS工作参数 参数 设定值 参数 设定值 RF 功率 1550W 元素积分时间 0.1s 等离子体气 15L/min HMI倍数 4 载气流速 0.5 L/min 样品提升速率 0.3 g/min 稀释气流速 0.6 L/min He 池气体流速 4.5 g/min S/C 温度 2.0°C 采样深度 10.0 mm 在基质复杂的酱油样品分析中,选用预设等离子体设置HMI-L(气溶胶稀释约4倍),可提供足够高的稳定性和耐受性。所用仪器参数如表1所示。所有透镜电压均采用仪器自动调谐功能进行了优化。 校准曲线及检测限 分别通过标准空白进样10次 SD*3 计算得到26种元素的检测限(DL)。如表2所示,各元素检测限满足GB 5009.268-2016的要求。各种元素的质量数、校准曲线线性(以相关系数R 来衡量)也列于表2中,典型校准曲线如图1-4所示。 表2.各元素检测限及校准曲线线性 元素 47 Ti 51V 52 Cr 59 Co 60 Ni 63 Cu 75 As 78 Se 66 Zn 88 Sr 95 Mo 111 Cd 118 Sn DL(ng/mL) 0.015 0.0019 0.042 0.0027 0.015 0.021 0.015 0.078 0.0092 0.0025 0.0047 0.00026 0.010 相关系数R 0.9999 0.9998 0.9992 0.9998 0.9997 0.9996 0.9997 0.9999 0.9998 1.0000 0.9991 0.9997 0.9991 元素 121 Sb 137 Ba 205 TI 208 Pb 201Hg 11B 23 Na 24 Mg 27 Al 39 K 44 Ca 55 Mn 56 Fe DL(ng/mL) 0.0041 0.0048 0.00080 0.0071 0.0090 0.34 0.089 0.013 0.077 0.29 0.084 0.033 0.011 相关系数 R 0.9994 1.0000 0.9998 0.9999 0.9999 0.9995 0.9997 0.9992 0.9996 0.9996 0.9991 0.9994 0.9992 图 1. 208 Pb标准曲线 图2.52Cr标准曲线 23 Na [He] ISTD: 103 Rh [He] y=0.0383*x+0.1099 R=0.9997 检测限=0.08873 ppm BEC=2.87 ppm 图3.23Na标准曲线 图4.78Se 标准曲线 样品测定结果与回收率 将酱油稀释液进样分析。稀释倍数换算后的原样品中的元素测定结果如表3所示。为考察方法的可靠性,对每个样品进行加标回收率实验。加标浓度根据元素含量确定,其中Hg 的加标浓度为1 ug/kg, B、Al、Zn、Mn 的加标浓度为200 pg/kg,其余元素的加标浓度均为 20 pg/kg。将加标样品连续进样6次,计算加标回收率,并以 %RSD 衡量测试稳定性,结果列于表3中。其中,生抽、老抽样品中的K、Ca、Na、Mg、Fe含量过高,未进行加标回收率实验。 表3.酱油样品测定结果及加标回收率 元素 47 Ti 51V 52 Cr 59 Co 60 Ni 63 Cu 75 As 78 Se 66 Zn 88 Sr 95 Mo 111 Cd 118 Sn 生抽样品测定结果(pg/kg) 35.1 12.1 27.8 14.0 0.99* 18.7 6.9 12.3 4.3* 0.99* 80.8 3.6 3.9 稀释10倍后加标浓度(ug/kg) 20 20 20 20 20 20 20 20 200 20 20 20 20 生抽样品回收率(%) 100.2 100.4 96.5 91.7 90.5 91.8 91.4 91.6 94.1 108.3 108.6 97.0 108.1 RSD%(n=6) 0.4 1.0 1.6 1.8 0.2 1.6 1.5 1.0 1.1 0.1 1.1 2.6 1.3 老抽样品测定结果(ug/kg) 52.0 13.5 35.5 19.0 1.2* 41.5 12.0 25.5 4.6* 1.45* 0.16* 5.0 11.0 稀释50倍后加标浓度(pg/kg) 20 20 20 20 20 20 20 20 200 20 20 20 20 老抽样品回收率(%) 105.3 106.8 99.3 94.7 94.6 92.3 108.7 98.4 92.1 99.3 102.5 92.3 104.6 RSD%(n=6) 0.2 1.2 2.0 1.4 0.4 2.1 1.0 1.5 0.8 0.7 0.8 1.6 1.4 元素 121 Sb 137 Ba 205TI 208 Pb 201 Hg 11B 23 Na 24Mg 27 Al 39 K 44 Ca 55Mn 56 Fe 生抽样品测定结果(rg/kg) 4.4 0.62* 9.0 9.1 0.40 3.0* 5.1** 0.44** 0.93* 0.29** 137** 4.7* 8.1* 稀释10倍后加标浓度(ug/kg) 20 20 20 20 1 200 \ \ 200 \ \ 200 \ 生抽样品回收率(%) 107.2 108.0 94.5 90.8 100.0 109.5 \ \ 101.7 \ \ 92.0 \ RSD% (n=6) 2.7 0.5 0.8 0.1 3.8 3.2 \ \ 3.3 \ \ 1.7 \ 老抽样品测定结果(pg/kg) 9.5 1.10* 19.0 8.5 0.50 5.8* 11.6** 40.7* 18.7* 0.35** 177* 6.4* 13.0* 稀释50倍后加标浓度(pg/kg) 20 20 20 20 1 200 \ \ 200 \ \ 200 \ 老抽样品回收率(%) 104.1 106.1 99.1 95.5 103.5 114.9 \ \ 101.0 \ \ 100.7 \ RSD%(n=6) 1.7 0.6 1.1 1.4 2.7 2.4 \ \ 1.1 \ \ 1.2 \ 注:*单位为 mg/kg; **单位为% 长期测定稳定性 为考察系统对高盐样品的耐受能力,将样品稀释后加入浓度为20 pg/kg 的标准品溶液,连续进样分析2小时以检验系统的稳定性。结果如图5和图6所示,所有元素的峰面积RSD 值均在3%以内。 图5.连续测定生抽样品2小时系统稳定性结果 图6.连续测定老抽样品2小时系统稳定性结果 本文采用配备高基质进样系统(HMI) 的 Agilent 7800 ICP-MS,通过气体在线稀释,建立了一种准确、稳定地测定酱油样品中26 种元素的方法。该方法对于盐分含量较高的酱油样品,只需经过简单稀释即可直接进样分析,无需进行消解。另外,由于气体在线稀释法大大降低了氧化物干扰,即使采用较高的气体稀释倍数,仪器信号受到的影响也很小。仅用单 He 模式即可消除多原子干扰,并提供可靠的测定结果。样品测试结果稳定可靠,各元素标准曲线R>0.9990,线性相关性良好。本方法满足GB5009.268-2016 的检测要求。 ( 1. GB 5009.268-2016《食品安全国家标准食品中多元素的测定》 ) ( 2 . 林立、陈玉红、田艳玲等 , 电感耦合等离子体质谱法直接测 定酱油中的铅。环境化学,2007,26(3):410-412 ) ( 3. 汪晓冬,微波消解-电感耦合等离子质谱法对8种市售酱油无 机元素的分析。食品研究与开发,2010,31(11):159-161 ) 增强ICP-MS 对食品样品的分析能力 为了保障食品安全和人类健康,对各种类型食品中的元素组成进行准确表征是非常必要的。由于不同类型食品中各种元素浓度范围差异很大,因此需采用多样的检测技术对样品进行表征。本文中,我们探讨了只使用一套安捷伦 ICP-MS 对所有必要的元素进行测定的可能性。 Agilent 7700 ICP-MS 和 Agilent 7800 ICP-MS 分别配备了具有9和10个数量级动态范围的检测器,为痕量元素和主要元素的同时测定提供了可能。 等离子体和样品基质所产生的干扰问题是食品分析中的另一大挑战。本研究使用单一的池气体——氦气,对干扰消除能力进行了研究。 我们也研究了不连续取样系统提高样品通量的性能。采用安捷伦ISIS-DS不连续取样系统,对其通过最小化分析过程中的溶液吸取和冲洗时间以减少样品总体分析时间的能力进行了评估。 标准品和样品前处理 作为该项工作的一部分,对四种认证标准物质 (CRM) 进行了分析。这四种标准物质分别为 NIST SRM 1548a(典型食物,美国)、NIST SRM 2976(贝类组织)、NRC DORM3(鱼肉组织,加拿大)和 NIST SRM 8415(全蛋)。取每种 CRM 各250 mg,加入3mL硝酸和1mL过氧化氢进行微波消解(详情见表1)。消解后的样品用去离子水定容至 50mL,最终所得样品的基质农度在 5 g/L 以内。使用 6% HNO。 和 0.5% HCI 稀释多元素标准品溶液配制浓度范围为 1-50 pg/L(用于主要元素测定时浓度还要提高100倍)和0.5-5pg/L (用于Hg元素测定)的系列校准溶液。标准品基质与样品基质无需匹配。 表1.食品 CRM 样品的微波消解详细程序 步骤 时间(分钟) 功率(W) 1 10 280 2 5 0 3 10 550 4 5 0 5 6 720 6 7 0 7 10 280 ( 仪器 ) 采用 Agilent 7700x ICP-MS 进行所有测定,该系统拥有特色的第三代八极杆反应系统 (ORS),并配备了标准样品引入系统(MicroMist玻璃同心雾化器、石英 Peltier 冷却雾化室、具有2.5 mm内径喷嘴的石英炬管)。氧化物比值设定为 0.8% (CeO*/Ce*), 从而实现样品在等离子体内的高效分解以及最小的基质效应。为了抑制干扰, ORS°体系只在氦气碰撞模式下工作,能够通过动能歧视(KED) 原理将等离子体和基质来源的多原子干扰去除。表2中中结了仪器的操作条件。 表 2. Agilent 7700x ICP-MS 操作参数 参数 数值 等离子体功率 1550W 等离子体气体流速 15.0 L/min 辅助气流速 1.0 L/min 载气流速 0.89 L/min 稀释气流速 0.15 L/min 采样深度 8.0mm 雾化室温度 KED 3V 氦气流速 4.5mL/min ( 与反应性池气体相比,氦气模式在食品样品分析方面具有多种关 键优势 ) ( -氦气模式能够对所有多原子干扰进行有效去除,不只是去除活性多原子干扰 ) ( - 因为氦气是惰性的,因此除基质因素外并不会产生新的干扰 ) 与反应性池气体不同,氦气不会与其他分析物发生反应,从而确保了分析的一致性和可预测性 不受多原子干扰影响的元素的测定也可以使用氦气模式。但是,为了获得更好的检测限,采用无气体模式对其进行测定。在样品测定过程中,系统可以根据需要自动在无气体模式和氦气模式之间进行转换,从而实现在最佳条件下对所有元素进行测定,避免了对某一待测样品进行多次测定的麻烦。模式间的切换非常迅速(约5秒),因此样品通量不会受到明显影响。 ISIS-DS 不连续取样系统 图1是安捷伦 ISIS-DS 系统的基本操作示意图。初期方法建立后,该系统能够大幅提高样品通量。首先样品被高速 ISIS 泵 (P1)迅速吸取至进样环中,同时空白载气和在线内标被持续泵入雾化器中(P2)。然后旋转6通阀将载气切入进样环,推动样品进入雾化器。与此同时,自动进样器针头进入淋洗位置,并在下一个样品开始前进行淋洗。 ISIS-DS 为该分析提供了以下多种优势: -样品吸取和淋洗时间显著缩短,从而实现了非常快速的分析 ( -降低了 ICP-MS 采样锥和透镜在样品基质中的暴露时间,从而增强了仪器的长期稳定性 ) -由于去除了进样路径中的蠕动泵管线,减少了样品残留-减少了进样系统的维护和清洗 图1.安捷伦 ISIS-DS 不连续取样系统的工作原理 表3.校准曲线的详细数据。R表示的是线性相关系数。DL 是以空白信号标准差的3倍计算所得的检测限 质量数 元素 调谐步骤 R 检测则(ppb) 23 Na He 0.99998 0.16 24 Mg He 0.99991 0.031 27 Al He 0.99987 0.23 39 K He 0.99989 1.8 44 Ca He 0.99999 5.7 47 Ti He 0.99975 0.041 51 V He 0.99985 0.013 52 Cr He 0.99992 0.0038 55 Mn He 0.99991 0.0018 56 Fe He 0.99996 0.021 59 Co He 0.99997 0.0014 60 Ni He 0.99996 0.0039 63 Cu He 0.99997 0.103 66 Zn He 0.99989 0.017 75 As He 0.99983 0.0084 78 Se He 0.99979 0.038 95 Mo 无气体 0.99998 0.0022 107 Ag 无气体 1.00000 0.016 111 Cd 无气体 1.00000 0.0007 118 Sn 无气体 1.00000 0.0028 121 Sb 无气体 0.99999 0.0005 137 Ba 无气体 1.00000 0.0020 201 Hg 无气体 0.99960 0.0030 208 Pb 无气体 1.00000 0.0013 图2.食品 CRM 样品分析得到的典型校准曲线 干扰抑制 首先进行了样品初测,以评估单独使用氦气模式测定时对干扰的抑制效果。对 CRM 样品中各元素的多个同位素进行了监测和比较,结果见表4。 表4.元素与其同位素浓度测值比较(ug/L) DORM3 SRM2976 SRM8415 SRM1548a 24 Mg 2781.99 22407.90 1501.30 2717.79 26 Mg 2749.48 23311.89 1531.20 2660.32 差异度(%) 1 -4 -2 2 43 Ca 6249.01 35189.24 10744.70 7489.41 44 Ca 6511.34 34589.19 11192.78 7532.89 差异度(%) -4 2 -4 -1 47 Ti 142.90 21.38 43.91 10.91 49 Ti 152.40 22.49 42.85 11.40 差异度(%) -7 -5 2 -5 52 Cr 6.72 2.65 2.16 0.57 53 Cr 6.74 2.58 1.99 0.42 差异度(%) 0 3 8 27 56 Fe 1150.83 990.14 576.99 182.53 57 Fe 1109.94 966.56 564.96 180.04 差异度(%) 4 2 2 1 60 Ni 4.46 4.39 1.11 5.48 62 Ni 4.45 4.45 1.10 5.44 差异度(%) 0 -1 1 1 63 Cu 49.67 19.86 15.23 11.61 65 Cu 49.50 19.83 15.16 11.60 差异度(%) 0 0 0 0 如表4中的数据结果所示,不同同位素得到的浓度值高度一致,从而证实氦气模式测定对不同基质中的多元素干扰的有效抑制。相反,在单四极杆 ICP-MS系统中, H,或NH。等反应性气体是不能够被用于同时消除多种同位素所受的未知多元素干扰的。利用多种同位素对同一种元素进行定量,对比所得数据,得到了高度一致的结果,说明测得的元素含量并未受到任何干扰的影响。7700/7800 ICP-MS 是目前唯一能够只使用氦气有效抑制多种同位素受到的多元素干扰的系统。 方法验证 表5比较了每种 CRM 样品的测定值与认证值的最终结果。 所有 CRM 中各元素的浓度测定值都与认证值极好地吻合,包括了主要元素 (Ca、K、Mg或 Na)、受干扰元素(As、Se 和Fe等)以及不受干扰元素(Hg、Pb等)。这个结果充分证实了Agilent 7700x ICP-MS 系统能够通过单次分析出色的实现各种食品类型中不同浓度水平的多种元素的测定。 食品分析中不连续进样装置的应用 在使用 ISIS-DS 之前,上述方法中单个样品分析时间为5分钟。使用 ISIS-DS 系统之后,整个样品分析时间缩减为1.2分钟。ISIS-DS能够显著缩小单个样品的分析时间,但是对系统的其他性能不会产生负面影响,如不会影响氦气模式下的消除干扰能力,对广泛食品样品中痕量元素、主要元素和受干扰元素的同时测定能力。表6总结了ISIS-DS方法所用的参数。 SRM 1548a 典型食物 SRM 2976 肌肉组织 DORM3 鱼组织 SRM 8415全蛋 测量值 认证值 测量值 认证值 测量值 认证值 测量值 认证值 Na 8459 8132+-942 3.4 3.5+-0.1* - - 0.317 0.377* Ca 1869 1967+-113 0.73 0.76+-0.03* - 0.235 0.248* Mg 603 580+-26.7 0.48 0.53+-0.05* - - 297 305 K 6684 6970+-125 0.99 0.97+-0.05* - - 0.319 0.319* Al 73.5 72.4+-1.52 140 134+-34 - 563 540 As 0.21 0.20+-0.01 14.9 13.3+-1.8 6.61 6.88+-0.30 0.015 (0.01) Cd 0.035 0.035+-0.0 15 0.79 0.82+-0.16 0.284 0.290+-0.020 0.001 (0.005) Cu 2.57 2.32+-0.16 4.09 4.02+-0.33 15.9 15.5+-0.63 3 2.7 Cr - 0.54 0.50+-0.16 2.15 1.89+-0.17 0.42 0.37 Fe 40.4 35.3+-3.77 204 171+-4.9 368 347+-20 114 112 Ni 1.21 0.369+-0.023 0.90 0.93+-0.12 1.42 1.28 +-0.24 - - Pb 0.12 0.044+-0.009 1.14 1.19+-0.18 0.39 0.395+-0.050 0.059 0.061 Se 0.259 0.245+-0.028 1.76 1.80+-0.15 - - 1.45 1.39 Sn 14.3 17.2+-2.57 0.12 0.096+-0.039 0.10 0.066+-0.012 - Zn 23.3 24.6+-1.79 144 137+-13 47.5 51.3+-3.1 65.8 67.5 Hg 0.104 0.061+-0.0036 0.412 0.409+-0.027 - - 参数 数值 载入时间 12 s 载入速度 1.0 rps 针头清洗时间 6s 针头清洗速度 0.2 rps 清洗后时间 10 s 清洗后速度 0.5s 食品样品的基质非常复杂,是一类挑战性非常强的元素分析样品。尤其是试图利用单一分析技术分析这类基质组成复杂、元素浓度范围宽以及存在潜在基质干扰的样品时,这种挑战性就更加突出。使用标准设置,以无气体模式和氦气模式运行的 Agilent7700x ICP-MS 被证实能够简单且准确地测定多种食品认证标准物质中的所有标定元素。它可以实现高灵敏度测定和ppt (ng/L)级的低检测限,同时还具有高动态范围,能够测定高 ppm 级元素。ISIS-DS 不连续进样装置的使用不会对仪器测定方法的性能产生负面影响,却能够显著降低单个样品测定时间(由5分钟缩减为1.2分钟)。 作者 ( Fabio F. Silva ) 采用 ICP-MS 的集成进样系统-不连续进样(ISIS-DS)对茶叶浸泡液中的13种痕量元素进行直接分析 茶叶因其抗氧化活性以及含有一些微量营养素,比如矿物质、黄酮类以及儿茶酚,使其消费日趋增长,因此对经过浸泡的茶叶、花或根部的前处理液的分析具有重要科学价值。已有研究表明,草本植物中存在潜在的有毒和累积性物质,如无机污染物2。这些污染物源自草本茶生产过程中的各个环节,也包括土壤、水、肥料以及工业排放的大气3。根据其浓度的不同,潜在的有毒元素对人体健康损害程度也有所不同,轻则肝脏和肾脏机能障碍,重则致癌。不过,茶叶中的污染物并不是都能被浸泡出来。大多数残留有毒物的浓度很低,因此降低了饮茶所带来的风险。 评价茶叶浸泡液中痕量多元素浓度最常用的方法之一就是一样品消解后用 ICP-MS 检测。这种方法需要微波消解系统和试剂,比如浓酸和氧化剂。整个过程中,样品的稀释因子可能达到10-100倍。这种方法需要较长的运行时间和过量的试剂,因此往往导致方法的检测限较差。反之,直接分析法也会使性能大打折扣,比如精度和长期稳定性下降、残留物积聚以及维护成本增加等。 用于 7700x/7800 ICP-MS 的安捷伦集成进样系统 (ISIS)配件采用不连续进样(DS)模式进行直接分析。其优点在于样品消耗量准确,避免了在 ICP-MS 进样系统中引入不必要的样品。而且,DS模式能够保持仪器性能,当配合使用独特的 ORS和 He 碰撞童体时,将实现高速分析。 采用惰性碰撞气体(氦气)高效运行的碰撞池与不连续进样之间的协同作用有利于获得优异的检测限、精度和通量等卓越性能。本应用简报通过证实氨碰撞模式与不连续进样结合的优点,建立了一个简单易用、无多元素干扰的茶叶浸泡液中13种元素的测定方法,并对其进行了验证。 实验 Agilent 7700x ICP-MS 系统配备带标准样品引入系统的安捷伦I-AS自动进样器,样品引入系统中包括 MicroMist 玻璃同心雾化器、石英双通道雾室、带稀释端口的连接管、2.5 mm内径的石英炬管和标准镍锥。使用设置一个蠕动泵和一个6通切换阀的ISIS 附件实现不连续进样 (DS)。不连续进样与 ICP-MS 结合后,系统只输送所需要的样品量,这不仅使运行时间以及样品负载量降至最低,而且也提高了生产率并进一步改善了长期基质耐受性。 ISIS-DS 可使用预配置的 ISIS 管线工具包,从而简化安装和使用过程。 图1为 ISIS-DS 系统的工作原理图。虽然系统中有内标和载体溶液的连续液流,但样品仍在6通阀的载样位置填充定量环。随后,阀切换至进样位置,使载体溶液通过样品定量环,使其推动样品进入雾化器中。 有关 ISIS-DS操作的详细信息,请参见之前的文献4.5。 使用ICP-MS MassHunter 软件按照食品和临床应用预先设置的方法进行 7700x的调谐。本方法使用了无气体、氦气和 HEHe 模式,调谐条件列于表1。 校准时,将13种元素分为两组::一组是低含量范围(0、0.1、0.5、、1、5、10和100 pg/L), 包括 As、Cd、Cr、Cu、Hg、Ni、Pb 和 Se。另一组是较高含量范围(0、10、100、250、500、1000和2000 pg/L), 包括 Al、Ba、Fe、Mn和Zn。两条分析曲线的样品均在0.2% v/v HNO,中配制。方法中不需要进行基质匹配或重新校准。内标混合溶液含有 Sc、Ge 和Y, 各浓度均为250 pg/L, 在线加入。 初始校准后,连续测定分析空白溶液10次,用其标准偏差(s)计算检测限(DL=3×s)和定量限(QL=10xs)。利用变异系数(n=16的CV)计算重复性。由于缺少这类基质的有证标准物质,因此采用分析物加标的回收率评价方法的准确度。为了获得精度和准确度,向样品浸泡液中加入不同浓度的分析物:As、Cd、Cr、Cu、Hg、Ni、 Pb 和 Se (浓度为10和50 pg/L) ; Al、 Ba、Fe、Mn和Zn (浓度为250和500pg/L)。 图1.在 DS 模式下运行的 ISIS:阀处于载样位置(A)和进样位置(B) 表 1. Agilent 7700x ICP-MS 和 ISIS-DS操作条件 Agilent 7700x参数 RF功率 1550W 载气流速 1.1 L/min 元素/内标数量 13/3 重复/峰型模式/吹扫 3/3/100 读取时间 60s 池调谐模式 无气体/He/HEHe 不同模式之间转换时间(无气体/He/HEHe) 5s HEHe 模式下的 He池流量 10 mL/min HEHe 模式下的动能歧视 7V He 模式下的 He池流量 5 mL/min He 模式下的动能歧见 5V 安捷伦 ISIS-DS 参数 定量环体积和尺寸 150/30 (pL/cm) 提升时间 20 s 采集延迟 20s 冲洗时间 采集时预取样清洗 使用四种不同种类的茶叶(见表2)验证了方法性能。本研究试验了三种来自本地市场不同商标的茶(2013 Campinas, SP-Brazil),每个牌子的茶叶,配制三种浸泡液。浸泡液的前处理如下:1.5g样品(相当于一个商品茶叶袋)在200mL去离子水(18.2 MQ.cm)中煮沸3分钟。冷却后将浸泡液酸化 (HNO:0.2%v/v), 然后通过250 um 的高分子膜过滤并转移到自动进样器样品瓶中。 表2.方法应用中的茶叶样品 蜜蜂花 香蜂花叶 茴香 茴芹果 花和果 苹果果 玫瑰茄花 狗蔷薇花和果 酸橙果皮 柠檬果皮 甜叶菊 红色 野茶树的茎和叶 这种应用的常规方法要求高通量、低检测限和低变异系数。以下将讨论所有这些性能数据。 生产率和稳定性 在一个分析流程中,样品前处理是最耗时的步骤之一。直接进样法取代常规的消解法,分析时间大大缩短。 Agilent 7700/7800ICP-MS 的部分标准配置,如 MicroMist 雾化器、珀尔帖冷却双通道雾室、高基质进样(HMI) 系统、宽直径(内径2.5mm)炬管中心管以及固态 RF (27 MHz) 发生器,为本研究所用挑战性基质的分析提供稳定性能起到了重要的保障作用。这些配置创造了一个非常稳定的等离子体,其 CeO*/Ce* 值低于 1.5%。即使具备了这样稳定的等离子体性能,但对于长时间的茶叶样品直接引入,可能也会引起采样锥的堵塞以及内标的不稳定问题。这将需要维护,并且还要停工进行清洗或更换进样部件。采用 ISIS-DS,将引入到 ICP-MS的样品量减少为1/4-1/3,从而解决这些问题,增强系统的稳定性。从图2显示的2小时期间内标的波动曲线可以估算系统的稳定性。 图2.所有样品校准空白归一化的内标回收率 就每个样品的总分析时间(样品提升、稳定、读数和清洗时间)进行比较, DS-ICP-MS 比常规 ICP-MS缩短了30%的运行时间(136秒对197秒)。这只有通过 DS 模式下的 ISIS 才能达到。当然, ORS°的作用也很重要,因为它仅使用不同的氦气模式(普通He 模式和 HEHe模式)就可以解决几乎所有多原子干扰,并且其容量很小,可在大约5秒内实现无气体、He 和 HEHe模式之间的转换。分析人员在同一个方法中可以选择多种模式,分析时间不会明显增加。 就食品质量控制而言,有些元素可能是有毒污染物,如Al、As、Ba、Cd、Hg、Ni 和 Pb;有些元素则是营养元素,如 Fe、Mn 和Zn;或乃至二者皆备者,如 Cu、Cr 和 Se。通常,样品中污染物的含量很低,而营养元素可能含量较高。这是食品分析要面对的一种挑战,因为很难用单一的仪器在单一的方法中兼顾不同的浓度范围。 Agilent 7700/7800 ICP-MS 的双级检测器对于所有这些不同浓度范围都能够获得线性(R)大于 0.9999 的校准曲线。 检测限、精度和回收率 表3.分析条件和性能测试 茶叶样品的直接分析使样品处理最小化,降低了化学处理所带来的污染和毒害风险。而且,该方法不需要稀释,因此改善了检测限。池模式之间的快速转换使用户能够在三种不同的调谐模式之间选择最适宜的一种模式进行分析。以52Cr*为例,它会受c40Ar*的严重干扰,但是在本应用中,利用 He 模式就可轻松对Cr 进行定量;而茶叶浸泡液分析中,202Hg*+没有多原子干扰,可以在无气体模式下直接测定。这种特性降低了检测限。降低检测限的另一个挑战是来自非控制环境中潜在的污染物。受此影响的元素包括 Al、Cu、Mn 和Zn。表3给出的是检测限、定量限和其他性能指标,以及所研究分析物的最佳分析条件。 使用本方法提出的条件,精度可以保持在20%以内,回收率介于82%-121%之间。 限度(pg/L) 精密度 回收率(%) 同位素 反应池 ISTD 检测限(3s) 定量限(10s) (%) 浓度1 浓度2 27Al He 72Ge 6 20 13 103±5 99±3 52Cr He - 0.09 0.29 17 85±1 91±1 55Mn He 72Ge 0.11 0.38 11 87±4 89±6 56Fe HEHe 72Ge 0.66 2.2 8 85±4 92±3 60Ni He - 0.63 2.1 10 82±1 89±1 63Cu - 72Ge 0.51 1.7 2 95±5 92±1 66Zn He 72Ge 10 35 15 95±6 95±3 75As HEHe 89Y 0.14 0.46 4 96±2 104±2 80Se HEHe 0.15 0.50 3 106±2 110.5±0.4 111Cd 一 72Ge 0.016 0.053 4 99±1 100±1 138Ba He 72Ge 0.60 2.0 12 110±8 111±3 202Hg - 45Sc 0.10 0.34 9 111±4 121.0±0.4 206Pb HEHe 72Ge 0.12 0.39 6 112±3 113±2 样品分析 优化分析条件并评价方法性能之后,对选定的四种不同茶叶的三个样品进行了分析,每个样品一式三份,用于验证该方法对实际样品分析的可行性。表4列出了分析结果。 数据表明了本方法的可行性,使用不连续进样系统 ISIS-DS(没有样品稀释)对几个浓度非常低的元素进行定量,包括那些对人体健康存在危险的元素(比如As、Cd、Cr、Hg和Pb)。 结果表明,不同茶叶浸泡液之间元素浓度范围变化很大。红茶的浸泡液中, Al、As、Cr、Mn、Ni 和 Pb 的浓度最高。然而,所测定的样品元素浓度值均没有超出 Resolution 12/11 国家限定的最高值:600pg As/L、600 pg Pb/L、400 pg Cd/L"。 表4.所分析茶叶浸泡液的平均结果和浓度范围 平均结果和范围(n=3, pg/L) 元素 蜜蜂花 茴香 花和果 红色 Al ND<20 32 (31-34) 28(24-32) 954 (882-1033) As ND < 0.46 ND <0.46 0.18 (ND<0.46-0.53) 0.76 (ND<0.46-1.8) Ba 16(8.2-21) 7.7(7.0-8.1) 103(89-111) 15(13-20) Cd 0.093(ND<0.053-0.21) ND< 0.053 0.021 (ND<0.053-0.063) ND<0.053 Cr ND<0.29 ND<0.29 0.33 (ND<0.29-0.53) 0.66(0.58-0.74) Cu 7.7(5.2-9.2) 21 (19-22) 9.8(6.1-13) 6.3(4.5-9.7) Fe 18 (11-24) 53(27-70) 91(70-102) 65(47-81) Hg ND<0.34 ND<0.34 ND<0.34 ND<0.34 Mn 509 (157-896) 56(47-62) 405 (357-434) 1020(951-1131) Ni ND<2.1 ND<2.1 3.2(2.1-4.5) 19(16-22) Pb 0.43 (ND<0.39-0.86) ND<0.39 0.22(ND<0.39-0.65) 0.78 (ND<0.39-1.3) Se ND<0.50 ND<0.50 ND<0.50 ND<0.50 Zn 21 (ND<35-62) 42(37-46) ND<35 30 (ND<35-45) *ND=未检出 结论 本应用简报介绍了一种采用 ISIS-DS 直接分析茶叶浸泡液中13种潜在毒性元素和营养元素总浓度的分析方法的建立和验证。该方法的显著优点是减少了循环时间和样品处理。所有13种元素的痕量值都低于已发布的法规限量。 本方法具有很好的精度和准确度,可以用于检测茶叶浸泡液,也可以用于其他饮料样品比如咖啡和果汁。 ( 1.F R . Bunkova, 1 . Marova, M. Nemec "Antimutagenic propertiesof green tea" Plant Foods for Human Nutrition 60:25-29, 2005 ) ( 2. T .Karak,R.M.B h agat "Tr a ce elements in tea leaves, madetea and tea infusion: A review" Food Research I nternational 43:2234-2252,2010 ) ( 3. W.Y. Han, M.A.L . F . Shi Yz, J.Y. Ruan "Arsenic, cadmium,chromium, cobalt, and copper in different types of Chinese tea" Bulletins of Environmental Contamination and Toxicology75:272-277,2005 ) ( 4 . S. Wilbur 和 C. Jones, "Maximizing Productivity in HighMatrix Samples u s ing the Agilent 7700x I C P-MS with IS I SDiscrete Sampling: EPA 6 020A Compliant Analysis i n LessThan 2 Minutes per Sample”(使用带 ISIS 不连续进样系统的 Agilent 7700x ICP-MS 最大程度提高基质样品的分析效率: 按照 EPA 6020A可在2分钟内完成单个样品的分析),安捷伦科技公司出版物 5990-5437EN ) ( 5. S . Wilbur, T. Kuwabara, and T . Sakai, " HighSpeedEnvironmental Analysis Using t h e Agilent 7500cx withIntegrated Sample Introduction System- Discrete Sampling(ISIS-DS)" Agilent Technogies publication 5990-3678EN ) ( 6. FAO/WH0 Summary Evaluation Performed by the JointFAO/WHO Expert Committee on Food Additives (JECFA).Maastricht, The Netherlands,2012 ) ( 7. Limites Maximos de Contaminantes Inorganicos emAlimentos, Regulamento Tecnico MERCOSUL, R e solucao012/2011.Assungao, Paraguai, 2011 ) 应用带方法自动化功能的 Agilent 7900ICP-MS对食品 CRM 中的痕量金属组分进行常规测定 Kazuhiro Sakai、Junichi Takahashi 安捷伦科技公司,日本 Ed McCurdv 安捷伦科技公司,英国 监测食品中元素含量的重要性已经得到了广泛认可,而且也受到了各界的关注。定期报告食品污染使得食品生产商和监管机构对食品安全的关注度越来越高,同时也给他们带来了更大的压力,因为他们需确保开展了充分的监测以保证食品中有毒的痕量元素的浓度不会造成危害。食品中营养组分的含量也是大家关注的焦点,在某些必需元素膳食摄入不足的地区,人们提议将强化食品作为一种改善饮食的手段。食品分析的另一个应用是检查涉及食品原产地标签的欺诈,尤其是当食品价值主要依赖于其产地的时候。鉴定食品原产地的一个相对较新的方法是利用食品中的痕量元素,因为在许多情况下这些元素是产区土壤组成的特征指标。使用痕量元素鉴别原产地的典型例子包括葡萄酒、牛肉、大米、橄榄油以及果汁的分析。据报道,借助11种元素(1(Na、P、K、Ca、Co、Cu、Sr、Cd、Ce、Cs和TI)的浓度数据可区分开产自日本和产自中国的葱"。在欧洲,也有报道称利用18种元素的测定结果鉴别出了橄榄油的产地2. 随着公众对食品中金属及其他元素的作用的关注度越来越高,政府和监管机构也正在加大食品检测的力度,由于食品供应的全球化趋势,这一进程也变得日趋紧迫。由联合国粮农组织 (FAO) 和世界贸易组织 (WTO) 设立的食品法典委员会已经制定了食品生产和检测的国际食品标准、准则和操作规程,其中包括了痕量元素Pb、Cd、As、Sn 以及其他金属元素的最大允许浓度。例如, Pb在鱼中的上限浓度为 0.3 mg/kg, Cd在糙米、小麦以及土豆中的浓度必须分别低于 0.4 mg/kg、0.2 mg/kg 以及 0.1 mg/kg。 除了检测要求越来越多外,需要监测的元素范围也越来越宽,而随着人们对元素毒性的认识越来越深入,限量浓度通常也越来越低。因此,在进行日常食品分析时,人们更加倾向使用样品通量高、检测限低的快速多元素分析技术,这意味着许多食品实验室现在要考虑使用或者已经开始使用 ICP-MS 来进行食品分析。 尽管经验丰富的 ICP-MS 实验室通常能够非常轻松地执行一项新的食品分析方法,但是对于那些之前一直使用 ICP-OES 和 AAS 等技术的实验室来说,采用新的分析仪器非常具有挑战性。为了确保在日常分析中能够获得低的检测限,痕量水平分析对一般实验室规范控制的要求更为严格。另外,一般认为 ICP-MS使用起来比成熟的 ICP-OES 和 AAS 技术更难,它在为新的样品类型开发可靠的分析方法时比后两种技术要复杂得多,这是它的一个明显的缺点。选择合适的分析物同位素和内标元素需要具备一定的经验,而识别和应对潜在的干扰则需对质谱有一定的了解。ICP-MS中碰撞反应池 (CRC) 技术的引入使得大部分常见的、食品实验室样品中经常会出现的多原子干扰都能够被去除,但是在进行食品痕量分析时选择最佳池气体条件也需要一定的专业知识。 Agilent7900 ICP-MS 使用了 ICP-MS MassHunter 软件,该软件的最新版包含了全新的方法自动化功能,这个功能可简化方法开发过程,使各种经验水平的用户都能更轻松地开发出适用于各自特定类型样品的可靠方法。本文介绍了使用 Agilent 7900 ICP-MS 并采用方法自动化功能开发的方法对鱼认证参比物质 (CRM) 进行痕量元素分析。 仪器与试剂 使用配超高盐进样(UHMI)选件和H2池气体选件的 Agilent7900 ICP-MS 进行所有测量。在本应用简报中,有了 UHMI, 方法自动化可选择的等离子体模式更多,在自动方法设置时可应对的样品基质水平也就更宽。同样,7900 ICP-MS配备了 H2反应池气路后,方法自动化就能够选择 DL 更低的 H2模式。但是需注意的是, He模式下可轻松获取达到食品分析常规监测的所有元素规定限量的数据。整个实验使用的是标准样品引入系统,包括玻璃同心雾化器、石英雾化室和带2.5mm内径中心管的石英炬管。使用标准镍头接口锥。使用 Agilent ASX 520 自动进样器输送装在 50mL样品瓶中的样品。使用 Milestone ETHOS1高级微波消解系统进行食品 CRM 的消解。准确称取 0.5g样品于消解管中,然后向管中加入7 mL的 HNOs 和1mL 的 HCI。室温消解20分钟后进行微波加热消解,加热程序见表1。众所周知,样品溶液中的碳会增强某些元素,尤其是 As、 Se 和P的ICP-MS信号,但是信号增强的具体机理还不清楚3.4。如果不需要分析挥发性元素,可在敞开式酸消解时通过加热去除食品样品中的碳。但是,食品监测中通常要求测定 Hg 及其他挥发性元素,因此密闭式微波消解是 ICP-MS 样品消解的常用标准方法。本文中消解温度很高(210℃),因此在消解时可有效分解碳基质。只要确保所有样品中都含有过量的碳,比如说在线添加内标溶液时加入2%正丁 醇,便可减轻样品中残留的碳的影响。 ( 本研究使用的CRM 为购自 NRC-CNRC 的 DORM-4(鱼蛋白) 以及购自日本国家计量院 (NMIJ) 的 CRM 7402-a(鳕鱼组织)和 CRM 7403-a(箭鱼组织)。高纯试剂如68% HN03 和36%HCI(Ultrapur-10 0 级)购自日本Kanto Chemicals 公司。向安捷伦混合储备标样(4183-4682)中添加 Hg 和 Sn 的单元素标样 (SPEXCertipr e p),从而制得校准溶液。 ) 步骤 功率 (W) 温度(℃) 时间(min) 模式 1 1000 50 2 升温 2 0 50 3 保持 3 1000 120 7 升温 4 1000 120 2 保持 5 1000 210 15 升温 6 1000 210 15 保持 通风 40 水冷 60 方法建立 可在手动模式或全自动模式(适用于7900ICP-MS) 下使用 ICP-MSMassHunter 4.1中的方法自动化功能或“方法向导”功能。在所有支持的安捷伦 ICP-MS 主机均适用的手动模式下,用户需输入样品总溶解态固体浓度等信息,并选择分析物元素。然后,方法向导会针对最快的样品通量或最低的检测限优化采集参数。如果操作者对 ICP-MS 有一定的经验并且主要希望简化方法开发工作,则可对熟悉的样品类型采用该模式。 在自动模式下,方法向导会根据当前的仪器配置以及用户自带的参比样品的组成(作为方法设置的一部分进行测定)自动选择最合适的操作条件(等离子体模式和调谐条件)、分析物同位素、积分时间、池气体模式以及内标。开发新方法的工作流程如下: 1.操作者需输入目标分析物元素 2.操作者需选择下列自动进样器样品瓶位置: ·空白溶液(2%HNO3) ·安捷伦调谐溶液(用于优化) ·参比标准储备溶液(用于校准) ·可代表样品类型的待测样品溶液 3.然后,操作者需选择“快速分析(Speed)”模式或“更低检测限 (Low DL)”模式 一旦输入了上述信息,就会自动开始建立方法。工作流程示意图见图1至图3的截图。 根据调谐溶液的测定结果,计算样品的吸取和清洗时间。根据典型样品的半定量分析结果,可获得总溶解态固体 (TDS) 水平和主要的元素组成。借助测得的 TDS 水平确定合适的等离子模式(低基质、通用、UHMI-4, -8,-25),主要的元素组成则可用于识别每个分析物潜在的基质干扰并选择最合适的池模式(无气体、He、高能量(HE)He、H2)、同位素、积分时间以及内标 (ISTD)。 对于本研究中的样品,采用 UHMI-25 和 He 池模式,即适用于溶解态固体水平和基质组成未知的样品的条件对代表性样品进行全自动的初步分析。在分析样品时,根据筛选采集得到的总基质水平,使用方法自动化功能选择“低基质”等离子体模式。 以 DORM-4 CRM 作为方法向导优化分析参数时所需的“典型样品基质”。方法自动化软件选择的等离子体和离子透镜参数见表2。根据方法设置时测得的典型样品的总溶解态固体(TDS) 浓度选择等离子体模式。本研究中,消解后 TDS 水平低于 1000 ppm, 因此方法向导选择了“低基质”模式。方法向导选择的方法参数见表3(样品吸取时间和清洗时间)和表4(采集参数)。每个 ORS模式下的离子光学系统设置的优化也是自动完成的。 表2.方法自动化软件设定的参数 参数 数值 等离子体模式 低基质 ORS模式 无气体 H2 He HEHe RF 功率 1550W 取样深度 8mm 载气 1.05 L/min 提取透镜1 0V 提取透镜2 -140V He 流速 4.3 mL/min 10mL/min H,流速 6 mL/min 表3.样品吸取及清洗时间 时间 蠕动泵速 样品吸取时间 44s 0.3 rps 稳定时间 40s 0.1 rps 探针清洗时间(样品) 10s 0.3 rps 探针清洗时间(标样) 10s 0.3 rps 清洗1 40 s 0.3rps Hep Finish Cancel 表4.方法自动化选择的分析物参数(自动方法)与经验丰富的 ICP-MS化学家选择的相应参数(手动方法)的对比 测定了多种从常量到痕量水平的元素,主要关注在3种CRM中有认证参比浓度值的分析物。7900 ICP-MS获得的结果以及现有的认证值见表5。各个 CRM 的所有元素的测定值与参比值均呈现出良好的一致性。为了进一步验证方法,对某些元素开展了加标回收测试,结果见表6。可以看出,加标回收率非常出色,大部分元素的回收率介于95%-105%之间。 为了进一步确认方法向导创建的方法所使用的条件非常适合所进行的分析,我们将自动创建的方法和经验丰富的应用化学家独立开发的方法进行了比较。手动创建的方法设置(见表4)对某些分析物采用了多个同位素和多种气体模式,这是专家级的用户为确认更优模式时通常采用的方法,,不过两种方法的大体采集设置基本相同。 结论 ICP-MSMassHunter 软件的方法自动化功能所自动创建的方法在分析多种食品认证参比物质时,对所有认证常量元素和痕量元素均获得了准确结果。方法设置与经验丰富的 ICP-MS 应用化学家独立选择的基本相同。这表明方法向导能够根据当前的仪器配置和样品基质识别每个分析物最合适的同位素和积分时间,并为分析物分配最佳的池模式和内标。自动创建的方法可用于常量元素及痕量元素,涵盖食品样品中常见的分析物范围。这一方法自动化功能还可用于环境、地质、临床及制药等其他样品类型,为这些领域的常规实验室大大简化方法开发过程。 表6.加标回收率测试 单位 加标浓度 样品浓度 检出浓度 回收率% 9Be[无气体] pg/L 51 0.071 45.8 88.9 23Na[无气体] mg/L 5.1 63.7 68.9 101.3 24Mg[无气体] mg/L 5.1 4.0 9.0 97.8 31 P [HEHe] mg/L 2.5 36.5 38.6 82.8 34 S [HEHe] mg/L 2.5 42.6 45.1 96.9 39K[H,] mg/L 5.1 不适用* 不适用 不适用 40 Ca [H,] mg/L 5.1 11.8 17.1 102.3 51V[He] pg/L 51 7.5 55.4 93.2 52 Cr [He] pg/L 51 8.5 64.2 108.5 55 Mn [He] pg/L 51 15.8 65.2 96.0 56 Fe [H,] mg/L 5.1 1.7 6.8 100.1 59 Co [He] pg/L 51 1.2 53.0 100.8 60 Ni [He] pg/L 51 6.3 54.8 94.3 63 Cu [He] pg/L 51 73.5 122.5 95.3 66 Zn [He] pg/L 51 242.7 293.3 98.4 75 As HEHe] pg/L 51 33.0 84.2 99.7 78 Se [H] pg/L 51 18.2 69.0 98.9 88 Sr [He] pg/L 514 46.2 591.5 106.1 95 Mo [He] pg/L 51 1.3 50.4 95.5 107 Ag [He] pg/L 51 0.1 52.8 102.4 111 Cd [He] pg/L 51 1.5 52.4 99.0 118 Sn [H,] pg/L 0.5 0.4 0.9 96.7 121 Sb [He] pg/L 51 0.2 47.1 91.3 137 Ba [He] pg/L 51 25.1 76.9 100.7 202 Hg [He] pg/L 5.1 1.8 6.9 100.0 205 TI [He] pg/L 51 0.1 51.0 99.0 208 Pb [He] ng/L 51 1.9 53.0 99.3 232 Th [He] pg/L 51 0.9 52.7 100.8 238 U [He] pg/L 51 0.3 51.2 99.0 *未加标的样品浓度相对于加标水平来说太高了 ( 参考文献 ) ( 1.1 K aoru Ariyama, Akemi Yasui, JARQ,40, 4, 333-339 (2006) ) ( 2. C inzia Benincasa, John Lewis, Enzo Perri, Giovanni Sindona,Antonio Tagarelli, Anal. Chim.Acta,585, 366-370 ( 2 007) ) ( 3.Eri k H. Larsen,Stefan Sturup,J. Anal. At. Sp e ctrom., 9, 10, 1099-1 1 05(1994) ) ( 4 . Maurizio Pettine, Barbara Casentini, Domenico Mastroianni,Silvio Capri, Anal. Ch i m. Acta,599,2,191-198(2007) ) Courtney Tanabe美国加州大学戴维斯分校 使用 Agilent 7900 ICP-MS对牛奶和奶粉进行常规的高通量多元素分析 牛奶和乳制品是人类膳食中重要的营养来源,对婴儿和儿童更是如此。乳制品的食用范围遍布世界各地。随着人们口味的变化和收入的增加,乳制品在许多亚洲和发展中国家/地区的普及程度日益提高。为了满足日益增长的需求,乳制品产量增加的同时产品质量也显得尤为重要。通过检测 Na、K、Mg、Ca等常量元素以及 Se、P、Mn、Zn等必需元素的浓度,可以提供有价值的营养信息。另外还需要检测动物奶中的As、Cd、Sn、Hg 和 Pb等潜在的有害元素,用于监测来自土壤、肥料、饲料或加工设备的潜在污染。 由于其卓越的灵敏度、快速多元素分析和广泛的元素覆盖,安捷伦 ICP-MS 仪器在环境和食品检测实验室中得到广泛使用。随着最近的技术进步, Agilent 7900 ICP-MS 的分析动态范围已扩展至10个数量级以上,在同一次常规分析运行中可以将牛奶中的常量元素(如Na、K和Ca) 和痕量元素进行同时检测。碰撞/反应池(CRC) 同样经过了改进,以确保待测元素在样品基质中多原子干扰下依然能得到准确的结果。7900 ICP-MS 拥有市场领先的等离子体稳定性,利用选配的超高基质进样(UMHI)技术,样品耐受量可进一步拓展至高达25%的总溶解固体(TDS)。结合与集成样品引入系统 (ISIS 3) 的不连续采样 (DS)功能带来的高样品通量,7900 ICP-MS 非常适合食品样品中宽范围元素的常规、高通量检测。 本研究介绍了 Agilent 7900 ICP-MS 配合可选 UHMI 和 ISIS3,用于牛奶和乳制品中常量和痕量元素的快速分析。通过测量全脂奶粉标准参比物质 (SRM)对数据质量进行评估。 样品和试剂 七种类型的市售牛奶和乳制品购自美国加利福尼亚州伯克利的一家本地商店,包括速溶脱脂奶粉、酪乳粉、全脂羊奶粉、奶油邮乳粉、脱脂奶粉、全脂牛奶和脱脂牛奶。使用美国国家标准与技术研究院 (NIST, Gaithersburg, MD) 的 1549a 全脂奶粉标准参比物质 (SRM)对方法进行验证。 样品前处理 将牛奶样品(0.5g奶粉或1g液体奶)和 NIST 1549a SRM (0.5g)分别加入6mL 硝酸 (67%-69%, BASELINE, SeaStar Chemicals,Sidney, BC, Canada) 和1 mL盐酸 (32%-35%, ARISTAR ULTRA,BDH, Westchester, PA) 中, 在 UltraWAVE 的单反应室微波消解系统 (Milestone Inc., Shelton CT) 中进行消解。空白中含有6mLHNO3和1mL HCI。在20分钟内分别将温度和压力升至240℃和150 bar。将最终条件维持15分钟,确保完全消解。用 Millipore超纯水 (Milli-Q" Water System, Darmstadt, Germany) 将每个样品稀希至10mL。用2% HNOs 和 0.5% HCI 将样品进一步稀释10倍,制备校准标样也用这种混合酸。每种市售样品平行配制三份,并配制七份 NIST 1549a SRM 消解样品。 仪器 分析采用配备标准镍锥、玻璃同心雾化器和 UHMI 选件的 Agilent7900 ICP-MS。 UHMI 将气溶胶稀释与等离子体温度自动优化结合,最大程度提高了7900 ICP-MS的等离子体稳定性。 7900 ICP-MS包括第4代碰撞/反应池(CRC)、八极杆反应池系统(ORS4),使用氦碰撞模式消除了多原子干扰,从而获得了最佳操作条件。未受干扰的低质量元素通常在无气体模式下进行测量,但是,如果为了最大限度提高样品通量而要求使用一种分析模式(与本研究中的情况相同),拥有高灵敏度的7900 ICP-MS 也可以在氦模式下测量这些分析物。。可选的 ISIS 3 不连续采样附件用来将每个样品的运行时间缩短至150秒。 分析步骤 Agilent ICP-MS MassHunter 有几种预设等离子体模式,这些模式中包含了 UHMI 气溶胶稀释倍数。这有助于简化仪器使用,操作人员可以快速高效地选择固定的预设操作条件,最小化用户手动输入。对于牛奶消解物的分析,选择预设等离子体条件设置为HMI-4(气溶胶稀约约4倍),为存在多种较高基质水平的消解样品提供适当的稳定性和耐受性。采用的仪器设置如表1所示。所有的透镜电压均通过仪器的自动调谐功能进行优化。 表1. Agilent 7900 ICP-MS 和 ISIS 3操作条件 参数 值 定量环体积(mL) 1.5 等离子体模式 时间(s) 泵速(%) 载样 6 50 稳定 15 5 针头冲洗 30 5 针头冲洗1 5 5 针头冲洗2 5 5 可选的定量环针头冲洗 15 50 元素数量 24 种分析物,6种 ISTD 总采集时间(重复3次)(秒) 150 可选的定量环清洗 15 50 校准 ( 本方法分析了24种元素和6个内标,分别为 Sc、Ge、Rh、In、Tb 和 Lu。多数痕量矿物元素的校准标样均使用安捷伦标准品配制,标准品包括:1000 mg/L Fe、K、 C a、Na、 Mg ; 10 m g/LAs、Ba、Cd、Co、Cr、Cu、Mn、Mo、 P b、 S b、 S e、 T I、V、Zn; 基 体为10% HNOs(部件号5183-4688)。 Spex 单元素标准品 (SPEX CertiPre p , Metuchen, NJ) 用于添加 Hg 和 Sn (各1 0 00 mg/L)、P(10000 mg/L) 以及 Na 和 Ca (各1000mg/L)。 Ti 和B(1000mg/L) 的单元素标准品购自 Fisher Scientific 公司。 ) Ti、V、Cr、Mn、Co、Cu、Zn、As、Se、Mo、Cd、Sn、Sb、Ba、TI、Pb元素在 0-100 pg/L的范围内进行了5点校准;B元素在 0-500 pg/L 的范围内进行了5点校准;Mg、P、K、Fe 元素在0-10000 pig/L 的范围内进行了5点校准; Hg元素在 0-2 pg/L 的范围内进行了5点校准。Na 元素在0-200000 pg/L的围围内进行了6点校准; Ca 元素在0-100000 ug/L 的范围内进行了6点校准。 表2.校准系数、方法检测限和背景等效浓度数据。所有元素均在 He模式下测量 几种元素的代表性校准曲线如图1和图2所示。 图1.K和 Ca的校准曲线,表明这两种元素分别在最大10 mg/L和100mg/L的常量元素范围内有出色的线性 图2.低浓度元素Mn 和 Se 的校准曲线,表明这两种元素在 100 pg/L的范围内有出色的线性 方法验证 在开始分析市售乳制品样品之前,将7个 NIST 1549a 样品作为仪器检查样品进行分析。表3的结果表明所有标准元素均达到了良好的准确度,回收率均在标准值的±5%以内。对于大多数元素来说,精密度约为3%RSD 甚至更小。这些结果证实 7900 ICP-MS适用于进行消解牛奶样品的常规测量。 表3.7个NIST 1549a 消解液样品测量的定量结果、回收率和精密度 NIST 1549a 元素 实测浓度(ng/L)n=7(ppm) RSD (%) 标准浓度(ppm) 回收率(%) 23 Na [He] 3176 2.43 3176±58 99.99 24 Mg [He] 865 1.54 892±62 97.02 31 P [He] 7751 1.99 7600±500 101.99 39K[He] 11837 2.31 11920±430 99.30 44 Ca [He] 8798 2.12 8810±240 99.86 55Mn [He] 0.179 3.07 0.184±0.024 97.03 66 Zn [He] 32.6 1.74 33.8±2.3 96.44 78 Se [He] 0.241 2.36 0.242±0.026 99.78 137 Ba [He] 0.575 3.02 0.566±0.039 101.58 在整个分析序列中,每隔10个样品测量一次连续校准验证(CCV)标准品。如图3所示,所有元素的 CCV 回收率均在±10%的限值内。 实际样品的分析 这种方法可用于分析牛奶和乳制品样品消解物。样品中检测浓度高于检测限(DL)的元素列于表4中。将这些数据与已发表文献比较后发现,市售全脂牛奶和脱脂牛奶的结果均处于此前发表的范围内。Khan 等人对微量元素的报告值分别为 Zn 3535.6-4754.3 ng/g、Se 679.1-1424.8 ng/g、Cu 84.5-718.3ng/g、Mn 64.1-236.9 ng/g 以及 Ba 91.0-163.1 ng/g。作者指出,他们所得的牛奶样品中Se、Mn 和 Cu元素的值略高于引用文献中的值,这一点也与本研究中获得的结果一致。 表4.市售牛奶和奶粉中多元素的定量结果(平均实测浓度(n=3))。阴影行中的结果单位为 mg/kg (ppm)。此外所有其他结果的单位为 pig/kg (ppb) 元素 速溶脱脂奶粉 酪乳粉 全脂羊奶粉 甜奶油酪乳粉 脱脂奶粉 全脂牛奶 脱脂牛奶 11 B 3053 2931 2337 2490 2182 443.5 406.4 23 Na 3919 3870 2804 4335 3871 371 378 24 Mg 1152 1017 1094 931 1091 106 107 31P 10215 90965 8221 8161 9845 965 985 39K 15827 30554 15912 14590 17195 1519 1560 44 Ca 11762 9963 8486 7950 11077 1104 1123 47 Ti 442.5 221.2 201.3 256.3 253.2 < DL
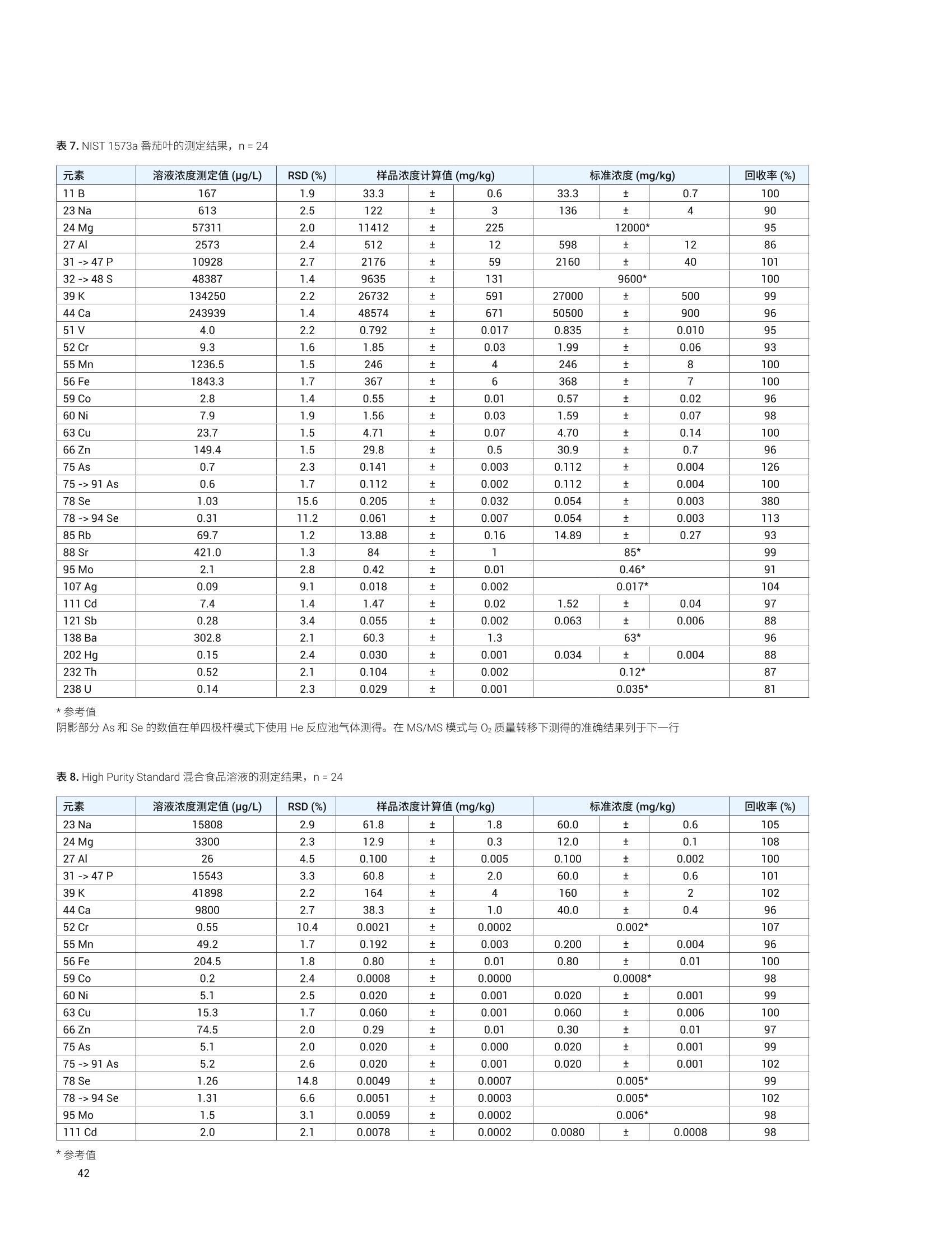
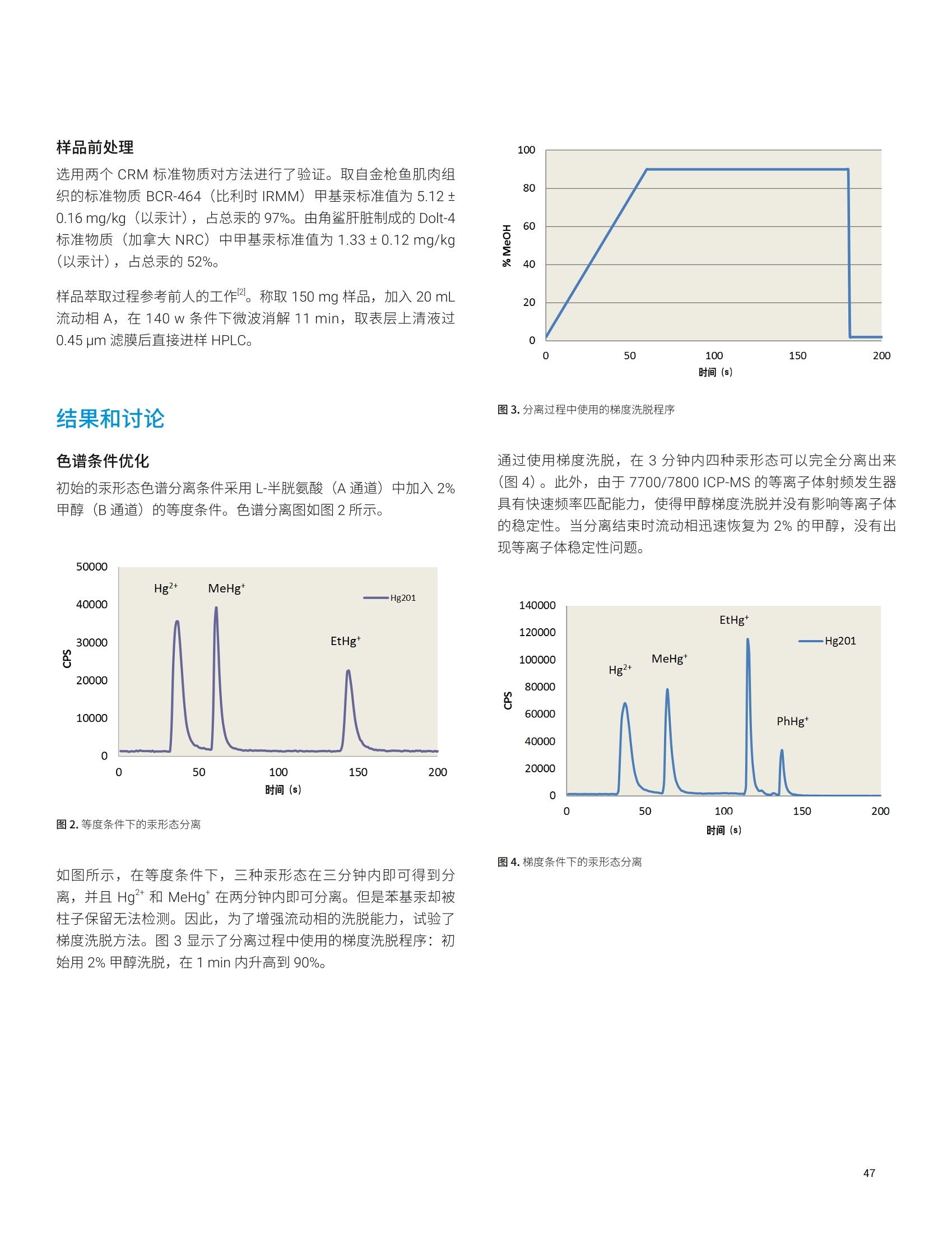
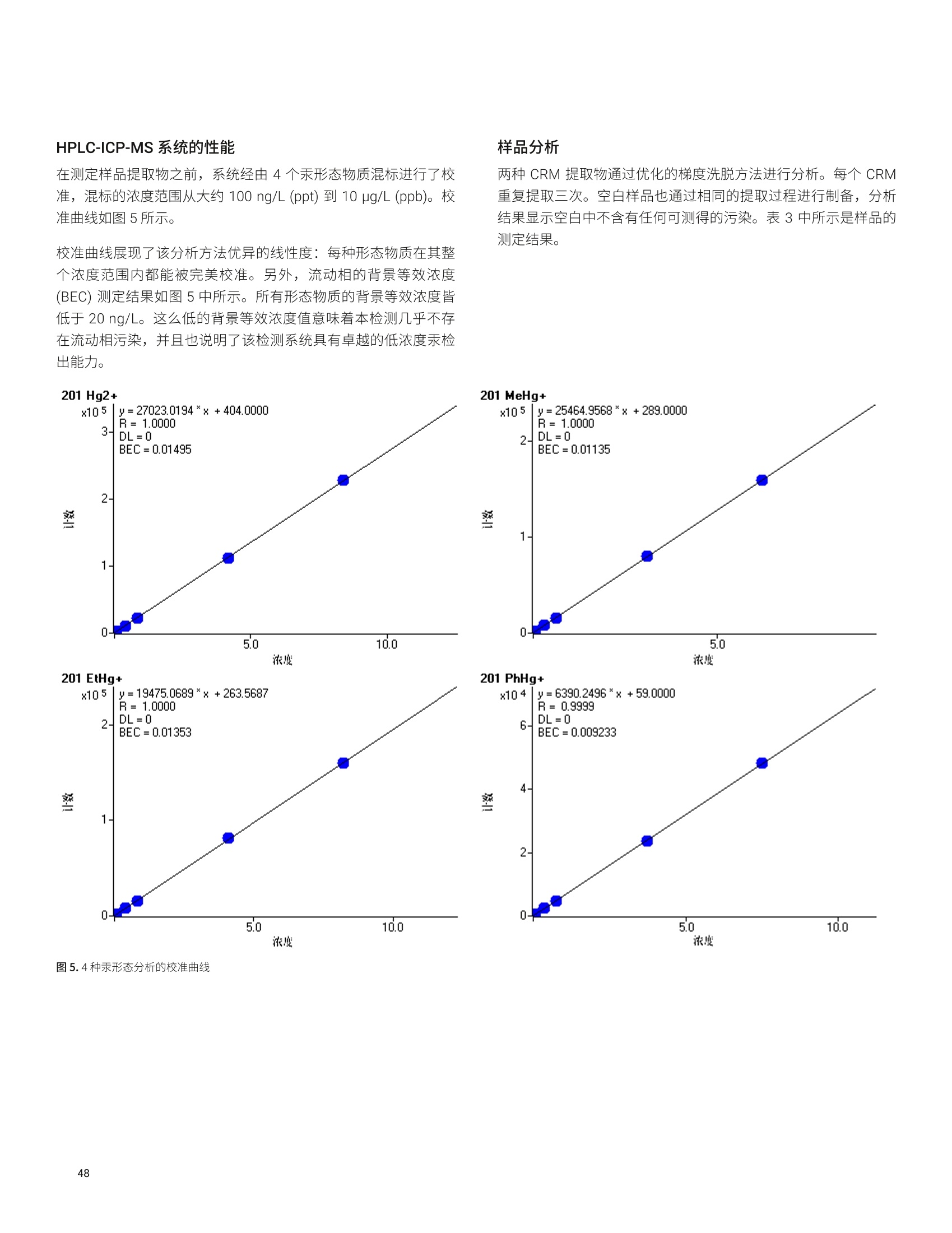
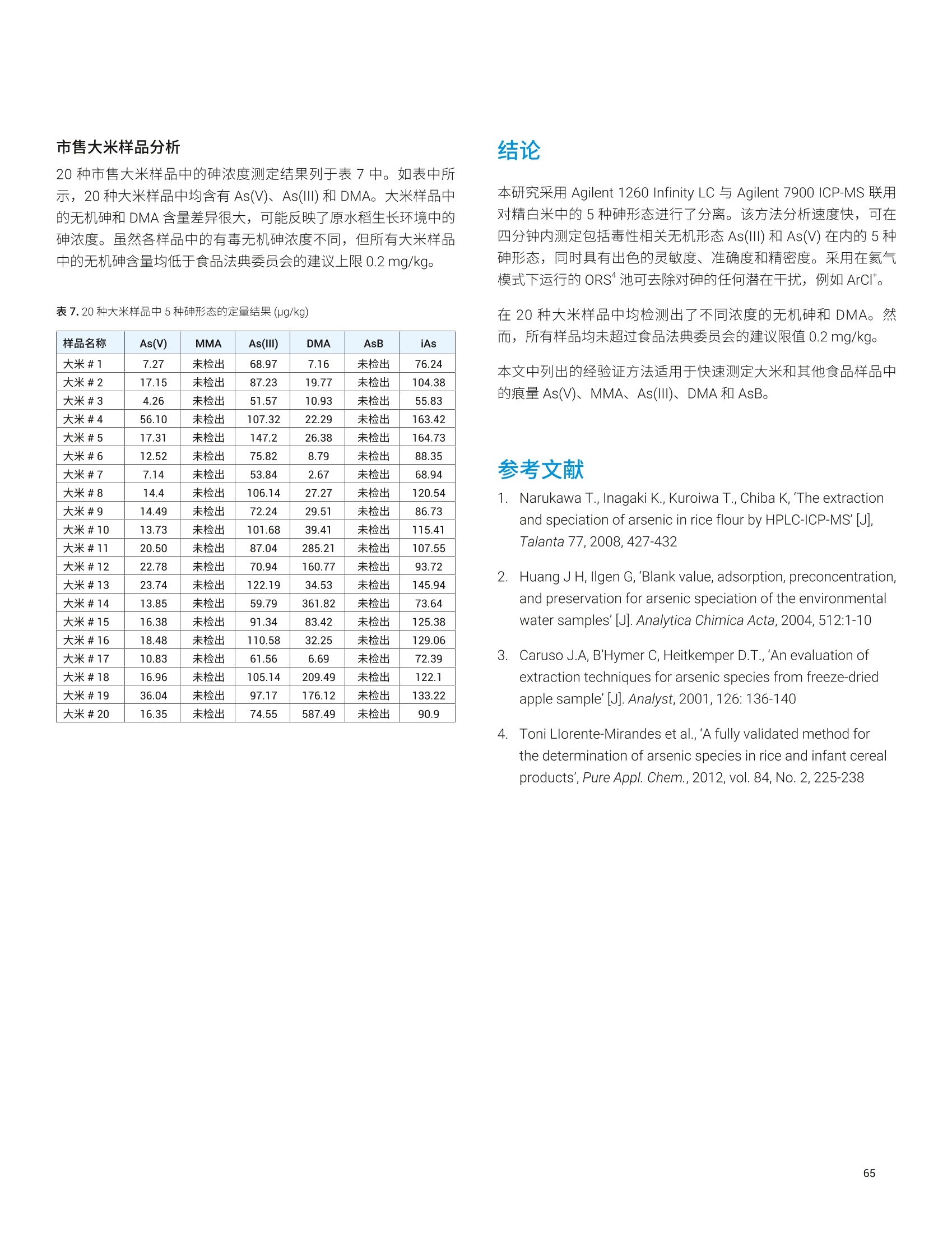
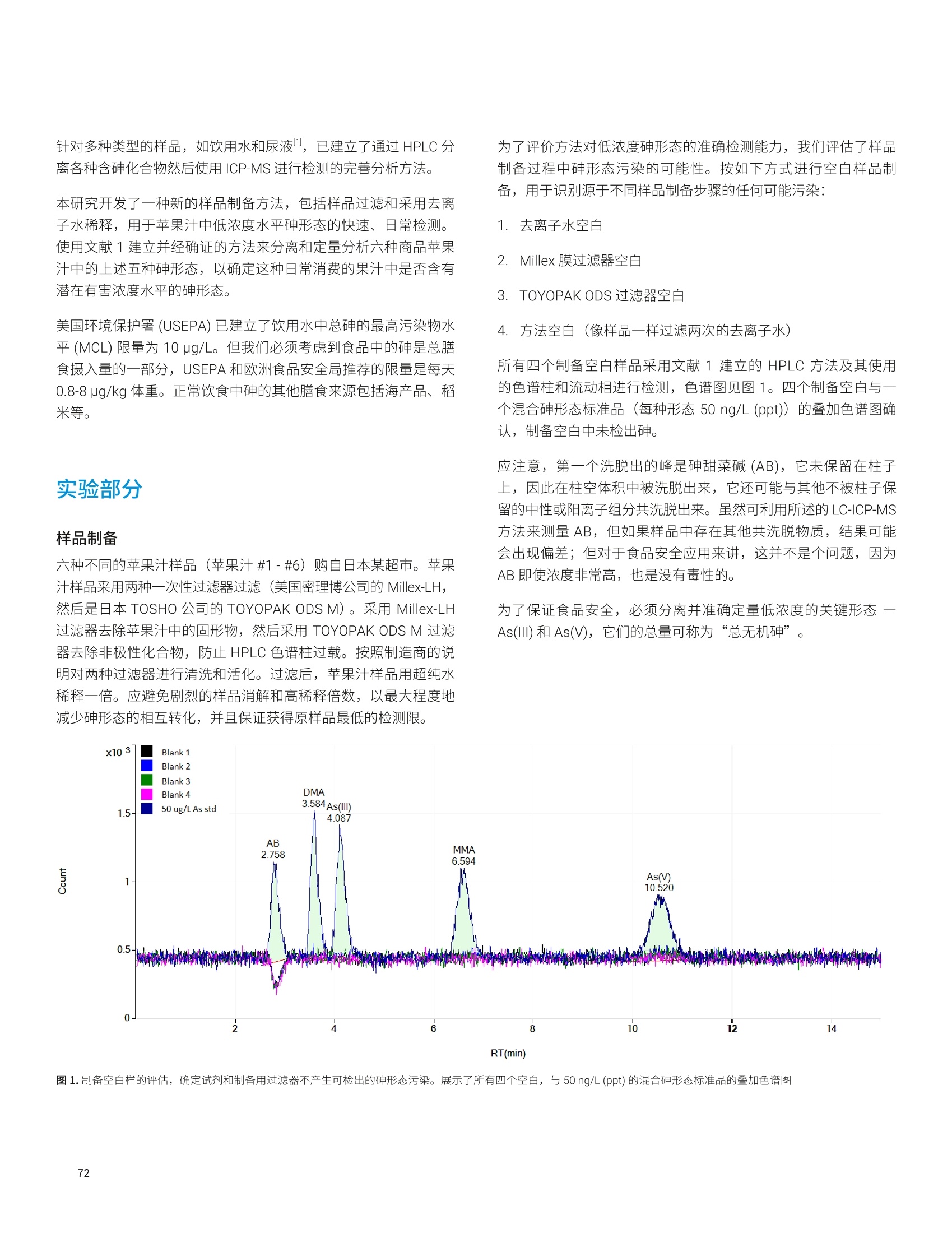
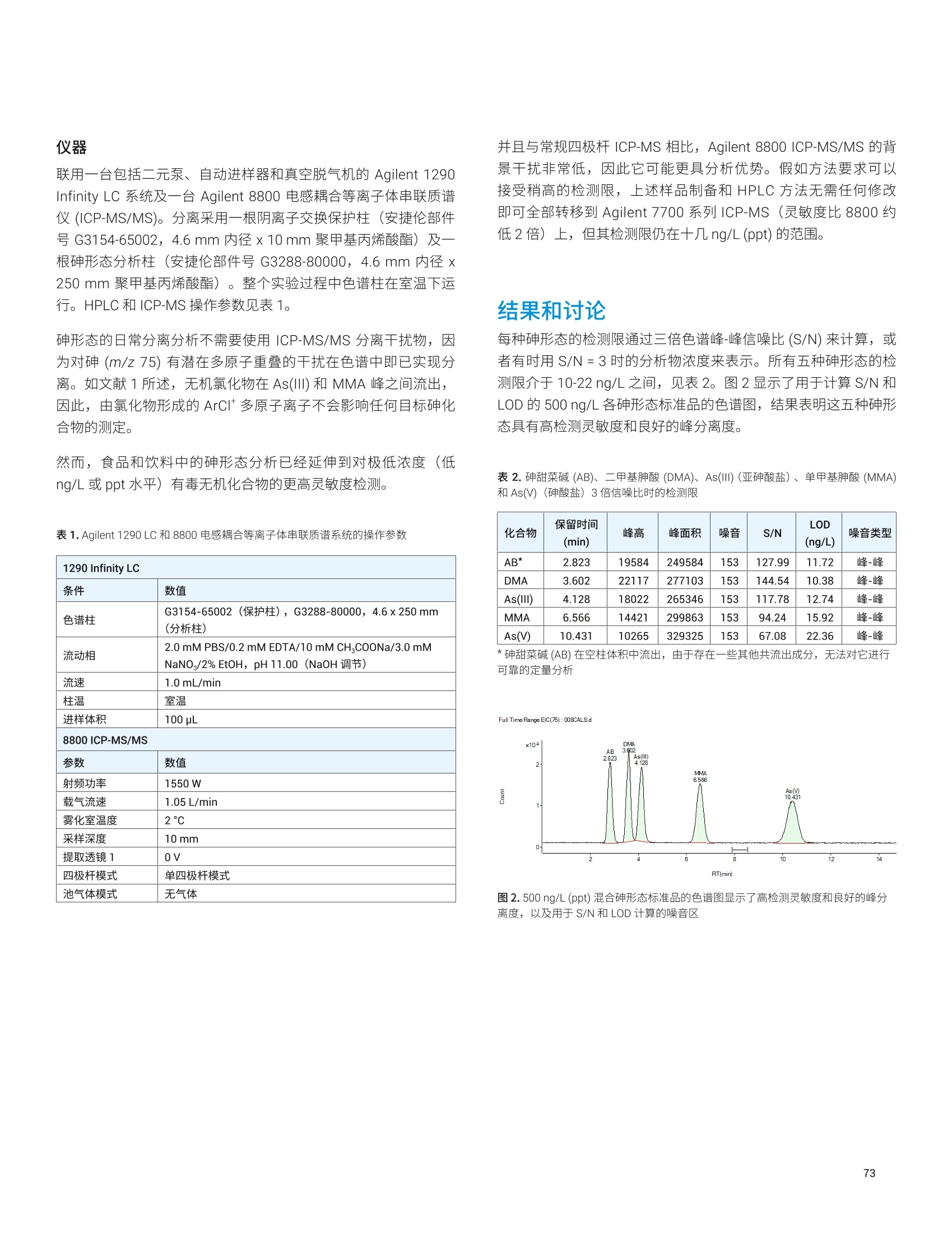
- 47P 12936 2.0 1291 26 1333 36 97 32->48S 15496 2.2 1546 ± 34 1645 25 94 39K 12700 2.3 1267 ± 29 1325 士 20 96 44 Ca 1871 1.8 186.7 士 3.4 191.4 ± 3.3 98 51V 0.10 8.1 0.010 0.001 0.01* 100 55 Mn 86 1.7 8.54 0.14 9.00 0.78 95 56 Fe 142 1.6 14.20 ± 0.22 14.11 士 0.33 101 63 Cu 19 1.6 1.94 士 0.03 2.03 士 0.14 96 66 Zn 112 1.9 11.17 0.21 11.61 0.26 96 75 As 0.047 16.5 0.0046 0.001 0.0048 0.0003 97 75->91 As 0.049 19.4 0.0049 ± 0.001 0.0048 ± 0.0003 101 78 Se 11.5 4.2 1.15 士 0.05 1.14 0.10 101 78->94 Se 11.8 1.9 1.17 0.02 1.14 士 0.10 103 85 Rb 6.54 1.8 0.652 0.012 0.671 士 0.012 97 95 Mo 4.60 2.1 0.459 士 0.009 0.464 0.034 99 111 Cd 0.239 5.7 0.0238 0.0014 0.0254 士 0.0009 94 118 Sn 0.0355 12.8 0.0035 0.0005 0.003* 118 202Hg 0.0066 11.3 0.0007 ± 0.0001 0.0005* 131 208 Pb 0.0937 4.4 0.0094 ± 0.0004 0.0104 0.0024 90 *参考值 表5.NIST 1568b 米粉的测定结果, n=24 元素 溶液浓度测定值(ug/L) RSD(%) 样品浓度计算值(mg/kg) 标准浓度(mg/kg) 回收率(%) 23 Na 65.6 3.2 6.54 ± 0.28 6.74 0.19 97 24 Mg 5454 1.5 543 8 559 ± 10 97 27AI 40.3 3.3 4.01 0.13 4.21 ± 0.34 95 31->47 P 15162 2.8 1510 43 1530 ± 40 99 32->48S 11369 2.5 1133 土 28 1200 10 94 39K 12371 2.0 1233 士 24 1282 11 96 44 Ca 1158 2.1 115.3 2.5 118.4 3.1 97 51 V 182.3 1.0 18.2 ± 0.2 19.2 1.8 95 55 Mn 75.4 1.0 7.51 ± 0.08 7.42 0.44 101 56Fe 0.173 1.7 0.0173 士 0.0003 0.0177 士 0.0005* 98 63 Cu 22.7 1.0 2.26 土 0.02 2.35 0.16 96 元素 溶液浓度测定值(pg/L) RSD (%) 样品浓度计算值(mg/kg) 标准浓度(mg/kg) 回收率(%) 66 Zn 191.7 1.4 19.10 0.26 19.42 士 0.26 98 75 As 2.97 1.4 0.296 0.004 0.285 0.014 104 75->91 As 3.01 1.7 0.300 0.005 0.285 ± 0.014 105 78 Se 3.4 8.9 0.341 ± 0.030 0.365 ± 0.029 93 78 -> 94 Se 3.5 3.8 0.352 士 0.013 0.365 ± 0.029 96 85 Rb 61.1 1.1 6.088 土 0.069 6.198 0.026 98 95 Mo 13.96 1.2 1.391 土 0.017 1.451 士 0.048 96 111 Cd 0.201 4.9 0.0201 0.0010 0.0224 士 0.0013 90 118Sn 0.060 7.4 0.0060 0.0004 0.005 士 0.001* 121 202 Hg 0.0529 2.1 0.0053 0.0001 0.0059 ± 0.0004 89 208 Pb 0.068 3.0 0.0068 ± 0.0002 0.008 士 0.003* 85 *参考值 表6. NIST 1515 苹果叶的测定结果, n=24 *参考值 阴影部分 As 和 Se 的数值在单四极杆模式下使用 He 反应池气体测得。在 MS/MS模式与02质量转移下测得的准确结果列于下一行 *1 Na 的测量结果高于参考值,重复分析同容溶液获得的结果相同。因此,加标回收率测试用来确认结果。加标回收率结果良好(回收率:99%),这表明初始样品遭受了 Na 污染 表 7. NIST 1573a 番茄叶的测定结果,n=24 *参考值 阴影部分 As 和 Se 的数值在单四极杆模式下使用 He 反应池气体测得。在MS/MS模与与02质量转移下测得的准确结果列于下一行 表8. High Purity Standard 混合食品溶液的测定结果,n=24 元素 溶液浓度测定值(pg/L) RSD (%) 样品浓度计算值(mg/kg) 标准浓度(mg/kg) 回收率(%) 23Na 15808 2.9 61.8 ± 1.8 60.0 0.6 105 24 Mg 3300 2.3 12.9 士 0.3 12.0 0.1 108 27 AI 26 4.5 0.100 士 0.005 0.100 0.002 100 31 ->47 P 15543 3.3 60.8 2.0 60.0 0.6 101 39 K 41898 2.2 164 士 4 160 士 2 102 44 Ca 9800 2.7 38.3 1.0 40.0 0.4 96 52 Cr 0.55 10.4 0.0021 0.0002 0.002* 107 55 Mn 49.2 1.7 0.192 0.003 0.200 士 0.004 96 56 Fe 204.5 1.8 0.80 0.01 0.80 ± 0.01 100 59 Co 0.2 2.4 0.0008 士 0.0000 0.0008* 98 60 Ni 5.1 2.5 0.020 0.001 0.020 士 0.001 99 63 Cu 15.3 1.7 0.060 士 0.001 0.060 士 0.006 100 66 Zn 74.5 2.0 0.29 0.01 0.30 0.01 97 75 As 5.1 2.0 0.020 ± 0.000 0.020 ± 0.001 99 75 ->91 As 5.2 2.6 0.020 士 0.001 0.020 0.001 102 78 Se 1.26 14.8 0.0049 0.0007 0.005* 99 78->94 Se 1.31 6.6 0.0051 0.0003 0.005* 102 95 Mo 1.5 3.1 0.0059 士 0.0002 0.006* 98 111 Cd 2.0 2.1 0.0078 ± 0.0002 0.0080 0.0008 98 对于高基质样品(如食品消解液样品)中最宽范围的痕量和常量元素, Agilent 8900 标准配置 ICP-MS/MS 与 UHMI相结合提供了常规分析所需要的稳定性和基质耐受性。在02反应池气体与MS/MS质量转移模式下,影响痕量水平砷和硒准确测定的带双电荷的 REE 干扰得以消除。大多数其他元素在 He 模式下进行测定,对于复杂多变的基质,这种在使用中充分验证过的方法广泛用于去除常见的基于基质的多原子干扰。 尽管并非所有的食品、土壤和沉积物中均含有高浓度的REE,但是 ICP-MS/MS 与 MS/MS 相结合提高了食品与环境样品中 As和 Se 测量结果的准确度和可靠性,而这些样品通常含有复杂多变的高 TDS 基质。 利用预设方法和自动调谐大大简化了方法开发,确保获得可重现的性能,不受操作者经验丰富与否的影响。 ( 1. E E d M cCurdy and Glenn Woods, J. Anal. At. Spectrom., 2004,19,607-615 ) ( 2.E Brian P Jackson et al, J. Anal. At. Spectrom.,2015,30, 1179-1183 ) ( . Kazuhiro Sakai, 安捷伦应用简报,2015,5991-6409EN ) ( 4. A Agilent 8800 ICP-MS/MS应用手册第二版,20 1 5, 5991- 2802CHCN ) ( 5. Lieve B alcaen et al, Anal. Chim. Acta, 2014,8 0 9, 1 - 8 ) ( 6.S S.D. Fernandez et al, Geochem Geophy Geosy, 2015, 16, 2005-2014 ) ( 7.T Takeshi Ohno and Yasuyuki Muramatsu, J. Anal. At.Spectrom., 2014,29, 347-351 ) ( 8. Clarice D. B. Amaral et al, Anal.Methods, 2015, 7,1215-1220. ) ( 9.E Erik H. Larsen, Stefan Sturup, J. Anal. At. Spectrom., 1994,9, 1099-1105 ) ( 10. Maurizio Pettine, Barbara Casentini, Domenico Mastroianni,Silvio Capri,Anal.Chim. Acta, 2007,599,2,191-198 ) ( 11.Wim Proper 、 Ed McCurdy 和 Junichi Takahas h i, 安捷伦应用 简报,2014,5 9 91-4257CHCN ) 安捷伦 ICP-MS 产品在食品形态分析领域中的应用文集 应用 HPLC-ICP-MS联用技术进行食品中汞形态分析的优势 汞是对生物体具有较强毒性的元素之一。环境中汞的浓度相对较低,但是食物链传递过程会使其浓度增大,最终导致一些食品中汞含量很高。此外,其毒性不仅与其总含量有关,还与其存在形态相关。因此研究食品中汞的存在形态对全面评价其对人体的潜在危害至关重要。 由于汞形态分析需要较低的检测限,因此 GC-ICP-MS 联用是首选方法。然而,随着现代ICP-MS 系统灵敏度的提高, HPLC 也已开始应用到形态分析中。HPLC 与 ICP-MS 的联用由于其简单快速速技术连接而备受瞩目。此外,与GC 分析相比, HPLC 可以对萃取的样品溶液直接进样,无需进行各形态的柱前衍生,大大简化了样品前处理,节省了总分析流程所需的成本。 本研究工作中,对采用 HPLC-ICP-MS 联用技术进行食品中汞的形态分析进行了评估。从毒理学角度来说无机汞(Hg*)和一甲基汞是主要的目标分析物,但本工作对可能遇到的乙基汞(EtHg*)和苯基汞(PhHg*)也作了研究。通过有机溶剂的梯度洗脱可将各形态分离开来。 Agilent 7700/7800 ICP-MS 系统中采用了独特的快速频率匹配的固态射频 (RF)发生器,允许在水相和有机相之间轻易转换而不会影响等离子体的稳定性。通过分析认证标准物质(CRM) 验证了本方法的可靠性。结果表明,安捷伦的 HPLC-ICP-MS 联用系统是进行食品中研形态分析的完整、全面集成和有效的解决方案。 仪器 色谱分离采用 Agilent 1260 HPLC。 1260 HPLC 最大允许压力可达600bar, 可使用极小粒径的色谱柱进行快速分离。本工作使用1.8 um 粒径的 Zorbax C-18色谱柱(安捷伦)。色谱条件见表1。该分离基于 High等人之前的工作进行了优化 。 表1. Agilent 1260 HPLC 系统操作条件 参数 数值 流速 1 mL/min 进样量 50pL 流动相:A通道 B通道 0.5 g/LL-半胱氨酸 0.5 g/LL-半胱氨酸、HCI、H,0, HCI调节 pH至2.3 甲醇 采用 Agilent 7700x ICP-MS 通过汞同位素201Hg测定汞, 通过7700x可选的第5个质量流控制器往载气中加入氧气(含有20%氧气的氩气)。等离子体中加入氧气确保有机物可直接进入 ICP-MS,而不会造成接口锥的积碳。使用铂锥防止氧气加入造成的氧化,同时使用有机分析常用的内径为1.0 mm 的炬管。 ICP-MS 7700x仪器操作参数见表2。 表2.Agilent 7700x ICP-MS 操作参数 参数 数值 射频功率 1600W 载气流速 0.54 L/min 补偿气流速 0.10 L/min 辅助气(含20%氧气和氩气) 0.06 L/min 雾化室温度 -5°℃ 采样深度 8.0mm 7700/7800 ICP-MS 的 Mass Hunter 工作站能同时控制常见的安捷伦 LC和 GC模块,可以在 ICP-MS Mass Hunter 软件中直接运行1260 HPLC 方法和序列(图1)。该特性不但简化了 HPLC-ICP-MS的联用操作,还增加了此类分析的安全性,因为双向通讯可保证HPLC 或 ICP-MS任何一方停止运行的时候,该软件可自动停止另一方的运行。 样品前处理 选用两个 CRM 标准物质对方法进行了验证。取自金枪鱼肌肉组织的标准物质 BCR-464(比利时IRMM)甲基汞标准值为5.12±0.16 mg/kg (以汞计),占总汞的97%。由角鲨肝脏制成的 Dolt-4标准物质(加拿大NRC) 中甲基汞标准值为1.33±0.12 mg/kg(以汞计),占总汞的52%。 样品萃取过程参考前人的工作。称取150 mg样品,加入20mL流动相A,在140w条件下微波消解 11 min, 取表层上清液过0.45 um 滤膜后直接进样 HPLC。 色谱条件优化 初始的汞形态色谱分离条件采用L-半胱氨酸(A通道)中加入2%甲醇(B通道)的等度条件。色谱分离图如图2所示。 图2.等度条件下的汞形态分离 如图所示,在等度条件下,三种汞形态在三分钟内即可得到分离,并且 Hg+和 MeHg* 在两分钟内即可分离。但是苯基汞却被柱子保留无法检测。因此,为了增强流动相的洗脱能力,试验了梯度洗脱方法。图3显示了分离过程中使用的梯度洗脱程序:初始用2%甲醇洗脱,在1 min 内升高到90%。 图3.分离过程中使用的梯度洗脱程序 通过使用梯度洗脱,在3分钟内四种汞形态可以完全分离出来(图4)。此外,由于7700/7800 ICP-MS的等离子体射频发生器具有快速频率匹配能力,使得甲醇梯度洗脱并没有影响等离子体的稳定性。当分离结束时流动相迅速恢复为2%的甲醇,没有出现等离子体稳定性问题。 样品分析 在测定样品提取物之前,系统经由4个汞形态物质混标进行了校准,混标的浓度范围从大约100 ng/L (ppt) 到 10 pg/L(ppb)。校准曲线如图5所示。 两种 CRM 提取物通过优化的梯度洗脱方法进行分析。每个 CRM重复提取三次。空白样品也通过相同的提取过程进行制备,分析结果显示空白中不含有任何可测得的污染。表3中所示是样品的测定结果。 校准曲线展现了该分析方法优异的线性度:每种形态物质在其整个浓度范围内都能被完美校准。另外,流动相的背景等效浓度(BEC)测定结果如图5中所示。所有形态物质的背景等效浓度皆低于 20 ng/L。这么低的背景等效浓度值意味着本检测几乎不存在流动相污染,并且也说明了该检测系统具有卓越的低浓度汞检出能力。 图5.4种汞形态分析的校准曲线 表3.认证标准物质样品分析结果——浓度以 mg/kg 汞表示 BCR-464 Dolt-4 201 MeHg* 201 Hg²+ 201 MeHg* 结果 4.93 1.17 1.34 RSD (%) 8 8 10 认证值 5.12±0.16 (1.25)* 1.33±0.12 回收率(%) 96 94 101 *未认证浓度 由于这些样品中的无机汞含量是无参考值的,因此无法评估实测值的准确度。只有样品中的甲基汞和总汞浓度是有准确参考值的。表3中括号里的浓度值是假设 Dolt-4 样品中仅存在二价汞和甲基汞(样品色谱图中未观察到乙基汞或苯基汞)的情况下获得的。在这种假设下, Dolt-4样品中测得的无机汞含量结果与参考值一致。 两种样品中甲基汞形态的测得值与参考值都非常一致,验证了该新方法对食物样品中甲基汞形态分离测定的准确性。尤其是 Dlot-4标样中的甲基汞含量仅占总汞的52%,该甲基汞实测值与标准参考值的高度一致证明了样品制备阶段的提取操作过程充分保持了甲基汞形态,而未发生转化。 结论 本研究针对食物样品中的汞形态分析开发了快速有效的梯度洗脱HPLC-ICP-MS 方法。该方法能够在3分钟内将样品中的4种目标汞形态物质完全分离出来。用标准物质测定对该方法进行了验证,与标准物质参考值相比较,汞各形态回收率良好。另外,若无需分离测定苯基汞,该方法则可进一步简化为等度分离。 7700/7800 ICP-MS 的射频发生器所具有的快速频率匹配特性允许流动相由水相快速转换为90%甲醇,因此可以在不影响等离子体稳定性的前提下实现汞形态的分离。这种特性为有机溶剂流动相HPLC分离和 ICP-MS联机应用带来了新的可能。 感谢法国国家计量学实验室((LNE, Laboratoire National deMetrologie et d'Essais) 的 Guillaume Labarraque 和 CarolineOster 提供 CRM 提取物。 ( 1. Hight, S . C. & Cheng, J. (2006). Anal. Chim. Acta. 567:160-172 ) ( 2. S E annac, S., Labarraque, G., Fiscaro, P., Pannier, F . & PotinGautier, M. (2009) . Accred . Qual. Assur . 14:263-267 ) 通过毛细管 HPLC-ICP-MS分析微升体积的植物汁液中锌的形态 ( Paulina Flis 、 Laurent Ouerdane、Ryszard Lobinski CNRS-UPPA,Laboratoire de Chimie Analytique B io-inorganique et Environnement, UMR5254, Helioparc, 2,Av. Angot, 64053 Pau, France ) 许多金属元素对于正常的植物生长和发育非常重要。其中一种金属元素就是锌,它通常是生物体中第二丰富的过渡金属,并且作为重要的微量营养元素在植物生理学中发挥着不同的作用。锌是300多种酶的主要成分。它负责基因调控和蛋白质结构的稳定,包括锌指、锌簇和 RING 指结构域。锌还参与光合作用和 CO2固定等基本过程。植物中的锌过量或缺乏将导致植物死亡率高、生长迟缓和萎缩、萎黄病、坏死、小叶病和开花延迟。所有这些症状都可能对食品安全产生严重影响,因为与锌可利用性相关的作作产量将显著降低13。 通过鉴定植物汁液中存在的低分子量含金属化合物,有助于更深入地了解植物生理学,并且确定其准确的功能,这将进一步促进营养、农业和环境研究。然而,复杂生物基质如植物样品的研究可能在样品前处理或色谱分离过程中存在若干问题。主要的挑战与金属配合物的低浓度及其多样性有关。此外,金属配合物通常不稳定,能够在萃取、离线预浓缩步骤、甚至色谱分离中发生降解。在迄今为止所研究的色谱技术中,体积排阻色谱(SEC)、亲水相互作用色谱 (HILIC) 和反相 (RP)色谱已被证明是最适合避免金属配合物在分析过程中发生降解的技术4。由预浓缩柱和HILIC或 RP 分离柱组成的色谱系统似乎是此类应用的理想选择。 本研究提出一种ICP-MS 辅助的金属组学方法用于分离豌豆后韧皮部中存在的锌形态分析。通过具有在线预浓缩功能的毛细管 HPLC-ICP-MS 对胚囊液体进行分析。由于植物汁液量非常少,所以需要使用毛细管色谱。 样品 本文对来自发育中的豌豆豆荚(嫩豌豆)的胚囊液体下(后韧皮部)进行了研究。 样品前处理 用玻璃毛细管在豆荚中穿孔,使用蠕动泵提取液体胚乳,将其放入保存在冰上的 Eppendorf 管中。收集完成后,立即将样品置于液氮中冷冻,并在进一步分析之前将其置于-20°℃的温度下储存。在分析之前,将样品解冻,并用乙腈按1:2的比例(样品:乙腈)进行稀释,然后在10000 rpm 的转速下离心2分钟。收集上清液并立即进行分析。 HPLC-ICP-MS 系统 使用配备毛细管泵和手动进样阀(定量环尺寸:100 uL) 的Agilent 1100 液相色谱仪。将 30 pL 上清液进样至 SeQuant 两性离子型(ZIC-) HILIC 保护柱 (Merck KGaA, Darmstadt, Germany,5 mmx1mm(内径),5um)中,使用90%乙青和10mM甲酸铵缓冲液(pH 5.5) 进行等度洗脱 (20 pL/min)。用流动相将样品清洗4 min, 然后反冲至用于化合物分离的 SeQuant ZIC-HILIC 毛细管柱 (Merck KGaA, Darmstadt, Germany, 150 mm x0.3 mm(内径),3.5 um)。使用洗脱液A (10mM甲酸铵缓冲液 (pH5.5))和洗脱液B(乙腈),进行流速为 4 uL/min 的梯度洗脱。梯度程序见表1。 表 1.HPLC洗脱程序 步骤 洗脱液[%B] 时间[min] 1 90 0-5 2 90-65 5-17 3 65-52 17-47 4 52-35 47-53 5 35 53-65 6 35-90 65-70 7 90 70-75 HPLC-ICP-MS 和ESI-MS/MS 将分离柱的出口连接至 Agilent 7700x ICP-MS ((通过 AgilentcapLC接口, G3680A, 图1)或 ESI-MS/MS. 图1.安捷伦毛细管液相色谱接口套件 (G3680A),其包括小型石英雾化室内部的总消耗型雾化器 使用含有20 ppb Y、Li、Tl、Ce 溶于2%硝酸中的调谐溶液,在每天开始时自动对ICP-MS 条件进行优化。7700x的 ORS碰撞/反应池在高能量氦模式下操作,以排除可能出现于 Zn 同位素中的多原子干扰。使用60 ms 的驻留时间采集64Zn 和66Zn的信号。ICP-MS操作条件见表2。 表 2. Agilent 7700x ICP-MS操作条件 参数 值 雾化器/雾化室 毛细管液相色谱接口 G3680A 炬管内径 1mm 接口锥 铂 RF 功率 1560W 采样深度 7.5 mm 载气流速 0.78 L/ min 可选气体(O,)流速 0.04 L/ min 透镜 提取电压1 2.7V 提取电压2 -180V 反应池 八极杆偏置电压 -100V 氦气流速 10 mL/ min 动能歧视 7V ESI LTQ Orbitrap Velos 质谱仪在正离子模式下操作,毛细管电压为3.0 kV。将离子源的蒸发器温度设置为120℃,并将毛细管温度设置为280℃。全扫描 MS模式的分辨率设置为100000 (m/z 400处的FWHM)。 获得的嫩豌豆后韧皮部的64Zn的色谱图如图2所示。使用具有在线预浓缩功能的毛细管 ZIC-HILIC ICP-MS 使我们能够获得尖锐的高强度色谱峰,并对两种锌形态进行分离和检测(图2a和2b)。使用 ESI Orbitrap MS/MS 鉴定两种金属配合物。ICP-MS检测对于测定不同锌形态的保留时间和估计质量平衡至关重要。这简化了在 ESI-MS 质谱图中搜索锌配合物的步骤。质谱图的放大部分(图2d和2e)清晰地显示了两种包含锌的同位素模式的离子。这些提取离子色谱图(EIC)的保留时间与通过毛细管 ZIC-HILIC ICP-MS观察到的两个锌的峰(图2c)具有良好的一致性。 获得的数据使我们能够鉴定两种锌配合物:锌-烟草胺(NA)和锌-(组氨酸)2(表3)。 表3.从豌豆(嫩豌豆)的后韧皮部中鉴定出的含锌配合物的列表 峰1 峰2 配体 组氨酸 烟草胺 配合物 (His),-Zn NA-Zn 分子式(中性形态) C12H160N,Zn C12H1g0NZn 理论质量数 373.05973 366.06381 实验质量数 373.05957 366.06389 A (ppm) -0.437 0.216 m/z 图2.通过a)毛细管ZIC-HILIC-ICP-MS; b) 毛细管 ZIC-HILIC-ICP-MS一色谱图部分放大图; c) 毛细管 ZIC-HILIC-ESI-MS(选择离子色谱图)获得的色谱图。d)和e)是ESI-MS 谱图中包含锌同位素模式部分的放大图 由毛细管 HPLC 和 ICP-MS 组成的色谱系统使我们获得的64Zn(约6 fmol 的 Zn-NA配合物)的检测限为75 ng/L, 该检测限是由基线上20个点的标准偏差的3倍计算得到。将该数值与 Zn-NA配合物的信号进行比较,所获得的64Zn的色谱柱回收率为 70%-80%。 本研究展示了一种有效的 ICP-MS 辅助的金属组学方法,用于分离和鉴定存在于豌豆后韧皮部中的锌配合物。使用 ZIC-HILIC 预柱对锌形态进行预浓缩,然后通过 ZIC-HILIC 毛细管柱进行分离。通过毛细管 HPLC 与 ICP-MS 和 ESI MS/MS 仪器联用获得的数据组合可用于鉴定不同的锌配合物。由于植物汁液量非常少,所以需要使用毛细管色谱。另外,具有在线预浓缩功能的色谱系统非常适用于分析包含低浓度金属形态(其有时也不稳定)的生物样品。本方法已成功用于鉴定鉴种锌形态:锌-烟草胺 (NA)和锌-(组氨酸)2配合物,证明 NA 和组氨酸是嫩豌豆后韧皮部中的两种与锌形成配合物的主要配体。 ( 参考文献 ) ( 1.1 M .R. Broadley, P .J. White, J.P. Hammond,I. Zelko, A. L ux, New Phytologist, 2007,1 7 3, 6 77-702 ) ( 2. T.C.Fox,M.L. Guerinot, Annu. Rev. Plant Physiol. Plant Mol. Biol., 199 8 ,49,669-696 ) ( 3. C .A. Blindauer, R . Schmid,Metallomics, 2010, 2,510-529 ) ( 4. L.Ouerdane, S. M a ri, P. Czernic, M. Lebrun,R. Lobinski, JAAS, 2006,21 , 676-683 ) ( 得知性能参数同样适用于7800 ICP-MS。 ) Rima Juskelis 和 Jack Cappozzo 食品安全与健康研究所 伊利诺伊理工大学 Bedford Park, IL USA Jenny Nelson 安捷伦科技有限公司 5301 Stevens Creek Blvd. Santa Clara, CA, USA 使用 HPLC-ICP-MS 对婴儿米粉中的无机砷进行形态分析 前言 大米是摄入无机砷(iAs)的主要来源。砷自然存在于环境中,而人类活动也会引入砷,比如二十世纪七十年代之前,人们通过使用含砷农药引入了砷。水稻能够从环境中有效富集砷,因为种植水稻的水淹地区有利于水稻对砷化合物的吸收2.3。 无机砷是一种已知的致癌物,长期暴露于低水平的砷中会增加患膀胱癌、肺癌和皮肤癌以及2型糖尿病和心血管疾病的风险。与精白米相比,糙米中的砷含量更高1.5.6。美国大米样品中无机砷的浓度比世界其他地方的更高,而美国销售的婴儿米粉的原料通常都是美国产大米。 本应用简报介绍了使用 FDA元素分析手册 (EAM): 4.11节指定的高效液液色谱/电感耦合等离子体质谱 (HPLC-ICP-MS) 方法对婴儿米粉中的砷进行形态分析。等度等离子交换 HPLC 用于砷形态分离, ICP-MS 则作为砷形态检测器,在m/z 775 处对含砷的色谱峰进行监测。 ICP-MS 采用了氦气碰撞反应池模式以消除可能共洗脱的不同形态的氯造成的干扰。所有砷形态的检测限和定量限(LOD 和 LOQ) 均低于15pg/g,相对标准偏差 (%RSD) 均低于7%。该方法可以提供大米以及大米相关的婴儿米粉中的砷浓度信息,这对于了解砷对婴儿的健康风险是非常有必要的。 化学品与标准品 配置溶液用的去离子水均由 Milli-Q系统(Millipore)制得,电阻率>18 MW·cm. 化学品/标准品 来源 硝酸, OPTIMA 超纯级 赛默飞世尔科技 过氧化氢, OPTIMA 超纯及 赛默飞世尔科技 磷酸铵 ACROS 氢氧化铵,超纯 赛默飞世尔科技 异丙醇, HPLC级 赛默飞世尔科技 砷储备标样(AslII), 1000mg/L Spex Certiprep 砷储备标样(AsV), 1000 mg/L Spex Certiprep 甲胂一一(MMA,纯度98.5%) Chem Service 甲胂二钠 (DMA,纯度98.9%) Chem Service 砷甜菜碱 (AsB) Fluka 铑/锗内标 安捷伦 ICP-MS砷标样 Plasma 表1.米粉标准参比物质 SRM/CRM 总砷(ug/kg) As(III) (ug/kg) As(V)(pg/kg) iAs (pg/kg) DMA (pg/kg) MMA (pg/kg) 1568a 290±30* 60±12+ 39±8+ 100±20+ 171±34+ 11±2+ 1568 410±50* 85±17+ 31±6+ 116±23+ 285±57+ 22±4+ *带不确定度的标准值表示为95%置信区间或95%置信区间+系统误差{不确定度表示为现有最佳数据均值的±20% 标准参比物质(SRM) 在砷形态测定以及总砷测定时,使用 NIST (美国国家标准技术研究院)标准参比物质 (SRM) 1568a 和1568米粉作为质量控制物质(表1)。 NIST 1568 的总总标准值为410±30 pg/kg,NIST 1568 的 As(III)、DMA 和 As(V)分别为85±17、285±57和31±6 ug/kg。 仪器 形态分析使用的仪器为 Agilent 1200 Infinity 液相色谱系统,该系统由真空脱气单元、二元泵、自动进样器和10通阀(两通已堵塞)组成。另外使用一台外部泵 (LC-20AD, Shimadzu) 用于内标添加。利用1/16×0.0025×12英寸 Peek 管 (UpchurchScientific) 将 HPLC 系统与 Agilent 7700x ICP-MS 连接起来,并配置 MicroMist 雾化器和 Scott 双通道雾化室。仪器运行条件见表2。 标准溶液 按照FDA 方法 (EAM 4.11)对储备形态标样进行梯度稀释,得到标准溶液(每天均需重新配制)。所有的砷储备标准溶液(As(III)、DMA、MMA、As(V))均为水溶液,浓度为1000 pg/mL。使用 ICP-MS 对 DMA 和 MMA 标样的砷浓度进行验证。使用 ICP-MS砷标样校准曲线测定 1 pg/g MMA 和 DMA 标样的总砷浓度。这些浓度用于对储备标样浓度进行重新计算,得到的新浓度值用于后续计算。 将200 ug/mL 的储备溶液用流动相稀释至合适的浓度,得到工作标样。所有的标准溶液均于4℃下避光保存。在实验的当天上午配制新鲜的混合标准溶液。形态分析方法中使用的内标为 2 ng/gAs(V)的流动相溶液,柱后进内标以监测并校正信号漂移。总量测定方法中使用的内标为含18%异丙醇的铑/锗溶液(100 mg/LICP-MS内标混合溶液)。 表2.HPLC和ICP-MS运行条件 HPLC 条件 保护柱 Hamilton 色谱柱 Hamilton PRP-X100阴离子交换色谱柱 流动相 4.1×250,不锈钢,10 pm 流速 10 mM 磷酸铵, pH 8.25, 等度运行 进样量 1mL/min ICP-MS条件 100pL ICP-MS条件 RF 功率 1500 W 等离子体气体流速 15 L/min 稀释气流量 0.17 L/min 雾化器气体流速 1.1 L/min 雾化器类型 MicroMist 采样深度 8.5mm 雾化室温度 2°C 碰撞池气体 氦气,4.3mL/min 数据采集模式 时间分辨分析: m/z 75(75As*), m/z 77 (40Ar35CI*) 驻留时间 m/z 75 0.8 s; m/z 77 0.2 s 在流动相溶液中加入0.2 ng/g As(III)、DMA、MMA和As(V), 用于测定 LOD 和 LOQ。在流动相中加入 5 ng/g As(III)和砷甜菜碱(AsB),配制分辨率检查标准,用以监测 AsB 与 As(III)的分离。当大约 50%As(II) 转化成 As(V)时,配制一个新的分辨率检查标准。 样品 婴儿米粉购自美国伊利诺伊州、加州、德克萨斯州以及北达科它州不同地点的多个零售商店。31种婴儿米粉来自7家不同的生产商。表3列出了从婴儿米粉容器上得到的信息。 表3.婴儿米粉测试结果 样品前处理 对所有婴儿米粉进行总砷和砷形态分析。直接对容器中的婴儿米粉进行分析,无需进一步干燥或均质化处理。在总砷分析时,使用的是限热消解法,消解后的样品直接进 ICP-MS分析,无需HPLC分离。 总砷以及形态分析均使用限热消解法3。本实验中所有样品前处理均采用称重法。精确称取1g婴儿米粉样品置于预先称重的50mL聚丙烯离心管(带顶盖)中。向管中加入10 g 0.28 MHNO3,然后旋转10-30秒。然后将盖紧盖的管置于预热的限热消解系统中,95℃保持90分钟。 待样品冷却后,加入6.7g去离子水。将米粉悬浮液以 3500 rpm的速率离心10分钟。上清液通过连接在3mL一次性注射器上的0.45 um尼龙针头过滤器。将最开始通过过滤器的大约1mL 滤液舍弃到废液中,取1g滤液转移至15mL去皮重的离心管中。向离心管中加入2gpH校正溶液(向流动相中加入氢氧化铵,pH调至9.95±0.05)。 使用 pH 校正溶液将最终方法空白和样品的 pH 调至6-8.5。将得到的部分样品溶液转移至聚丙烯自动进样器进样瓶,待HPLC-ICP-MS分析。 色谱分离 图1给出了典型的分离图谱。我们进行了空白测试以查看是否存在砷污染,结果表明没有污染。 图1.5ng/g砷标准的色谱分离图谱 方法精密度 为了验证证形态分析和总量测定方法,我们对 NIST SRM 1568米粉进行了分析。有证标准物质中各个形态的砷以及总砷的测量值与标准值非常吻合。使用一系列 SRM 重复样测定了 EAM 4.11 方法分析婴儿米粉时的重现性(表4)。使用砷形态分析法时总砷的重现性 (%RSD) 为 1.74%,使用砷总量测定方法时总砷的 %RSD为5.3%, iAs 的%RSD 为2.8%。 校准曲线 使用0.25、0.4、1.0、5.0和20 ng/g As(III)、DMA、MMA和As(V)标准溶液测定了砷形态的校准曲线(图2)。该浓度范围内线性标准曲线的相关系数(R²)为1.00。校准核查标准由10 ng/gAs(III)、DMA、MMA 和 As(V)组成,其回收率介于99%-113%,%RSD<4%。 表4.方法精密度 样品名称 (分别配制) As(III) (pg/kg) DMA (ug/kg) MMA (ug/kg) As(V) (ug/kg) iAs (pg/kg) 总砷 (按 USP 方法) 总砷 (按总方法) 质量 平衡 标准值 85±17 285±57 22±4 31±6 116±23 410±50 410±50 1568_重复1 65 289.9 24.8 40.6 105.6 420.3 398.4 105.5 1568_重复2 68.5 289 24.6 42.5 110.9 424.5 445.1 95.4 1568_重复3 66.9 300.6 25 44.7 111.6 437.2 405.2 107.9 1568_重复4 70.3 288.7 21.6 37.5 107.8 418.1 442 94.6 1568_重复5 69.8 289.4 22.8 43.3 113.1 425.4 442.3 96.2 平均值 68.1 291.5 23.8 41.7 109.8 425.1 426.6 99.9 标准偏差(SD) 2.2 5.1 1.5 2.8 3.1 7.4 22.8 6.3 %RSD 3.2 1.7 6.3 6.7 2.8 1.7 5.3 6.3 iAs 为 As(III)和 As(V)之和 b质量平衡=形态分析得到的总砷 (As(III)+DMA+MMA+As(V))/(总砷测定法得到的总砷) 检测限和定量限 测定了 HPLC-ICP-MS 对大米中砷形态分析的分析溶液检测限(ASDL)、分析溶液定量限 (ASQL)、方法检测限 (LOD) 以及方法定量限(LOQ)(表5)。砷各个形态的 LOD 值大约介于0.9 ng/g-1.8 ng/g, LOQ介于7pg/kg-14 pg/kg。 表 5. HPLC-ICP-MS砷形态分析的 ASDL、ASQL、LOD 和LOQ As(III) DMA MMA As(V) ASDL (ng/g) 0.034 0.017 0.024 0.035 LOD (pg/kg) 1.68 0.87 1.18 1.74 ASQL (ng/g) 0.262 0.135 0.184 0.273 LOQ (ug/kg) 13.1 6.8 9.2 13.6 回收率 总体而言, iAs、DMA 和 MMA 的样品加标回收率还是很好的(考虑到砷从 As(III) 转化为 As(V)的问题)。 iAs、 DMA 和 MMA的回收率为97.3%(iAs)-115.0%(DMA)(表6)。 表6.添加砷的%回收率(n=2) 各个形态的加标浓度 As(III) DMA MMA As(V) iAs 50 ng/g 104.1±38.2 115.0±1.2 104.8±1.1 109.1±38.3 106.5±0.6 75ng/g 85.1±1.3 108.6±2.9 106.8±0.8 116.4±0.9 100.5±1.1 100 ng/g 67.8±32.8 112.4±2.2 105.0±0.8 143.7±28.5 105.2±2.6 150 ng/g 74.7±10.1 104.0±9.4 106.0±6.1 120.7±7.7 97.3±8.9 150 ng/g 67.9±15.6 112.9±2.8 106.6±0.5 142.8±12.4 104.8±1.8 225ng/g 88.1±1.5 109.3±1.2 105.2±1.0 118.2±3.0 102.9±2.2 婴儿米粉中总砷以及各种形态的砷浓度 表7给出了婴儿米粉中的总砷以及形态分析结果。所有样品重复测试两次的结果没有显著差异。测试的所有31种米粉均含有砷和无机砷 (iAs),其中 iAs 的浓度为 As(II) 和 As(V) 的浓度之和。米粉中总砷以及 iAs 的浓度均值分别为174.4和101.4 ug/kg。婴儿米粉中 iAs 在总砷中的平均比例为58.2%。 砷形态分析和总量测定方法的质量平衡(形态分析法得到的所有砷形态的总和除以总量测定方法得到的砷浓度)介于85.8%-106.0%,质量平衡的均值为96.7%。质量平衡的全部结果见表7。 混合谷类中总砷以及 iAs 的平均浓度(分别为105.1和62.8ug/kg)相对较低。婴儿混合谷类米粉中 iAs 在总砷中的平均比例为59.8%。 如表3所示,所有的31种婴儿米粉由有机米、全谷物有机米、混合谷类(全麦、全谷物米以及燕麦)或者大米制成。结果表明,各种米粉中无无砷 (iAs)的浓度差异极大(表7)。有机米粉和传统米粉中 iAs 的浓度没有显著差异(有机精白米的均值为98 ng/g,传统精白米的均值为101 ng/g). 在所测试的婴儿米粉中,总砷浓度为 79.9-277 ng/g。 iAs 在总砷中的比例为23%-81%。检测到的有机砷形态主要为 DMA (图3)。MMA 未检出或以痕量水平检出(表7)。 样品编号 As(III) (pg/kg) DMA(ug/kg) MMA (pg/kg) As(V) (pg/kg) iAsa (pg/kg) 总砷(按形态分析)(ug/kg) 总砷(总计)(pg/kg) 质量% (pg/kg) 每份 (pg) 混合谷物_1 20.6±7.7 27.5±0.2 TR(1.4) 36.6±8.4 57.2±0.7 86.2±0.5 88.3±1.3 97.6 0.9 混合谷物_18 18.1±3.3 35.2±1.4 TR(1.9) 44.9±4.1 63.0±0.7 100±2.0 112±5.7 89.1 0.9 混合谷物19 12.1±9.2 23.0±0.7 TR(1.5) 43.3±7.9 55.5±1.3 79.9±1.4 88.0±1.4 90.9 0.8 混合谷物20 4.84±1.3 50.5±0.6 TR(2.3) 58.9±1.1 63.7±0.1 116±0.6 124±0.5 93.8 1.0 混合谷物_21 13.0±2.1 48.2±0.4 TR (2.4) 58.5±2.0 71.6±0.1 122±0.5 126±0.4 96.4 1.1 混合谷物_22 4.83±0.5 50.0±1.7 TR(2.5) 64.0±1.1 68.8±0.6 121±2.7 131±9.1 92.2 1.0 混合谷物_23 9.89±9.6 49.1±0.6 TR (3.0) 55.4±9.1 65.3±0.4 117±0.7 128±4.6 91.5 1.0 混合谷物_27 19.3±0.2 38.1±0.5 TR(1.3) 37.7±5.3 57.1±5.0 96.5±3.9 109±0.4 88.1 0.9 有机米粉_4 37.8±8.6 153±0.6 TR (8.9) 67.3±4.9 105±3.7 267±3.8 272±7.9 98.2 1.6 有机米粉_6 26.0±0.4 51.8±1.5 TR(2.8) 64.7±1.9 90.7±1.4 145±3.1 146±7.3 99.3 1.4 单谷物大米粉_5 65.7±5.7 100±0.1 TR(4.9) 72.0±3.7 137±1.9 243±2.5 230±10 106 2.1 单谷物大米粉_7 32.9±0.8 89.2±0.9 TR (5.1) 85.9±0.3 118±1.1 213±0.7 212±8.5 100 1.8 单谷物大米粉_8 56.6±1.8 126±1.0 TR (6.6) 76.1±0.5 132±1.3 265±0.8 256±0.4 104 2.0 样品编号 As(III) (pg/kg) DMA (g/kg) MMA (pg/kg) As(V) (ug/kg) iAsa (pg/kg) 总砷(按形态分析) (pg/kg) 总砷(总计)(pg/kg) 质量% (pg/kg) 每份 (ug) 单谷物大米粉_13 27.6±0.1 35.3±0.0 TR(1.5) 45.2±1.7 72.8±1.6 109±1.2 108±1.7 101 1.1 单谷物大米粉_14 24.7±1.0 32.2±0.9 TR(3.0) 43.5±0.0 68.2±0.9 103±1.8 101±1.7 102 1.0 单谷物大米粉_15 24.1±1.6 30.0±0.3 TR (1.6) 33.8±0.0 58.0±1.7 89.7±3.1 92.5±3.2 97.1 0.9 单谷物大米粉_16 59.9±22 107±1.5 TR (3.4) 65.6±14 125±8.1 236±9.6 227±1.6 104 1.9 单谷物大米粉_17 35.2±10 34.3±0.9 TR(1.8) 54.7±7.0 90.0±3.1 126±3.1 127±1.4 99.2 1.4 单谷物大米粉_26 60.1±8.3 97.1±1.8 TR(2.7) 47.4±8.2 107±0.1 207±2.1 241±2.4 85.8 1.6 单谷物大米粉_31 58.6±3.7 104±1.6 TR(2.8) 39.1±2.7 97.8±0.9 205±3.5 237±0.9 86.4 1.5 有机全谷物米粉_3 16.2±7.3 15.9±0.5 0.0 51.7±5.4 68.0±1.9 84.4±3.0 85.1±1.7 99.1 1.0 有机糙米粉_2 21.7±0.2 42.9±0.1 TR (4.2) 111±1.2 133±1.0 180±0.2 178±0.1 101 2.0 有机糙米粉_9 21.7±10 27.7±1.0 0.0 34.3±9.1 56.0±1.7 84.7±2.6 83.9±2.6 101 0.8 有机糙米粉_10 24.2±1.3 206±4.2 TR (6.5) 39.5±2.6 63.8±4.0 277±8.0 261±7.0 106 1.0 有机糙米粉_11 21.3±3.1 38.5±0.3 TR(2.8) 107±0.3 128±2.7 169±2.0 165±7.8 103 1.9 有机糙米粉_12 23.0±3.5 107±1.0 TR (3.4) 65.7±1.3 88.8±2.2 200±2.9 206±13 97.2 1.3 有机咪米粉_24 18.0±0.9 25.8±0.0 TR(1.7) 69.4±0.7 87.4±1.6 114±2.0 127±1.9 90.2 1.3 有机咪米粉_25 23.1±1.8 27.6±0.0 TR(2.0) 73.0±0.6 96.2±2.4 125±1.9 133±0.0 94.2 1.4 有机全谷物苹果米粉_28 41.8±1.2 32.2±0.0 TR(1.5) 63.3±0.4 105±0.7 139±0.9 160±1.0 86.6 1.6 有机全谷物米粉_29 51.5±2.2 65.0±0.3 TR(2.6) 89.6±1.2 141±0.9 208±0.1 242±4.4 86.0 2.1 有机全谷物米粉_30 81.7±7.8 51.8±0.6 TR(1.2) 76.7±13 158±6.0 211±5.4 244±0.0 86.4 2.4 10 15 RT (min) 图3.五种婴儿米粉砷形态分析的代表性叠加谱图 形态法分析时,混合谷类米粉中的总砷(均值为10 ng/g) 以及无机砷(均值为63ng/g) 的浓度最低。 本实验得到的婴儿米粉的分析结果与文献值进行了比较1.7。总砷以及无机砷的浓度并没有之前报道的婴幼儿配方米粉中的高。这是因为本实验中的婴儿米粉均不含有机糙米糖浆 (OBRS)。据报道, OBRS 为主要成分的幼儿配方米粉中砷的浓度比不含OBRS 的配方米粉的高20多倍。 与 FDA 调查结果的比较 在2012年9月19日, FDA发布了第一份关于美国市场中将近200 多个大米及大米产品样品的分析结果。在这些样品中,有32个米粉样品,婴儿米粉样品只有3个(表8)。FDA的报告中iAs 的数值比我们的结果高得多。 FDA 测试的米粉中无机砷 (iAs)的均值为3.5pg/份(1.5-9.7pg/份),婴儿米粉中为 2.7 pg/份。 本实验中23个婴儿米粉样品中 iAs 均值为 1.5 pg/份,8个混合谷类米粉 iAs 均值为 0.9 pg/份。 iAs 浓度介于0.8-2.4pg/份(表7)。 表8.FDA婴儿米粉分析结果总结摘自“Rice/Rice Product Sampling-September 2012” 样品编号 产品类别 样品描述 原产国/ 地区 无机砷/份 (pg/份*) 70145 米粉 有机全谷物米粉(婴儿) NR 3.2 720341 米粉 有机全谷物米粉(婴儿) NR 2.9 719983 米粉 单谷物大米粉(婴儿) NR 2.0 *每份的大小基于21CFR 101.12规定的婴儿米粉习惯消费参考量 (RACC), 每份设为15g以计算每份的无机砷含量(ug) 本研究证明了 FDA元素分析手册 (EAM):4.11节指定的 HPLC-ICP-MS 方法可成功应用于婴儿米粉中砷形态分析。灵敏度 (LOD和 LOQ) 和精密度 (%RSD) 足以检测低浓度的所有砷形态,包括比之前 FDA 关于婴儿米粉研究中发现的 iAs 更低的浓度。本研究为大米以及大米相关的婴儿米粉中的砷含量评估提供了大量非常必要的新信息。 致谢 我们要感谢安捷伦科技有限公司的 Amir Liba 和 Mike Woodman提供的技术支持,还要感谢安捷伦科技有限公司提供HPLC-ICP-MS 设备。 更多信息 这些数据仅代表典型的结果。 有关我们的产品与服务的详细信息,请访问我们的网站www.agilent.com。 ( 1. B . Jackson, et al. , "Arsenic, Organic Foods, and Brown Rice Syrup", Environ. Health Perspect., 2012,120,623-626 ) ( 2.E B. Jackson, et al. , "Arsenic concentration and s pecia-tion i ninfant formulas and first foods", Pure Appl. Chem., 2012,84(2), 215-225 ) ( 3.A A. Carey, et al.,"Phloem transport of arsenic species from flagleaf to grain during grain f illing", New Phytol. 2011,192(1), 87-98 ) ( 4 . A A. Meharg, et al., "Arsenic & Rice", 2012, ISBN-13, 978- 9400729469 ) ( 5. A. M eharg, et al., "Geographical Variation i n T otal andInorganic Arsenic Content of Polished (White)Ric e ", Environ. Sci. Technol., 2009,43(5),1612-1617 ) ( 6. G C . S un, et al. , "Inorganic arsenic in r ice bran a nd its p roductsare an order of magnitude higher th a n in bulk grain", E nviron. Sci. Technol.,2008,42(19),7542-7546 ) 7. N. Vela, D. Heitkemper, "Total arsenic determination andspeciation in infant food products by ion chromatogra-phy-inductively coupled plasma-mass spectrometry",J. AOAC Int.,2004,87(1),244-252 作者 Bing Yue 中国北京国家食品安全风险评估中心 ( Juane Song、K e Xie、Zhao-jun Yun和 Jian- q iu Mi ) ( 安捷伦科技公司,中国北京 ) 使用 HPLC-ICP-MS 快速测定精白米中的五种砷形态 众所周知,砷(As)是一种有毒元素,可存在于环境和食品中。因此,多个国家和地区对其进行了严格监管。然而,由于砷的生物毒性在很大程度上取决于其化学形态,因此砷形态分析比总砷分析更为重要。例如,如果已知一种海藻样品含有高浓度砷,但主要以 AsB形式存在,那么食用该样品就没有潜在风险,因为 AsB 是无毒的。在砷的五种主要形态As(V)、MMA、As(III)、DMA 和 AsB中, 只有两种无机形态 (As(III) 和 As(V))是有毒的。这些无机砷还对人体有致癌作用,因此尤其需要对食品中的无机砷进行测定。以大米为主食的国家对大米中的砷特别关注。水稻可从土壤和水中吸收砷。与其他农作物相比,水稻的生长需要大量的水,因此更可能发生砷积聚。 本研究展示了使用配备 Agilent ZORBAX SB-Aq 色谱柱的 Agilent 1260 HPLC 系统与Agilent 7900 ICP-MS 联用对大米中有毒砷形态的快速测定方法。 仪器 将包含四元泵、自动进样器和真空脱气机的 Agilent 1260 HPLC 系统与 Agilent 7900 CP-MS 联用。使用 PFA管线将色谱柱出口端轻松连接至 ICP-MS 雾化器。在整个分析过程中, Agilent ZORBAXSB-Aq (部件号880975-914,4.6 mm 内径x250 mm, 5pm)反相色谱柱保持在室温下运行。流动相为20mM柠檬酸和5mM 己烷磺酸钠,用氢氧化钠调节至 pH=4.3。实验中对 5 pL 和 100 pL两种进样量进行了评估。 HPLC 和 ICP-MS 操作参数见表1。 配备八极杆反应池系统(ORS)碰撞/反应池(CRC) 的 Agilent7900 ICP-MS 能在多种干扰条件下对砷进行高灵敏度和高特异性分析。o一些法规指导中规定必须使用盐酸提取食品样品以模拟胃内条件。而在本研究中,基于 ArCl 和 CaCl 形成的多原子离子可能对砷的唯一同位素 (m/z 75)造成质谱干扰。然而,在氦气模式下运行7900 ICP-MS ORS 可有效去除这类基体中多原子对砷的干扰。 表 1. Agilent 1260 HPLC 和 7900 ICP-MS 的运行条件 ICP-MS参数 RF 功率 1550W 取样深度 8 mm 载气 0.6 L/min 尾吹气 0.5L/min 反应池气体 He, 4mL/min KED 3V 监测的同位素 75As、35CI 驻留时间 1.0s/5As; 0.1 s/35Cl HPLC 参数 流动相 等度洗脱, 20mM C,Hg0,和5mM C,HNaO,S, 用 NaOH 调节至pH=4.3 色谱柱 Agilent ZORBAX SB-Aq 流速 1.2mL/min 温度 室温 进样量 5 pL 或 100pL 运行时间 4 min 化学品与试剂 As(V)、MMA、As(III)、DMA 和 AsB 的标准储备溶液购自 NIMC(中国北京国家计量科学研究院)。高纯柠檬酸(≥99.5%)、己烷磺酸钠(≥98%)和氢氧化钠(≥99.99%) 购自 Sigma Aldrich 化学品公司(英国)。使用超纯级 HNOs (英国 Sigma Aldrich 公司) 进行样品前处理。 精白米购自中国以下地区:江苏、福建、辽宁、重庆和江西。 将精白米样品碾碎并用30目滤网过筛,制成米粉。称取1.00 g米粉置于聚丙烯离心管(50 mL)中。加入15 mL 0.15 M HNO3,然后涡旋混合30秒。将盖紧盖的管在室温下放置过夜;然后置于90°℃烘箱中2.5小时,每30分钟振荡30秒。提取完成后,将样品置于4℃冰箱中冷却。将冷却的米粉悬浊液以8000 rpm离心15分钟,然后用 0.22 pm 聚醚砜 (PES) 过滤器对上清液进行过滤。在4℃下储存滤液并在24小时内完成分析,以最大限度减少砷的形态间转换。 分离与定量 制备6种不同浓度的校准标准溶液(含5种砷形态):1 ppb、5 ppb、10 ppb、50 ppb、100 ppb 和200 ppb, 并进行分析。10 ppb标准标准溶液(进样量5pL)的色谱图显示5种砷形态均在4分钟内得到良好分离(图1)。所得结果用于绘制砷形态校准曲线,如图2所示。 Full Time Range EIC(75) :019CALS.d 图1.10 ppb砷(以砷元素浓度计)形态混合物标准品的色谱图(进样量5pL) 图2. As(V)、MMA、As(III)、DMA和AsB 的校准图显示出良好线性 检测限 每种拓形态的检测限(DL)按照等同于标准品色谱图的色谱峰-峰基线噪音(S/N)三倍的浓度进行计算。结果汇总于表2。如表中所示,当进样量为5pL时,5种砷形态的检测限介于0.106-0.667 ppb 之间,当进样量为100pL时,则介于 0.010-0.042 ppb之间。 表 2. As(V)、MMA、As(III)、DMA 和 AsB 在 5pL 和100 pL 进样量下的检测限(ppb) 进样量(pL) As(V) MMA As(III) DMA AsB 5 0.106 0.121 0.187 0.267 0.667 100 0.010 0.012 0.025 0.028 0.042 图3显示 50 ppt砷形态标准品混合物的色谱图(进样量100pL),展示了此方法的超痕量分析能力。 图3.50 ppt砷形态混合物的色谱图(进样量100 pL) 有证标准物质(CRM)分析 此方法用于分析 NIST 1568a 和 NIST 1568b2种米粉有证标准物质。尽管 NIST 1568a 中仅认证了总砷含量(290±30 ppb), 但许多文献已对 CRM 进行了良好表征。按上述样品前处理方法提取2种CRM, 并分析5种砷形态。 表3和4汇总了2种 CRM 中无机砷形态、MMA、DMA 和总砷含量的定量结果、认证值或文献中的报道值。本研究中,由无机砷、MMA、DMA 和 AsB 的总和计算得到总砷含量。如表中所示, NIST 1568b 中无机砷 (iAs) 和两种 CRM 中总砷含量的定量结果与认证值一致,且均处于标准偏差内。每种砷形态的定量结果同样与文献中报道的值一致1-4。 表 3. NIST 1568b 米粉中砷形态的定量分析结果 As(V)(pg/kg) MMA(pg/kg) As(III)(ug/kg) DMA(ug/kg) iAs(ug/kg) 总砷(ug/kg) 本研究 62.0±5.1 10.6±1.3 36.8±5.8 179±7 98.8±3.6 288.4 认证值 11.6±3.5 180±12 92±10 285±14 数值为10次进样的平均值±SD,无机砷: As(III)和As(V)的总和 表4.本研究中测定的 NIST 1568a 米粉中砷形态的定量结果与文献值的比较。NIST1568a中总砷含量的认证值为290±30 ppb As(V)(ug/kg) MMA(pg/kg) As(III)(pg/kg) DMA(pg/kg) iAs (pg/kg) 总砷 (pg/kg) 参考文献[1] 44±2 12±0.8 52±1 173±2 100 281±2 参考文献[2] 50.3±2.9 14.9±3.9 63.4±3.5 144±4.5 113.7 272.8±9.9 参考文献[3] 53.7±3.3 14.8±1.8 54.7±1.4 165±8 108.4 288.2 参考文献[4] 13.6±2.5 168.0±2.2 104.3±4.4 286.1±3.8 本研究 64±5 14±2 57±4 140±4 121 275±4 数值为10次进样的平均值±SD, °无机砷: As(III)和 As(V)的总和 加标样品回收率 本研究测定了5种砷形态的加标样品回收率。将 As(V)、MMA、As(III)、DMA 和 AsB 的混合液分别以 1 ppb、5 ppb 和10 ppb的浓度加标至三种大米样品萃取物中。平行制备三份溶液(加标样品1、2和3)。如表5所示,每份加标溶液中各个浓度下的所有砷形态均获得了良好的回收率,均介于85%-110%之间。 精密度 通过对大米样品重复进样10次测定方法的精密度。表6列出了所有砷形态的浓度结果,表明10次分析均具有出色的重现性。所有砷形态的%RSD 均小于4%,无机砷的%RSD 小于2%。 表6.大米#4的重现性结果(n=10,进样量5pL) 样品 As(V) (pg/kg) MMA (pg/kg) As(III)(pg/kg) DMA (pg/kg) AsB (pg/kg) iAs (pg/kg) 大米#4-1 56.10 未检出 107.32 22.29 未检出 163.42 大米#4-2 55.23 未检出 110.39 24.74 未检出 165.62 大米#4-3 56.97 未检出 107.30 23.10 未检出 164.27 大米#4-4 57.68 未检出 108.51 24.19 未检出 166.18 大米#4-5 57.16 未检出 108.46 23.64 未检出 165.62 大米#4-6 56.10 未检出 108.52 24.82 未检出 164.62 大米#4-7 56.43 未检出 108.89 23.96 未检出 165.32 大米#4-8 57.27 未检出 107.90 22.37 未检出 165.17 大米#4-9 56.18 未检出 109.56 22.70 未检出 165.73 大米#4-10 56.71 未检出 108.76 23.35 未检出 165.47 平均值 56.58 - 108.56 23.52 一 165.14 %RSD 1.3% 0.9% 3.9% 0.5% 样品名称 加标浓度 As(V) MMA As(III) DMA AsB 浓度(ppb) 回收率(%) 浓度(ppb) 回收率(%) 浓度(ppb) 回收率(%) 浓度(ppb) 回收率(%) 浓度 (ppb) 回收率(%) 大米#1 0.48 未检出 4.60 0.48 未检出 加标样品1 1 ppb 1.38 89.2% 1.02 101.5% 5.65 105.6% 1.54 106.1% 1.03 103.2% 加标样品2 1.43 94.5% 0.96 96.2% 5.51 90.8% 1.42 93.9% 1.07 106.5% 加标样品3 1.47 98.1% 0.95 94.3% 5.52 92.2% 1.45 97.4% 0.98 98.4% 大米#2 1.14 - 未检出 5.82 1.32 一 未检出 加标样品1 5 ppb 5.52 87.6% 4.96 99.2% 10.98 103.2% 6.23 98.3% 4.82 96.3% 加标样品2 5.65 90.1% 4.77 95.3% 10.88 101.3% 6.45 102.6% 4.97 99.4% 加标样品3 5.77 92.5% 4.34 86.7% 11.35 110.6% 6.62 106.1% 5.13 102.6% 大米#3 0.28 未检出 - 3.44 - 0.73 一 未检出 加标样品1 10ppb 9.65 93.7% 9.68 96.8% 13.35 99.1% 9.72 89.9% 8.91 89.1% 加标样品2 9.89 96.1% 10.08 100.8% 12.97 95.3% 10.29 95.6% 9.54 95.4% 加标样品3 9.53 92.5% 10.62 106.2% 13.10 96.6% 10.65 99.2% 10.48 104.8% 20种市售大米样品中的砷浓度测定结果列于表7中。如表中所示,20种大米样品中均含有 As(V)、As(III) 和 DMA。大米样品中的无机砷和 DMA含量差异很大,可能反映了原水稻生长环境中的砷浓度。虽然各样品中的有毒无机砷浓度不同,但所有大米样品中的无机砷含量均低于食品法典委员会的建议上限0.2 mg/kg。 表7.20种大米样品中5种砷形态的定量结果(ug/kg) 样品名称 As(V) MMA As(ⅢII) DMA AsB iAs 大米#1 7.27 未检出 68.97 7.16 未检出 76.24 大米#2 17.15 未检出 87.23 19.77 未检出 104.38 大米#3 4.26 未检出 51.57 10.93 未检出 55.83 大米#4 56.10 未检出 107.32 22.29 未检出 163.42 大米#5 17.31 未检出 147.2 26.38 未检出 164.73 大米#6 12.52 未检出 75.82 8.79 未检出 88.35 大米#7 7.14 未检出 53.84 2.67 未检出 68.94 大米#8 14.4 未检出 106.14 27.27 未检出 120.54 大米#9 14.49 未检出 72.24 29.51 未检出 86.73 大米#10 13.73 未检出 101.68 39.41 未检出 115.41 大米#11 20.50 未检出 87.04 285.21 未检出 107.55 大米#12 22.78 未检出 70.94 160.77 未检出 93.72 大米#13 23.74 未出 122.19 34.53 未检出 145.94 大米#14 13.85 未检出 59.79 361.82 未检出 73.64 大米#15 16.38 未检出 91.34 83.42 未检出 125.38 大米#16 18.48 未检出 110.58 32.25 未检出 129.06 大米#17 10.83 未检出 61.56 6.69 未检出 72.39 大米#18 16.96 未检出 105.14 209.49 未检出 122.1 大米#19 36.04 未检出 97.17 176.12 未检出 133.22 大米#20 16.35 未检出 74.55 587.49 未检出 90.9 本研究采用 Agilent 1260 Infinity LC 与 Agilent 7900 ICP-MS联用对精白米中的5种砷形态进行了分离。该方法分析速度快,可在四分钟内测定包括毒性相关无机形态 As(III) 和 As(V) 在内的5种砷形态,同时具有出色的灵敏度、准确度和精密度。采用在氦气模式下运行的 ORS 池可去除对砷的任何潜在干扰,例如 ArCl*。 在20种大米样品中均检测出了不同浓度的无机砷和 DMA。然而,所有样品均未超过食品法典委员会的建议限值 0.2 mg/kg。 ( 本文中列出的经验证方法适用于快速测定大米和其他食品样品中的痕量 As(V)、MMA、As(III)、 D MA 和AsB。 ) ( 1 . Narukawa T., Inagaki K. , Kuroiwa T., Chiba K, "The extractionand speciation of arsenic in rice flour by HPLC-ICP-MS'[], Talanta 77,2008,427-432 ) ( 2. : F Huang J H, Igen G, B lank value, adsorption,preconcentration,and preservation for arsenic speciation of the environmentalwater samples'[ ] . Analytica Chimica Acta, 2004, 512:1-10 ) ( 3.Caruso J.A,B ' Hymer C, Heitkemper D.T., 'An evaluation of extraction techniques for arsenic species from freeze-driedapple sample'[]. Analyst, 2001 , 126:136- 1 40 ) ( 4 . T oni Llorente-Mirandes et al.,' A fully validated method forthe determination of arsenic species in rice and infant cereal products, Pure Appl. Chem., 2012,vol. 84, No. 2, 225-238 ) 作者 Jenny Nelson、 Helene Hopfer、加州大学戴维斯分校葡萄栽培和酿酒系,美国加利福尼亚州戴维斯 ( Jenny Nelson、 H elene H opfer、 加州大学戴维斯分校食品安全与测 量 机构,美 国 加利福尼亚州戴维斯 ) ( Jenny Nelson、F a bio Silva、 ) ( Steve Wilbur、Jianmin Chen 和 ) Kumi Shiota Ozawa 安捷伦科技有限公司,美国加利福尼 亚州圣克拉拉市 Helene Hopfer1 HM Clause 公司,美国加利福尼亚州 戴维斯 Philip L. Wylie 安捷伦科技有限公司,美国特拉华州 臧尔明顿 利用基于 GC-ICP-MS/MS的磷和硫检测方法测定食品中的农药 前言 测定食品中的农药残留对于婴幼儿来讲尤其重要,因为他们摄入的食物量换算到单位体重会非常高。某些农药是已知的或疑似的内分泌干扰物(EDC),因此,即使它们浓度较低,也可能干扰天然激素的功能,从而严重影响儿童的成长。因为通过饮食长期低剂量接触农药,使得人们越来越关注能够将快速样品前处理与联用的分离和检测相结合的高灵敏度分析方法的开发。大多数农药残留实验室使用QuEChERS (快速、简便、经济、高效、耐用和安全)萃取方法。对于热稳定的弱极性农药,通常使用气相色谱串联质谱 (GC/MS/MS)分析提取物,对于挥发性较小和/或极性较强的农药,则使用液相色谱串联质谱(LC-MS/MS) 进行分析。,一种近年来开发的替代技术涉及将气相色谱与串联四极联 ICP-MS联用(GC-ICP-MS/MS),该系统能够通过测量大多数农药中的杂原子P和S(以及CI和Br) 来测定农药。 GC-ICP-MS/MS提供了非常出色的选择性和特异性,并且灵敏度优于成熟的方法。本研究所述的方法可应用于其他化合物,例如有机磷化学战剂、溴代阻燃剂、聚合物添加剂以及香精和香料中的痕量硫化合物。 实验部分 试剂 三种农药混标购自 Ultra Scientific (Kingstown, RI, USA) 和安捷伦科技公司(部件号5190-0468)。用高纯度乙腈稀释标准溶液以形成中间溶液,然后利用中间溶液通过乙腈连续稀释来配制校准标样溶液。 样品与样品前处理 对几种不同食品基质中的农药含量进行检测,包括婴儿食品水果泥(购自巴西圣保罗)和三种茶叶(购自中国)。将所有食品基质均质化,应用 AOAC 2007.1 QuEChERS 方法叫,使用 QuEChERS 萃取试剂盒(部件号5982-5755)重复萃取三次。 首先,称取约15±0.1g婴儿食品样品或5±0.1g 茶叶置于50mL离心管,并向其中加入15mL乙腈。放入两个陶瓷均质子,使用涡旋混合器对每个样品进行1 min 的均质化混合。加入包含6gMgSO4和1.5g NaCl 的 Agilent Bond Elut QuEChERS 萃取无水盐包。将混合物搅拌1 min,然后在2600 g 下离心5 min。 然后,将8mL的上层乙腈溶液转移至15mL用于一般水果和蔬菜的 Agilent Bond Elut QuEChERS 分散 SPE 离心管(部件号5982-5058)中,其中包含N-丙基乙二胺 (PSA) 和 MgSO4。将离心管涡旋混合 1 min 并在 2600 g 下离心5 min。将所得的上清液转移至棕色色璃样品瓶(部件号5183-4496)中进行分析。 仪器 ( 使用安捷伦GC-ICP-MS 接口 (G3158D) 将 Agilent7890气相色 谱仪与 Agilent 8800 ICP-MS 联用。将两根安捷伦色谱柱串联使 用。第一根色谱柱5m长,从2 0 mx0.18mmx0.18 um(膜 厚) DB-35ms 超高惰性(UI)毛细管柱 ( 部件号121-3822UI)切 下((5m色谱柱以部件号 G3903-61005 提供)。该色谱柱安装 ) 在进样口和吹扫接口的一端之间,并且在运行马上结束前进行反吹,以免高沸点污染物进入第二根色谱柱。第二根色谱柱为15mx0.25mm(内径)×0.25 um (膜厚) DB-5MS UI 毛细管柱(部件号19091S-431UI),其安装在吹扫接口的另一端和 GC 柱温箱内 ICP-MS传输线接口之间。进样口保持280℃,在不分流条件下进样,进样量为1pL。利用预加热的尾吹气将气相色谱流出物高效带入等离子体中。 GC 操作参数在之前的研究中详细列出出。 磷和硫具有较高的第一电离势,因此它们在 ICP-MS 等离子体中很难被电离,导致其测量灵敏度相对较低。它们也很难通过传统的四极杆 ICP-MS (ICP-QMS) 进行测量,因为光谱干扰很强。然而,在 MS/MS 反应池模式下操作的 ICP-MS/MS 适用于解决这些光谱干扰问题,相比于之前所用的 ICP-QMS, 其能够对浓度低得多的P和S进行定量分析。在本研究中,使用 MS/MS 质量转移模式并以02作为反应池气体,分别以m/z 47处的反应子离子31PO+和 m/z 48处的反应子离子32SO+的形式对P和S进行测量。 在 ICP-MS/MS 调谐过程中,将供应给气相色谱进样口和辅助电子气路控制 (aux EPC) 模块的氦气载气替换为包含 100 ppm H2S的氩气。针对来自H2S 加标氩气的32S+信号,对氧气反应池气体流速和反应池设置进行优化。在切换回纯氦气后,观察到较高的残留硫背景,表明需要在另一个位置将调谐气体引入 ICP-MS/MS以实现更常规的应用。ICP-MS/MS 操作条件见表1。 表 1. Agilent 8800 ICP-MS/MS操作条件 P和S测量 采样深度(mm) 3 尾吹气流速(L/min) 0.6 八极杆偏置电压(V) -0.5 动能歧视(V) -13 反应池气体 02 反应池气体流速 满量程的20% Q1》Q2 结果与讨论 为确认 GC-ICP-MS/MS 方法的线性,分别使用10个和6个校准标样以及空白溶液生成P(约0.01-16pg/L) 和S(约0.8-33pg/L)的校准曲线。该浓度代表测量农药中的这些元素所需的范围。在常规操作中,每种化合物的校准可简化为采用3个或4个校准浓度。在所有化合物中,P和S这两种元素均获得了高于 0.997 的相关系数(R),表明在校准范围内具有优异的线性,如表2所示。P和S的代表性校准曲线如图1所示。 表2.基于 PO+和 SO+ 测量得到的18种农药化合物的校准范围和相关系数(R) P S 化合物 保留时间±0.3(min) 化合物的校准范围 (pg/L) 相关系数(R) 化合物的校准范围(pg/L) 相关系数(R) 敌百虫 4.103 0.02-12 0.999 虫线磷 5.926 0.02-12 0.999 1-12 0.996 特丁磷 7.071 0.02-11 0.999 1.3-33 0.997 地虫磷 7.185 0.02-13 0.999 2-26 0.997 磷胺 7.299 0.02-21 0.998 除线磷 7.858 0.01-10 0.999 0.8-10 0.999 甲基毒死蜱 7.973 0.01-10 0.997 0.8-10 0.995 杀螟硫磷 8.44 0.02-11 0.999 2-11 0.999 丙硫特普 8.705 0.02-16 0.999 0.7-16 0.998 毒虫畏 9.486 0.01-9 0.996 丁烯磷 9.541 0.01-10 0.999 三硫磷 11.158 0.08-9 0.999 1.1-28 0.997 乙硫磷 11.527 0.02-15 0.999 氨磺磷 12.547 0.01-10 0.998 4-20 0.991 亚胺硫磷 12.851 0.14-10 0.996 溴苯磷 13.263 0.01-8 0.999 1-8 0.999 益棉磷 13.827 0.01-9 0.999 3-19 0.996 敌杀磷 14.587 0.02-14 0.998 图1.上图:除线磷的校准曲线,基于P的响应(以PO+测量)。 下图:丙硫特普的校准曲线,基于S的响应(以SO+测量) 根据农药和所用的仪器不同,采用目前的 GC/MS/MS 仪器获得的农药的检测限(DL)通常在约0.1至10pg/L之间变动3.4。表3所列的数据表明 GC-ICP-MS/MS 在有机药农药的测定中提供了与GC/MS/MS相近或略低的 DL。对于含硫农药而言, GC-ICP-MS/MS检测限与 GC/MS/MS 获得的检测限相近或略高。表3所列的大部分农药均可通过其P含量得到检测,且定量限 (LOQ) 远低于大多数食品安全实验室所要求的 10 pg/L。 图2示出农药混标中P和S的叠加色谱图。可轻松鉴定出包含多种杂元素的农药。对实际食品样品中的农药含量进行了测量,四种食品和 200 pg/L农药混标中的P信号的色谱图如图3所示。有机磷农药的迹线可以在检测的所有食品样品中查看。 表3.农药化合物及农药杂原子元素的检测限。检测限(LOD)由3倍信噪比 (S/N)计算得出 P S 农药 RT±0.3 (min) 化合物 DL (ug/L) 元素DL(pg/L) 化合物DL(pg/L) 元素 DL (pg/L) 敌百虫 4.103 0.178 0.021 虫线磷 5.926 0.221 0.028 11.93 1.580 特丁磷 7.071 0.718 0.077 9.708 3.231 地虫磷 7.185 0.455 0.057 7.917 2.057 磷胺 7.299 0.923 0.095 除线磷 7.858 0.362 0.036 15.80 1.604 甲基毒死蜱 7.973 0.613 0.059 24.18 2.399 杀螟硫磷 8.440 0.907 0.101 19.52 2.253 丙硫特普 8.705 0.200 0.033 9.912 1.676 毒虫畏 9.486 2.020 0.174 丁烯磷 9.541 3.338 0.329 三硫磷 11.158 0.583 0.053 9.585 2.684 乙硫磷 11.527 0.707 0.114 11.51 3.832 氨磺磷 12.547 2.206 0.210 20.61 4.054 亚胺硫磷 12.851 3.829 0.374 溴苯磷 13.263 1.125 0.085 18.35 1.425 益棉磷 13.827 1.812 0.163 21.33 3.952 敌杀磷 14.587 1.392 0.189 7.840 2.198 图3.示例色谱图示出在四种食品样品和200 pg/L校准标样中测得的P信号转载经J. Agric. Food Chem., 2015, 63, 4478-4483授权。版权所有(2015)美国化学学会 结论 GC-ICP-MS/MS 方法适用于通过测量杂原子含量对有机磷和有机硫农药进行高选择性和高灵敏度检测。由于 Agilent 8800 ICP-MS/MS具有显著更低的背景,因此 GC-ICP-MS/MS 相比于 GC/MS/MS为有机磷农药的测定提供了更好的灵敏度。在调查的所有实际食品样品中,均检测出了农药。 关于本应用的完整记述,请参见: Jenny Nelson, Helene Hopfer,Fabio Silva, Steve Wilbur, Jianmin Chen, Kumi Shiota Ozawa, andPhilip L. Wylie,Evaluation of GC-ICP-MS/MS as a New Strategyfor Specific Heteroatom Detection of Phosphorus, Sulfur, andChlorine Determination in Foods, J. Agric. Food Chem., 2015,DOI: 10.1021/jf506372e ( 参考文 献 ) ( 1.5 S . J. Lehotay et al., Determination of pesticide residuesin foods by acetonitrile extraction and partitioning withmagnesium sulfate: co l laborative study, J AOAC Int. 2007 Mar-Apr;90 (2): 485-520 ) ( 2. P. L . Wy l ie、C. Meng, 安捷伦三重四极杆 GC/MS/MS分析175种农药残留,安捷伦出版物,2009,5990-3578CHCN ) ( 3. M. Churley,安捷伦科技公司。应用简报5991-4131CHCN 2014,1-10 ) ( 4 . G. E. Mercer, B. Neuhaus,J. Jones, M. Wong,FDA/ORA/DFS Lab. I nf. Bull.1-32 ) 采用 Agilent 8800 ICP-MS/MS 通过HPLC-ICP-MS 联机进行苹果汁中砷的形态分析 Mina Tanoshima*、Tetsushi Sakai*和Ed McCurdy 安捷伦科技公司 *日本东京 英国斯托克波特 食品中潜在有毒元素和化合物的存在日益受到公众的密切关注,因此,食品生产者及管理部门就要求有快速、可靠的筛选方法来准确定量食品和饮料中这些污染物的含量。对于砷(As)而言,它在食品中的富集浓度可能会通过以往含砷农药如砷酸氢铅(砷酸铅)或砷酸钙的使用而上升。这些化合物作为收获前农药在20世纪广泛用于控制水果类作物(主要是苹果)上的害虫,如苹果蠹蛾、苹果蛆和果蝇。虽然在1970年禁止了这些农药的广泛使用,但是砷酸铅和砷酸钙非常稳定并可长期存留于土壤之中,因此在其应用被禁止很长时间以后仍可以影响在污染土壤中生长的作物。 食品安全中的砷形态分析非常重要,因为元素的毒性程度强烈依赖于其存在的化学形态或种类。众所周知,无机砷如亚砷酸盐 (As(III)) 和砷酸盐 (As(V))具有高毒性和致癌性,而有机砷如单甲基胂酸 (MMA)和二甲基胂酸 (DMA) 却毒性较低,砷甜菜碱 (AB)更被认为是无毒的。因此对许多类样品包括饮用水、食品和饮料、药品和石油化学制品中的无机砷含量水平已经开展日常监测。 针对多种类型的样品,如饮用水和尿液,已建立了通过 HPLC分离各种含砷化合物然后使用 ICP-MS 进行检测的完善分析方法。 本研究开发了一种新的样品制备方法,包括样品过滤和采用去离子水稀释,用于苹果汁中低浓度水平砷形态的快速、日常检测。使用文献1建立并经确证的方法来分离和定量分析六种商品苹果汁中的上述五种砷形态,以确定这种日常消费的果汁中是否含有潜在有害浓度水平的砷形态。 美国环境保护署(USEPA)已建立了饮用水中总砷的最高污染物水平(MCL) 限量为 10 pg/L。但我们必须考虑到食品中的砷是总膳食摄入量的一部分, USEPA 和欧洲食品安全局推荐的限量是每天0.8-8 pg/kg 体重。正常饮食中砷的其他膳食来源包括海产品、稻米等。 样品制备 六种不同的苹果汁样品(苹果汁#1-#6)购自日本某超市。苹果汁样品采用两种一次性过滤器过滤(美国密理博公司的 Millex-LH,然后是日本 TOSHO 公司的 TOYOPAK ODS M) 。采用 Millex-LH过滤器去除苹果汁中的固形物,然后采用 TOYOPAK ODS M 过滤器去除非极性化合物,防止 HPLC色谱柱过载。按照制造商的说明对两种过滤器进行清洗和活化。过滤后,苹果汁样品用超纯水稀释一倍。应避免剧烈的样品消解和高稀释倍数,以最大程度地减少砷形态的相互转化,并且保证获得原样品最低的检测限。 为了评价方法对低浓度砷形态的准确检测能力,我们评估了样品制备过程中砷形态污染的可能性。按如下方式进行空白样品制备,用于识别源于不同样品制备步骤的任何可能能染: 1.去离子水空白 2. Millex 膜过滤器空白 3.TOYOPAK ODS 过滤器空白 4.方法空白(像样品一样过滤两次的去离子水) 所有四个制备空白样品采用文献1建立的HPLC 方法及其使用的色谱柱和流动相进行检测,色谱图见图1。四个制备空白与一个混合砷形态标准品(每种形态50 ng/L (ppt)) 的叠加色谱图确认,制备空白中未检出砷。 应注意,第一个洗脱出的峰是砷甜菜碱(AB),它未保留在柱子上,因此在柱空体积中被洗脱出来,它还可能与其他不被柱子保留的中性或阳离子组分共洗脱出来。虽然可利用所述的LC-ICP-MS方法来测量AB,但如果样品中存在其他共洗脱物质,结果可能会出现偏差;但对于食品安全应用来讲,这并不是个问题,因为AB即使浓度非常高,也是没有毒性的。 为了保证食品安全,必须分离并准确定量低浓度的关键形态一As(III)和As(V), 它们的总量可称为“总无机砷”。 仪器 联用一台包括二元泵、自动进样器和真空脱气机的 Agilent 1290Infinity LC 系统及一台 Agilent 8800 电感耦合等离子体串联质谱仪(ICP-MS/MS)。分离采用一根阴离子交换保护柱(安捷伦部件号G3154-65002,4.6 mm 内径 x 10 mm 聚甲基丙烯酸酯)及一根砷形态分析分(安捷伦部件号 G3288-80000, 4.6 mm 内径x250mm 聚甲基丙烯酸酯)。整个实验过程中色谱柱在室温下运行。 HPLC 和 ICP-MS操作参数见表1。 砷形态的日常分离分析不需要使用 ICP-MS/MS 分离干扰物,因为对砷(m/z 75)有潜在多原子重叠的干扰在色谱中即已实现分离。如文献1所述,无机氯化物在 As(III) 和 MMA 峰之间流出,因此,由氯化物形成的 ArCI* 多原子离子不会影响任何目标砷化合物的测定。 然而,食品和饮料中的砷形态分析已经延伸到对极低浓度(低ng/L 或 ppt水平)有毒无机化合物的更高灵敏度检测。 表1. Agilent 1290 LC 和 8800 电感耦合等离子体串联质谱系统的操作参数 1290 Infinity LC 条件 数值 色谱柱 G3154-65002(保护柱), G3288-80000, 4.6x250 mm(分析柱) 流动相 2.0 mM PBS/0.2 mM EDTA/10 mM CH,COONa/3.0 mMNaNO/2%EtOH, pH 11.00 (NaOH 调节) 流速 1.0 mL/min 柱温 室温 进样体积 100pL 8800 ICP-MS/MS 参数 数值 射频功率 1550 W 载气流速 1.05 L/min 雾化室温度 2°C 采样深度 10mm 提取透镜1 0V 四极杆模式 单四极杆模式 池气体模式 无气体 并且与常规四极杆 ICP-MS 相比, Agilent 8800 ICP-MS/MS的背景干扰非常低,因此它可能更具分析优势。假如方法要求可以接受稍高的检测限,上述样品制备和 HPLC方法无需任何修改即可全部转移到 Agilent 7700 系列 ICP-MS(灵敏度比8800约低2倍)上,但其检测限仍在十几 ng/L (ppt) 的范围。 每种砷形态的检测限通过三倍色谱峰-峰信噪比 (S/N)来计算, 或者有时用 S/N=3时的分析物浓度来表示。所有五种砷形态的检测限介于 10-22 ng/L 之间,见表2。图2显示了用于计算 S/N 和LOD 的500 ng/L各砷形态标准品的色谱图,结果表明这五种砷形态具有高检测灵敏度和良好的峰分离度。 表2.砷甜菜碱(AB)、二甲基胂酸 (DMA)、As(III)(亚砷酸盐)、单甲基胂酸 (MMA)和As(V)(砷酸盐)3倍信噪比时的检测限 化合物 保留时间(min) 峰高 峰面积 噪音 S/N LOD(ng/L) 噪音类型 AB* 2.823 19584 249584 153 127.99 11.72 峰-峰 DMA 3.602 22117 277103 153 144.54 10.38 峰-峰 As(III) 4.128 18022 265346 153 117.78 12.74 峰-峰 MMA 6.566 14421 299863 153 94.24 15.92 峰-峰 As(V) 10.431 10265 329325 153 67.08 22.36 峰-峰 *砷甜菜碱(AB)在空柱体积中流出,由于存在一些其他共流出成分,无法对它进行可靠的定量分析 Full Time Range EIC(75):008CALS.d 图2.500 ng/L (ppt) 混合砷形态标准品的色谱图显示了高检测灵敏度和良好的峰分离度,以及用于 S/N 和 LOD 计算的噪音区 校准浓度范围为10-500 ng/L,表明各砷形划线性关系良好,如图3所示。 75 AB 75 DMA 图3.AB、DMA、As(III)、MMA 和As(V)的校准曲线 苹果汁分析结果 表3.采用LC-ICP-MS/MS分析六种商业苹果汁品牌中所有五种砷形态时的定量分析结果(ug/L) 六种不同苹果汁中的砷浓度测定结果见表3(结果已考虑到2倍稀释因素),色谱图见图4。我们从浓度结果可以清楚地看到,虽然大多数砷以有毒的无机形式存在,但所有苹果汁样品中总砷含量极低,大大低于 USEPA 针对饮用水规定的10 pg/L 的限度。图4中的色谱图以相同的强度刻度展示,突出每种砷形态的不同相对浓度。 浓度pg/L 样品名 稀释倍数 AB DMA As(III) MMA As(V) 无机砷 总砷 苹果汁1 2 0.069 0.196 0.704 0.033 0.631 1.335 1.600 苹果汁2 2 0.066 0.037 0.062 0.006 0.008 0.070 0.173 苹果汁3 2 0.063 0.292 0.847 1.633 0.827 1.674 3.662 苹果汁4 2 0.052 0.276 1.014 1.475 1.977 2.991 4.794 苹果汁5 2 0.067 0.225 1.196 0.795 0.724 1.920 3.007 苹果汁6 2 0.043 0.254 1.218 0.005 0.095 1.313 1.610 RT(min) RT(min) 图4.六种苹果汁样品中砷形态的色谱图 虽然砷形态在所有六种苹果汁中均有发现,但总砷浓度和不同砷形态的相对浓度各异。然而,在测试的所有果汁样品中,各砷形态的总浓度均低于5 ug/L, 低于 USEPA 对饮用水最大污染限度(10 pg/L) 规定的一半。所有样品中总无机砷(As(III)与 As(V)之和)的量低于3 ug/L, 并且所检测的六种苹果汁样品中有五个低于2pg/L。 加标回收率实验和重现性 图5.#1苹果汁加标 500 ng/L砷标准溶液的7次平行测量叠加色谱图 为了验证分析实际样品时的方法性能,采用混合砷形态标准溶液进行加标回收率实验。#1苹果汁样品加标砷形态标准品至2倍稀释样品中的浓度为 500 ng/L。加标样品按未知样品重复测定,总共分别测定7次。表4列出了所有砷形态的保留时间(RT)和浓度结果,表明7次重复分析的RT 和浓度具有优异的重现性。所有砷形态的保留时间%RSD 小于 0.5%, 浓度 %RSD小于 1.6%。所有7次进样的叠加色谱图见图5. 表4.1 pg/L标准溶液加标到#1苹果汁中的加标回收率测定结果(n=7) 样品名 AB DMA As(III) MMA As(V) 保留时间 (min) 浓度(pg/L) 保留时间 (min) 浓度(pg/L) 保留时间 (min) 浓度(pg/L) 保留时间 (min) 浓度(pg/L) 保留时间 (min) 浓度(pg/L) 苹果汁1加标1 2.77 0.848 3.62 1.112 4.19 1.606 6.43 0.980 10.62 1.524 苹果汁1加标2 2.76 0.862 3.61 1.116 4.19 1.632 6.43 0.996 10.63 1.560 苹果汁1加标3 2.77 0.872 3.61 1.125 4.19 1.621 6.41 1.007 10.62 1.551 苹果汁1加标4 2.77 0.886 3.61 1.122 4.18 1.632 6.41 1.003 10.63 1.554 苹果汁1加标5 2.78 0.882 3.61 1.134 4.19 1.643 6.41 1.008 10.65 1.561 苹果汁1加标6 2.78 0.873 3.61 1.146 4.17 1.637 6.37 1.016 10.68 1.597 苹果汁1加标7 2.78 0.881 3.60 1.145 4.17 1.651 6.35 1.018 10.69 1.588 平均值 2.78 0.872 3.61 1.128 4.18 1.632 6.41 1.004 10.65 1.562 标准偏差 0.0076 0.0133 0.0058 0.0135 0.0096 0.0148 0.0306 0.0130 0.0291 0.0242 %RSD 0.28 1.53 0.16 1.20 0.23 0.91 0.48 1.29 0.27 1.55 采用 Agilent 1290 Infinity LC 联用 Agilent 8800 ICP-MS/MS,测定了商品苹果汁中 pg/L 和亚 pg/L 浓度的包括毒性相关无机形式As(III) 和 As(V) 在内的五种砷形态。通过对苹果汁样品进行简单的过滤和2倍稀释,得到了所有砷形态在 10-20 ng/L (ppt) 范围内的检测限。所有检测的苹果汁样品中均发现了砷(As)形态,虽然各品牌中不同砷形态的浓度各异。在本研究所分析的样品中,所含的总砷均不超过 5 ug/L, 所有样品中无机砷(As(III) 和 As(V)形态之和)的浓度均低于3pg/L, 而且分析的六个品牌中有五个低于2pg/L。 基于对日本苹果汁市场上这个小样本的分析,我们的数据支持了目前美国食品和药品监督管理局 (FDA) 关于在无机砷残留提高的情况下,商品苹果汁对人体健康无明显风险的意见。我们对日本市场上苹果汁的测试结果肯定了美国 FDA 监测计戈的调查结果,即所有测试的苹果汁样品中,无机砷的含量水平低于饮用水中10 pg/L 的限量。 ( 参考文献 ) ( 1. T Tetsushi Sakai 和 Steve Wilbur, Routine Analysis of To x icArsenic Species in Urine Using HPLC with ICP -M S(采用 HPLC 和 ICP-MS常规分析尿液中的有毒砷形态),安捷伦 出版物5989-5505EN ) 使用氢化物发生法-ICP-MS高通量测定大米中的无机砷 ( Asta H . Petursdottir、 Stanislav Musil、N i ls Friedrich、Andrea Raab、Eva M. Krupp and Jorg Feldmann TESLA-Trace Element Speciation Laboratory, University of Aberdeen, Aberdeen,AB24 3UE, Scotland, UK ) 本文开发出了一种利用氢化物发生(HG) 技术与 ICP-MS分离并检测食品中无机砷 (iAs)的快速而灵敏的方法。31种市售大米中的无机砷含量测定值均低于现行中国法规中规定的最大浓度(ML)150pg/kg。 对 HG-ICP-MS 和 HPLC-ICP-MS 获得的数据进行比较后发现两种分析技术的检测限相当。 HG-ICP-MS 是大规模筛选大米等食品样品的理想选择,因为这一技术仅需耗费传统HPLC-ICP-MS 方法通常所需时间的一小部分,且分析性能不受任何影响。 Stanislav MusilInstitute of Analytical Chemistry ofthe ASCR, Brno, Czech Republic Asta H. PetursdottirMatis, Environment and GeneticsDepartment, Reykjavik, Iceland 为确保食品安全,应对食品中的砷类化合物等潜在毒性化学物质浓度进行密切监测。然而,砷类化合物的毒性取决于所含该元素的化学形态或“种类”而非总浓度。亚砷酸盐 (As(III))和砷酸盐(As(V))等无机砷公认具有高毒性和致癌性,而单甲基胂酸(MMA)和二甲基胂酸 (DMA) 等有机砷的毒性较低"。由于这种毒性差异的存在,因此大量研究致力于开发可靠而耐用的不同砷形态分离方法,以实现对毒性形态的特异性定量分析。 虽然不同形态的色谱分离与随后的 ICP-MS 形态特异性定量分析已经成为了食品样品中痕量元素分离的公认首选方法,但还存在许多比高效液相色谱(HPLC) 更省时更经济的砷形态分析非色谱策略2.3。 本文重点介绍利用氢化物发生(HG) 技术和 ICP-MS 对大米样品中的无机砷进行形态分析。大米是世界上大部分人口的重要食物来源,但由于水稻吸收了土壤中的砷而使大米中的无机砷浓度相对较高。土壤中的砷可能天然存在,也可能来自人为来源,例如20 世纪70年代前人们曾大量使用含砷农药。显然目前迫切需要一种简单而快速的分析方法来筛查大量样品中的无机砷以确保食品安全。 ( 现行法规 ) 中国已出台的法规中规定大米中无机砷的最大浓度(ML)为0.15 mg/kgl4,南美洲贸易集团则规定大米中总砷的最大浓度为0.3 mg/kg。食品污染法典委员会举行第八次会议后,世界卫生组织(WHO)建议精白米中的无机砷浓度不得超过 0.2 mg/kgl6.美国和欧盟尚未针对大米中的无机砷浓度进行立法,但美国 FDA和欧洲标准化委员会 (CEN) 已启动了致力于建立食品中无机砷测定标准方法的项目。 本研究评估了大米样品中无机砷测定的替代方法,证明无需采用耗时的色谱方法也可进行无机砷形态分析。 实验部分 化学品与标准品 所有标准溶液和样品均采用超纯水(>18MQ cm)制备。 化学品/标准品 目的 来源 1002 mg/L砷标准储备溶液 总砷浓度校准与 HG测定 Merck, UK 二甲基胂酸钠 (DMA, 98%) HPLC-ICP-MS 测定 ChemService, USA 铑: 1pg/L HG 测定中的内标 Specpure, Alfa Aesar, Germany 铑:25pg/L 总砷/形态分析中的内标 Specpure,Alfa Aesar, Germany 硝酸(69%) Fluka, UK 硝酸铵(98+%) Sigma-Aldrich, UK 铵溶液(28%)和碳酸铵 BDH, UK 过氧化氢(>30%w/v)、 磷酸铵、氢氧化钠(*实验纯) Fisher Scientific, UK 盐酸(32%,*实验纯) 氢化物发生反应 Fisher Scientific, UK 硼氢化钠(99%) Acros Organics, UK 消泡剂B乳浊液 Sigma-Aldrich (USA) 除另有说明,所有化学品均至少为分析级(AR)。 *LR=实验室级纯度 样品与参比物质 样品中包括31种购自本地商店的不同大米以及12种在受控砷暴露环境下生长的大米。使用咖啡研磨机将市售大米样品的子样品(30g)研磨成均匀的细粉。将 IMEP-107大米(比利时赫尔参比物质和测量研究所)和美国国家标准技术标究院 (NIST) 1568a 米粉 (Gaithersburg, MD, USA) 两种大米参比物质用作无机砷浓度测定的质量控制。 样品前处理 在测定总砷含量时,每份样品取 0.15g置于敞口消解容器中,加入1mL浓 HNO3和2mL H202(30%w/w), 并在 CEM Mars 微波系统中进行消解。使用去离子水将所有样品稀释至最终体积为30mL。 利用 HPLC-ICP-MS 进行无机砷形态分析时,取大米样品0.1 g加入10mL1%HNO3 和1%H202中进行提取 (5 min 50℃, 5 min75℃, 10 min 95℃)。采用 HG-ICP-MS 进行分析时样品提取物制备与上述方法相同。此外采用1%HNO3 和1%H202以与样品相同的方式配制校准标样。分析前将每份样品在13000 rpm 下离心10 min. 针对安捷伦 ICP-MS 集成进样系统 (ISIS) 的氢化物发生附件可用于砷等气态氢化物形成元素的高灵敏度分析。图1显示了本研究中所用的 HG-ICP-MS配置。通过 ASX-500 自动进样器进样,并通过 ISIS蠕动泵(PP1)将样品运输至氢化物发生器。样品在混合线圈中与 HCI (5M)、NaBH4 (2%(w/v)) 和消泡剂B乳浊液混合后进入气液分离器。随后含有无机砷(以挥发性氢化物形式存在)的气态样品随 ICP-MS尾吹气路控制的氩气流被输送至 ICP-MS 雾化室。Rh 内标 (IS) 通过常规气动雾化器引入 ICP-MS雾化室,创造出湿润的等离子体条件。方法开发的详细信息请参见之前的文献。最佳运行条件如表1所示。 图1.本研究中所用 HG-ICP-MS配置示意图 表1.氢化物发生法的运行参数 参数 值 样品流速(mL/min) 0.5 HCI流速(mL/min) 2.5 NaBH, 流速 (mL/min) 0.5 反应线圈体积(mL) 0.23 HG 氩气流速 (L/min) 0.3 内标雾化的氩气流速(L/min) 0.85-0.95 在酸性条件下利用 NaBH4 进行处理后,无机砷可有效转为成挥发性胂(AsH3),而有机结合的砷化合物未被转化,或仅形成了挥发性较弱的胂类化合物,如沸点为35℃的二甲胂(CH3)2AsH。加入高浓度盐酸可进一步减少挥发性较弱的胂类化合物的产生,而无机砷几乎全部转化为胂,从而无需使用色谱技术进行形态分离即可对无机砷进行单独测定。 仪器一ICP-MS 将 HG 与 Agilent 8800 串联四极杆 ICP-MS (ICP-MS/MS) 串联以实现砷的检测。由于 ICP-MS/MS有助于对潜在干扰物进行监测与控制,因此与传统四极杆 ICP-QMS 相比更适用于初始方法开发。由于通过 HG的胂选择性形成过程中必不可少的高浓度 HCI 增加了氯形成的4Ar35cl对砷(m/z75)造成干扰的机会,因此这一点非常重要。 使用 ICP-MS/MS测定砷的首选方法是利用质量转换方法,在该方法中 As*与反应池气体氧气 (02)发生反应转化成了 AsO*, 然后作为 m/z 91 的 As 子离子得到测定。 ICP-MS/MS 能够在 MS/MS 模式下运行,在该模式中两个四极杆均作为单位质量过滤器运行。如果将Q1设置为 m/z 75,则仅有砷和原位质量干扰引入反应池,因此目标子离子75As10*m/z 91 的潜在干扰可被排除。而在初始研究中充,氧气反应模式(其中以 m/z 91 AsO* 的形式对砷进行间接测定)和无气体模式(其中以m/z75对砷进行直接测定))下获得的 HG结果之间并不存在差异,表明尽管使用高浓度HCI也不存在显著的氯化物干扰。因此可在 Agilent 7900 ICP-MS等四极杆 ICP-MS 仪器中采用相同的氢化物发生法对砷进行测定。 为将 HG-ICP-MS/MS 结果与成熟 HPLC-ICP-MS 方法所得的结果进行比较,我们将 Agilent 1100 HPLC 连接至 ICP-MS/MS.实验中采用 Hamilton PRP X-100 阴离子交换柱(10 pm, 4.6×250 mm), 流动相为20 mM 碳酸铵 (pH8.5),流速为1 mL/min。 表2.ICP-MS/MS运行条件 总砷含量测定ICP-MS/MS HG-ICP- MS/MS HPLC-ICP-MS/MS 参数 值 RF功率(W) 1550 载气流速(L/min) 1.19 0.93 1.13 尾吹气流速(L/min)* 0.3 雾化室温度(C) 2 采样深度(mm) 8 提取透镜1(V) -4 0.5 0 提取透镜2(V) -185 -170 -200 四极杆模式 单四极杆 MS/MS 反应池气体模式与流速(%) 无气体 0 (30) *用作氢化物发生法中的吹扫气 结果与讨论 质量控制 如表 3a所示, ICP-MS/MS 测定出的 NIST 1568a 和 IMEP-107 中的总砷浓度与各自标准值和分析能力测试值均呈现出良好的一致性。使用 HG-ICP-MS/MS 测得的 NIST 1568a 和IMEP-107 中的无机砷形态分析结果与使用 HPLC-ICP-MS/MS测定的结果和报告值保持高度一致(表3b)。 表 3a. ICP-MS/MS 测得的 NIST 1568a 和 IMEP-107 中的总砷浓度 总砷 ICP-MS/MS(pg/kg) 标准值(pg/kg) NIST 1568a 295±6,(n=3) 290±30 IMEP-107 173±1,(n=3) *172±18 *分析能力测试 表 3b.使用 HG-ICP-MS/MS 和 HPLC-ICP-MS/MS 测得的无机砷结果 无机砷 HG-ICP-MS/MS(pg/kg) HPLC-ICP-MS/MS (pg/kg) 报告值 (pg/kg) NIST1568a 94±8(n=3) 105±4(n=3) 94±12 IMEP-107 100+11(n=15) 110±12(n=15) 107±148 两种QC物质均获得了良好的色谱柱回收率,其中 NIST 1568a为101%±4%(n=3), IMEP-107 为 98%±9%(n=12)。对 IMEP-107 随每批样品共同进行了分析,通过这些多次测量结果对“日内”RSD和“日间”RSD 进行了计算。HG 和 HPLC 的日内RSD 平均值为3%,所有测定日中的所有重复测定均值 RSD 为 11%。结果显示两种方法的重现性和重复性相似。分析每批样品时均对空白样品进行了分析。 HG-ICP-MS/MS 和 HPLC-ICP-MS/MS结果比较 多种大米中的总砷提取效率普遍较高,平均值为91%±10%,范围为 73%-111%。对于最大浓度而言,接受研究的所有样品中无机砷含量均低于150ug/kg, 因此均未超过现行中国最大浓度和FAO/WHO 联合食品法典委员会的无机砷建议最大浓度规定。所有样品的HPLC 色谱柱回收率均可实现定量分析(94%±10%)。 表4a和4b中汇总了无机砷、DMA 和总砷的测定值。 HG-ICP-MS和 HPLC-ICP-MS 测得的无机砷结果显示出了良好的一致性。大米中存在的主要砷形态为无机砷和 DMA, MMA 仅存在痕量水平。在使用 HCI(5M) 和NaBHa 选择性生成胂的方法中,AsHs几乎是所形成的唯一产物,而仅有少量 DMA 产生约2%-4%的二甲胂贡献。砷暴露环境中生长大米的分析结果同样确定了这一点(表4b)。尽管样品含有高浓度 DMA, 但 HG-ICP-MS 测得的无机砷与 HPLC-ICP-MS 测得的结果仍具有良好一致性。MMA 可通过该方法形成甲基胂,转化率约为40%;但由于大米中通常不含MMA 或仅含痕量 MMA, 因此应不会对无机砷的定量分析造成影响。 表 4a. HG-ICP-MS/MS 和 HPLC-ICP-MS/MS 测得的31种大米产品中无机砷的形态分析结果。表中还给出了 DMA 和 MMA 的结果以及 ICP-MS/MS 测得的总砷浓度。结果均以数值+SD 表示,形态分析结果中n=3,总砷测定中n=2或3 大米产品 HG iAs HPLC iAs HPLC DMA HPLC MMA* 总砷 (pg/kg) (pg/kg) (pg/kg) (pg/kg) (pg/kg) Arborio Risotto米 113±13 120±18 63±7
确定




















































还剩98页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《酱油中Zn 元素检测方案(等离子体质谱)》,该方案主要用于酱油中营养成分检测,参考标准--,《酱油中Zn 元素检测方案(等离子体质谱)》用到的仪器有
该厂商其他方案
更多








