本应用简报介绍了一种定量测定芝麻酱中26 种真菌毒素的方法,该方法基于Liu 等人发表的论文。首先使用实验室开发的改良QuEChERS 方案对样品进行萃取和净化,然后用Agilent 1290 Infinity 液相色谱系统串联Agilent 6460 三重四极杆质谱仪对所得的溶液进行分离和检测。本文开发的方法经过基质匹配外标校准,具有非常出色的线性动态范围,相关系数达到0.995 或更高。利用该方法检测了26 种真菌毒素,其定量限(LOQ) 几乎均低于当前中国、欧盟及其他监管机构规定的相应最大残留水平(MRL)。加标实验表明,大多数回收率都在60% - 120% 的范围内,各种分析物的RSD 均低于15%。本研究开发的方法具有极高的灵敏度、选择性和准确度,并且具有较高的通量,适用于对实际样品中的真菌毒素进行目标物筛查。
方案详情

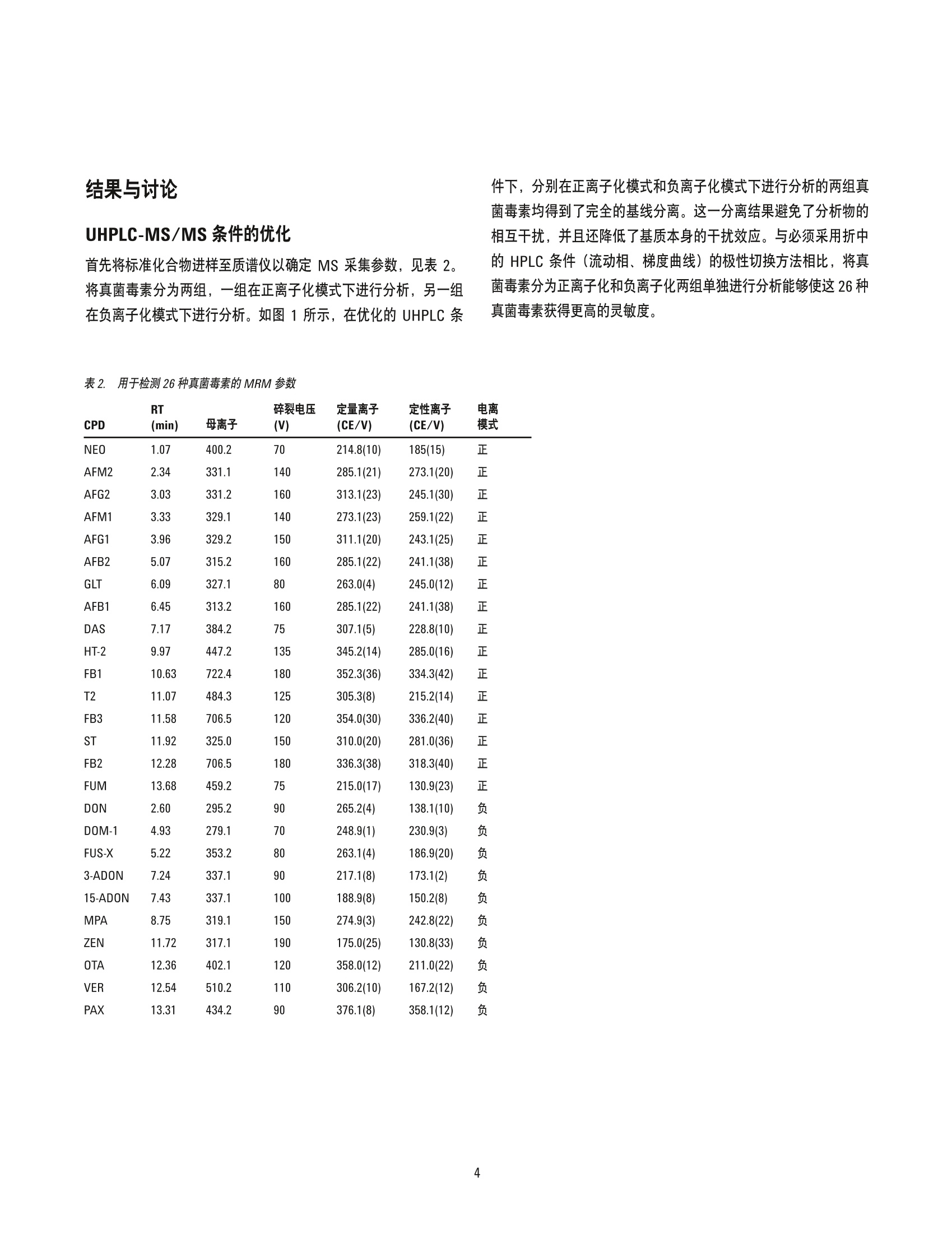
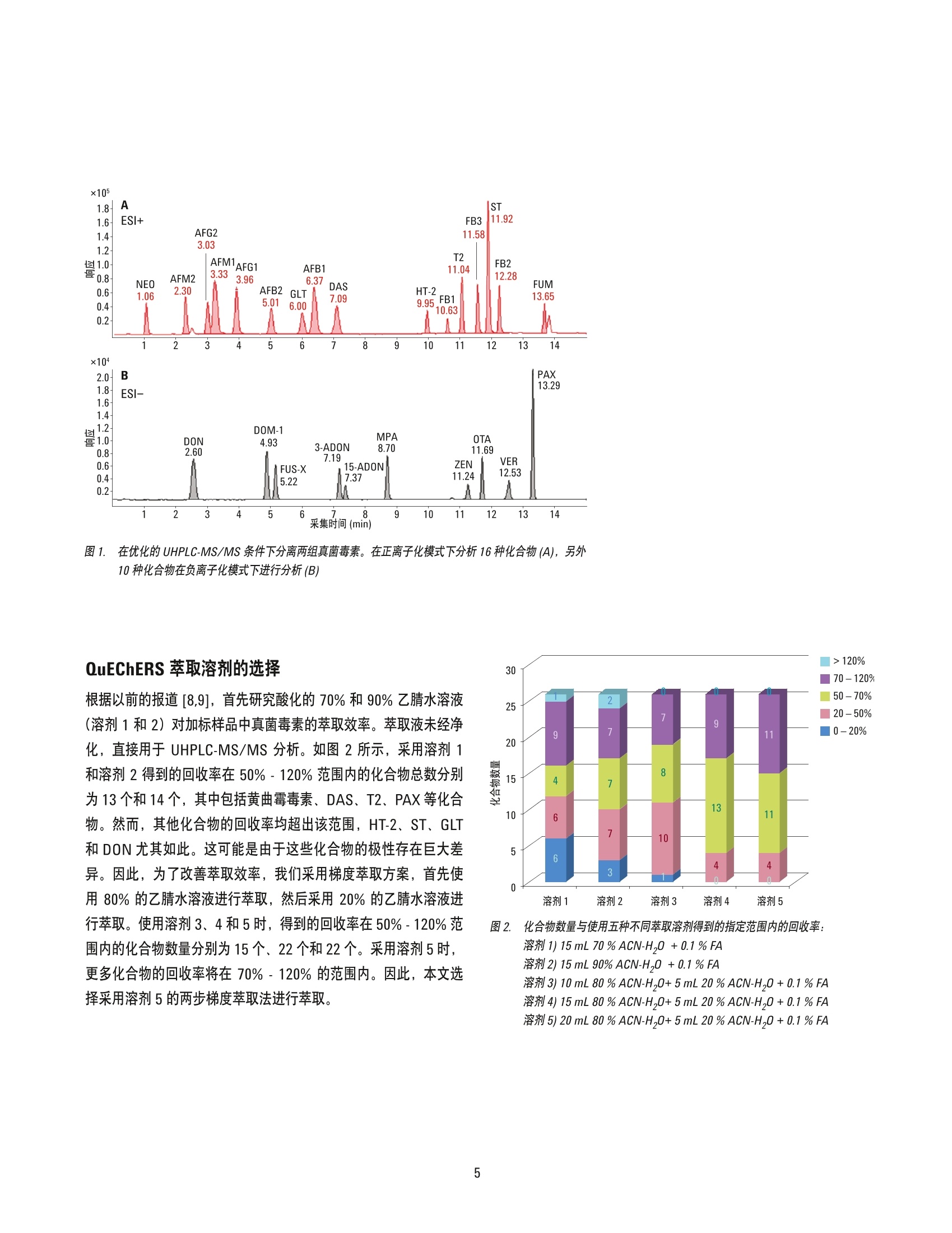
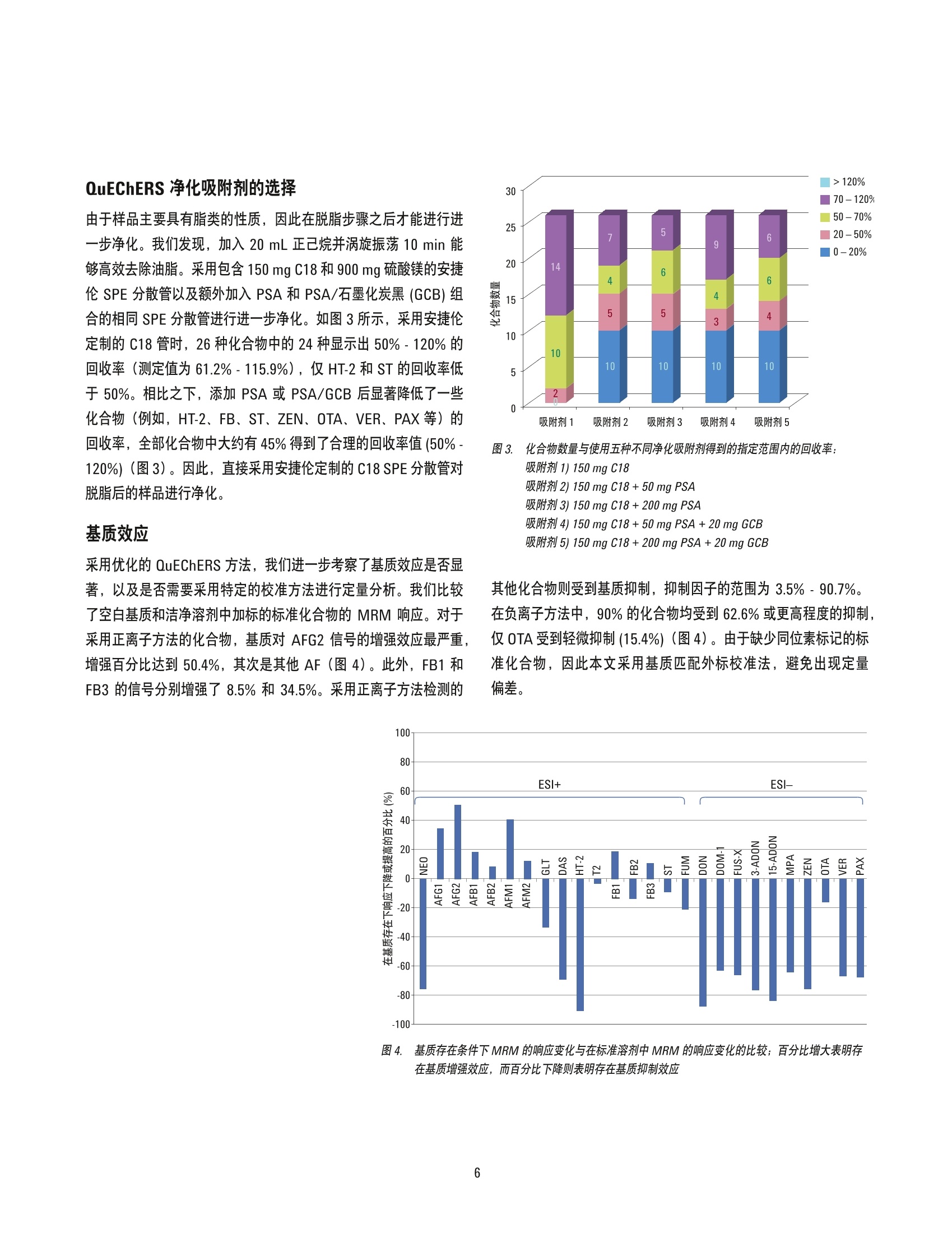
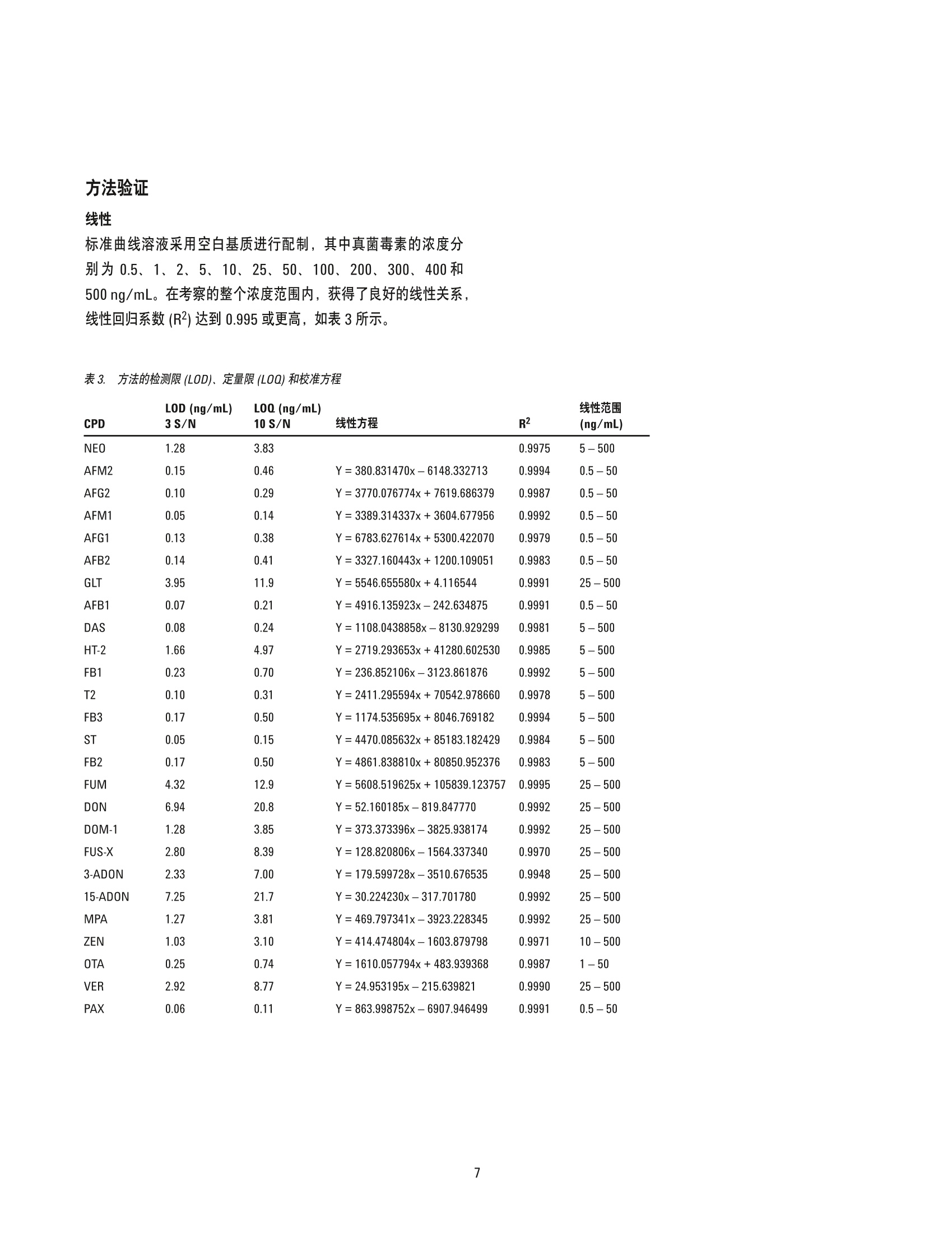
作者 Ying Liu、Shen Han、 Pei-Yue Wang、 Jing Han 和 Jin-Hua Wang 北京出入境检验检疫局检验检疫技术中心 中国北京 Meiling Lu、 Shan Zhou 安捷伦科技(中国)有限公司 中国北京 改良的 QuEChERS 与 UHPLC-ESI/三重四极杆质谱联用同时测定芝麻酱中的26种真菌毒素 应用简报食品 摘要 本应用简报介绍了一种定量测定芝麻酱中26种真菌毒素的方法,该方法基于 Liu 等人发表的论文[1]。首先使用实验室开发的改良 QuEChERS 方案对样品进行萃取和净化,然后用 Agilent 1290 Infinity 液相色谱系统串联 Agilent 6460 三重四极杆质谱仪对所得的溶液进行分离和检测。本文开发的方法经过基质匹配外标校准,具有非常出色的线性动态范围,相关系数达到0.995或更高。利用该方法检测了26种真菌毒素,其定量限(LOQ)几乎均低于当前中国、欧盟及其他监管机构规定的相应最大残留水平(MRL)。加标实验表明,大多数回收率都在60%-120%的范围内,各种分析物的 RSD 均低于 15%。本研究开发的方法具有极高的灵敏度、选择性和准确度,并且具有较高的通量,适用于对实际样品中的真菌毒素进行目标物筛查。 各种农产品(包括原材料和加工后的食品)容易受到真菌毒素的污染,在适宜的气候条件下,真菌毒素主要由曲霉属、青霉属、镰刀菌属以及许多其他真菌物种分泌产生。这些真菌毒素多数都含有剧毒,甚至具有致癌性[2,3]。目前,真菌毒素已受到许多机构的监管,尤其是在主要农产品(例如,谷物、玉米、牛奶和食用油)中[4]。食品中真菌毒素的常规监测需要采用极其灵敏且可靠的方法。 过去十年间,高效液相色谱与质谱尤其是串联质谱的联用系统(HPLC-MS/MS) 通过与免疫亲和净化(IAC) 或固相萃取(SPE)相结合,已被应用于真菌毒素的检测中。QuEChERS 是一种更通用的萃取和净化方法,该方法已被扩展至分析一些常见食品基质(例如,小麦、面粉、谷物、葡萄酒等)中的真菌毒素[5-7]。然而,芝麻酱作为另一种更加复杂的食品基质,尚未得到深入分析。芝麻酱主要由芝麻和花生制成,容易受到多类真菌毒素的污染,从而可能导致人类健康风险的增加。这种酱富含脂肪、碳水化合物、蛋白质和天然色素,因此很难净化。本研究的目的是通过结合通用的 QuEChERS 方法与超高效液相色谱/质谱串联系统(UHPLC-MS/MS), 开发出一种可靠的方法,对芝麻酱中的26种常见真菌毒素进行高通量测定。 材料和试剂 真菌毒素标准化合物:新茄病镰刀菌烯醇(NEO)、呕吐毒素(DON)、3-乙酰基-脱氧雪腐镰刀菌烯醇 (3-ADON)、15-乙酰基-脱氧雪腐镰刀菌烯醇(15-ADON)、黄曲霉毒素 B1 (AFB1)、黄曲霉毒素 B2 (AFB2)、黄曲霉毒素 G1 (AFG1)、黄曲霉毒素 G2 (AFG2)、黄曲霉毒素 M1 (AFM1)、黄曲霉毒素 M2 (AFM2)、T2 毒素、HT-2毒素、伏马菌素B1 (FB1)、杂色曲霉素 (ST)、疣孢青霉原 (VER)、赭曲霉毒素 A (0TA) 和玉米烯酮 (ZEN)购自 Alexis Corporation;4,5-二乙酰氧基镰草镰刀菌醇(DAS)、镰刀菌烯酮-X(FUS-X)、脱环氧-呕吐毒素(DOM-1)、胶霉毒素 (GLT)、烟曲霉素 (FUM)、伏马菌素 B2(FB2)、伏马菌素 B3 (FB3)、霉酚酸 (MPA) 和蕈青霉素(PAX)购自 Romer Lab。一些试剂(例如甲醇、乙腈、甲酸、乙酸铵和水)为 HPLC级。其他试剂均为分析纯级并购自本地供应商。定制的 QuEChERS 萃取 (EN15662方法)试剂盒和分散净化管均购自安捷伦科技公司。 样品萃取和净化 称取样品(2.5g)加入50mL离心管中,并采用两种不同的溶液依次对样品萃取30分分: 20mL含0.1%甲酸的80%乙腈水溶液和5mL含0.1%甲酸的20%乙腈水溶液。在每次萃取后,均对样品瓶进行离心,并收集上清液。然后将两次收集的上清液混合在一起,并使用安捷伦 QuEChERS 萃取取剂盒(部件号5982-5650CH)通过立即涡旋振荡1分钟后在 8000 rpm 下离心 5 min 以进行盐析。然后将上清液转移至洁净的样品瓶中,并使用20 mL 正己烷进行萃取,除去脂质。将保留在下层的分析物转移至包含150 mg C18和900mg硫酸镁的安捷伦 dSPE 净化管(部件号5982-4956CH)中。涡旋振荡浑浊溶液 1 min, 然后进行离心。将所得上清液倒入洁净的分散管中,该分散管依次用5 mL乙腈清洗两次。然后将流过的溶液与清洗溶液混合,并使用旋转蒸发器在40℃下将其蒸干。最后,将残渣依次溶解于 1.5 mL甲醇和 1.0mL水中。将所得到的溶液通过 0.22 pm滤膜,以便采用 UHPLC-MS/MS 进一步分析。 LC/MS条件 表1. 仪器条件 仪器 内置脱气机的 Agilent 1290 Infinity 液相色谱系统 自动进样器 Agilent 1290 Infinity 自动进样器,带温控功能 柱温 Agilent 1290 Infinity 柱温箱 色谱柱 Agilent ZORBAX Eclipse Plus C18, 2.1×50 mm, 1.8 pm 柱温 40°C 流动相 A) 0.1%甲酸(正)和纯水(负) B)0.1%甲酸的乙醇溶液(正)和纯甲醇(负) 流速 0.4 mL/min 进样量 3pL 后运行时间 2 min 梯度洗脱曲线 0-8 min, %B 由 30%增加至 35%; 8-8.5 min, %B 由35%增加值50%; 8.5-15 min, %B由50%增加至80%(正); 0-3min,%B 保持在 10%; 3-3.1 min, %B 由10%增加至15%; 3.1-4.5 min, %B 由15%增加至20%; 4.5-8.0 min, %B 由 20%增加至30%; 8.0-8.5 min, %B由30%增加至 45%; 8.5-14.0 min, %B 由45%增加至90%(负) ESI-MS/MS条件 仪器 配备安捷伦喷射流电喷雾离子源的 Agilent 6460 三重四极杆液质联用系统 干燥气温度 300°℃(+)/350°C (-) 干燥气流速 6L/min(+)/10 L/min (-) 雾化气压力 45 psi (±) 鞘气温度 350℃(±) 鞘气流速 12 L/min(+)/7 L/min (-) 毛细管电压 3500V(±) 喷嘴电压 0(+)/2000V(-) 结果与讨论 UHPLC-MS/MS条件的优化 首先将标准化合物进样至质谱仪以确定 MS 采集参数, 见表2。将真菌毒素分为两组,一组在正离子化模式下进行分析,另一组在负离子化模式下进行分析。如图1所示, 在优化的 UHPLC 条 件下,分别在正离子化模式和负离子化模式下进行分析的两组真菌毒素均得到了完全的基线分离。这一分离结果避免了分析物的相互干扰,并且还降低了基质本身的干扰效应。与必须采用折中的 HPLC 条件(流动相、梯度曲线)的极性切换方法相比,将真菌毒素分为正离子化和负离子化两组单独进行分析能够使这26种真菌毒素获得更高的灵敏度。 表2.用于检测26种真菌毒素的 MRM 参数 RT 碎裂电压 定量离子 定性离子 电离 CPD (min) 母离子 (V) (CE/V) (CE/V) 模式 NEO 1.07 400.2 70 214.8(10) 185(15) 正 AFM2 2.34 331.1 285.1(21) 273.1(20) 正 AFG2 3.03 331.2 313.1(23) 245.1(30) 正 AFM1 3.33 329.1 273.1(23) 259.1(22) 正 AFG1 3.96 329.2 311.1(20) 243.1(25) 正 AFB2 5.07 315.2 285.1(22) 241.1(38) 正 GLT 6.09 327.1 80 263.0(4) 245.0(12) 正 AFB1 6.45 313.2 160 285.1(22) 241.1(38) 正 DAS 7.17 384.2 75 307.1(5) 228.8(10) 正 HT-2 9.97 447.2 345.2(14) 285.0(16) 正 FB1 10.63 722.4 352.3(36) 334.3(42) 正 T2 11.07 484.3 305.3(8) 215.2(14) 正 FB3 11.58 706.5 354.0(30) 336.2(40) 正 ST 11.92 325.0 310.0(20) 281.0(36) 正 FB2 12.28 706.5 336.3(38) 318.3(40) 正 FUM 13.68 459.2 75 215.0(17) 130.9(23) 正 DON 2.60 295.2 90 265.2(4) 138.1(10) 负 DOM-1 4.93 279.1 70 248.9(1) 230.9(3) 负 FUS-X 5.22 353.2 80 263.1(4) 186.9(20) 负 3-ADON 7.24 337.1 90 217.1(8) 173.1(2) 负 15-ADON 7.43 337.1 100 188.9(8) 150.2(8) 负 MPA 8.75 319.1 274.9(3) 242.8(22) 负 ZEN 11.72 317.1 175.0(25) 130.8(33) 负 OTA 12.36 402.1 120 358.0(12) 211.0(22) 负 VER 12.54 510.2 110 306.2(10) 167.2(12) 负 PAX 13.31 434.2 90 376.1(8) 358.1(12) 负 图1. 在优化的 UHPLC-MS/MS 条件下分离两组真菌毒素。在正离子化模式下分析16种化合物(A),另外10种化合物在负离子化模式下进行分析(B) QuEChERS 萃取溶剂的选择 根据以前的报道[8,9],首先研究酸化的70%和90%乙腈水溶液(溶剂1和2)对加标样品中真菌毒素的萃取效率。萃取液未经净化,直接用于 UHPLC-MS/MS分析。如图2所示,采用溶剂1和溶剂2得到的回收率在50%-120%范围内的化合物总数分别为13个和14个,其中包括黄曲霉毒素、DAS、T2、PAX等化合物。然而,其他化合物的回收率均超出该范围, HT-2、ST、GLT和 DON 尤其如此。这可能是由于这些化合物的极性存在巨大差异。因此,为了改善萃取效率,我们采用梯度萃取方案,首先使用80%的乙腈水溶液进行萃取,然后采用20%的乙腈水溶液进行萃取。使用溶剂3、4和5时,得到的回收率在50%-120%范围内的化合物数量分别为15个、22个和22个。采用溶剂5时,更多化合物的回收率将在70%-120%的范围内。因此,本文选择采用溶剂5的两步梯度萃取法进行萃取。 图2. 化合物数量与使用五种不同萃取溶溶得到的指定范围内的回收率: 溶剂 1) 15mL 70 % ACN-H,0 +0.1% FA溶剂2) 15 mL 90% ACN-H,0 +0.1% FA溶剂 3) 10 mL 80%ACN-H,0+5mL 20% ACN-H,0+0.1% FA溶剂4) 15 mL 80%ACN-H,0+5 mL 20 % ACN-H,0 + 0.1% FA溶剂5)20 mL 80%ACN-H,0+5 mL 20%ACN-H,0 +0.1 % FA QuEChERS 净化吸附剂的选择 由于样品主要具有脂类的性质,因此在脱脂步骤之后才能进行进一步净化。我们发现,加入 20 mL正己烷并涡旋振荡 10 min 能够高效去除油脂。采用包含150mg C18和900mg硫酸镁的安捷伦SPE 分散管以及额外加入 PSA 和 PSA/石墨化炭黑 (GCB)组合的相同 SPE 分散管进行进一步净化。如图3所示,采用安捷伦定制的 C18管时,26种化合物中的24种显示出50%-120%的回收率(测定值为61.2%-115.9%),仅 HT-2和 ST 的回收率低于50%。相比之下,添加 PSA 或 PSA/GCB 后显著降低了一些化合物(例如, HT-2、FB、ST、ZEN、OTA、VER、PAX 等) 的回收率,全部化合物中大约有45%得到了合理的回收率值(50%-120%)(图3)。因此,直接采用安捷伦定制的 C18 SPE 分散管对脱脂后的样品进行净化。 基质效应 采用优化的 QuEChERS 方法, 我们进一步考察了基质效应是否显著,以及是否需要采用特定的校准方法进行定量分析。我们比较了空白基质和洁净溶剂中加标的标准化合物的 MRM 响应。对于采用正离子方法的化合物,基质对 AFG2 信号的增强效应最严重,增强百分比达到50.4%,其次是其他 AF (图4)。此外, FB1 和FB3 的信号分别增强了8.5%和34.5%。采用正离子方法检测的 图3. 化合物数量与使用五种不同净化吸附剂得到的指定范围内的回收率: 吸附剂1)150 mg C18 吸附剂 2) 150 mg C18+50 mg PSA吸附剂 3) 150 mg C18+200 mg PSA吸附剂 4) 150mg C18+50 mg PSA+20 mg GCB吸附剂5)150mg C18 + 200 mg PSA + 20 mg GCB 其他化合物则受到基质抑制,抑制因子的范围为3.5%-90.7%。在负离子方法中,90%的化合物均受到62.6%或更高程度的抑制,仅 OTA受到轻微抑制(15.4%)(图4)。由于缺少同位素示记的标准化合物,因此本文采用基质匹配外标校准法,避免出现定量偏差。 图4 基质存在条件下 MRM 的响应变化与在标准溶剂中 MRM 的响应变化的比较;百分比增大表明存在基质增强效应,而百分比下降则表明存在基质抑制效应 方法验证 线性 标准曲线溶液采用空白基质进行配制,其中真菌毒素的浓度分别为0.5、1、2、5、10、25、50、100、200、300、400和500 ng/mL。 在考察的整个浓度范围内,获得了良好的线性关系,线性回归系数(R2)达到 0.995或更高,如表3所示。 表 3. 方法的检测限(LOD)、定量限(LOQ)和校准方程 CPD 3 S/N 10 S/N 线性方程 R2 (ng/mL) NEO 1.28 3.83 0.9975 5-500 AFM2 0.15 0.46 Y=380.831470x-6148.332713 0.9994 0.5-50 AFG2 0.10 0.29 Y=3770.076774x+7619.686379 0.9987 0.5-50 AFM1 0.05 0.14 Y=3389.314337x+3604.677956 0.9992 0.5-50 AFG1 0.13 0.38 Y=6783.627614x+5300.422070 0.9979 0.5-50 AFB2 0.14 0.41 Y=3327.160443x+1200.109051 0.9983 0.5-50 GLT 3.95 11.9 Y=5546.655580x+4.116544 0.9991 25-500 AFB1 0.07 0.21 Y=4916.135923x-242.634875 0.9991 0.5-50 DAS 0.08 0.24 Y=1108.0438858x-8130.929299 0.9981 5-500 HT-2 1.66 4.97 Y=2719.293653x+41280.602530 0.9985 5-500 FB1 0.23 0.70 Y=236.852106x-3123.861876 0.9992 5-500 T2 0.10 0.31 Y=2411.295594x+70542.978660 0.9978 5-500 FB3 0.17 0.50 Y=1174.535695x+8046.769182 0.9994 5-500 ST 0.05 0.15 Y=4470.085632x+85183.182429 0.9984 5-500 FB2 0.17 0.50 Y=4861.838810x+80850.952376 0.9983 5-500 FUM 4.32 12.9 Y=5608.519625x+105839.123757 0.9995 25-500 DON 6.94 20.8 Y=52.160185x-819.847770 0.9992 25-500 DOM-1 1.28 3.85 Y=373.373396x-3825.938174 0.9992 25-500 FUS-X 2.80 8.39 Y=128.820806x-1564.337340 0.9970 25-500 3-ADON 2.33 7.00 Y=179.599728x-3510.676535 0.9948 25-500 15-ADON 7.25 21.7 Y=30.224230x-317.701780 0.9992 25-500 MPA 1.27 3.81 Y=469.797341x-3923.228345 0.9992 25-500 ZEN 1.03 3.10 Y=414.474804x-1603.879798 0.9971 10-500 OTA 0.25 0.74 Y=1610.057794x+483.939368 0.9987 1-50 VER 2.92 8.77 Y=24.953195x-215.639821 0.9990 25-500 PAX 0.06 0.11 Y=863.998752x-6907.946499 0.9991 0.5-50 LOD 和 L0Q LOD 基于最低校准浓度下采集的 MRM色谱图以3倍信噪比进行计算, 而 LOQ则采用相同的色谱图以10倍或更高信噪比来计算。如表3所示,样品的 LOQ范围为 0.11ng/mL (PAX)至21.7 ng/mL(15-ADON), 其相当于样品中的浓度分别为 0.11 ng/g和21.7 ng/g。该方法具有极高的灵敏度,能够测量芝麻酱这类复杂食品基质中的痕量真菌毒素。 回收率和精密度 整个研究过程中均采用基质匹配外标校准方法。为验证其性能,将三种浓度的真菌毒素加标至空白基质中,并对每种浓度的样品重复进样三次。黄曲霉毒素的浓度分别设置为2.0、4.0和8.0ng/g;所有其他类别真菌毒素的加标浓度范围为100至400ng/g。对加标样品进行萃取、脱脂和净化,然后采用 UHPLC-MS/MS 方法进行分析。如图5所示,除了两个较高浓度下的 FB2和PAX以及最低浓度下的 ST 之外,95%样品的回收率值均在60%-120%的范围内。所有 RSD 均低于15%,大多数 RSD 值(总数中的96%)低于10%。这表明该方法高度可靠。 图5. 使用基质匹配外标校准法进行定量分析,在三种不同浓度下加标至空白基质中的真菌毒素的回收率 使用所开发的方法对30个样品进行筛查,这30个样品包括从本地杂货店随机购买的20种芝麻酱和10种花生酱。总共检出了十种真菌毒素,其中包括 AFB1、AFB2、AFG1、AFG2、FB1、FB2、FB3、ST、DON 和 OTA。各种检出的真菌毒素的测定范围如图6所示。图6中还标记了中等浓度和阳性样品的数量。在20种芝麻酱中,我们发现所有样品均含有 FB (FB1、FB2和FB3),其浓度范围为6.8至29.3 ng/g;三个样品被 ST 污染,ST的其浓度范围为1.5至5.1ng/g; 还发现两个样品中含有浓度分别为 253.7 ng/g 和3.2 ng/g的 DON 和OTA; 四个样品被 AF(AFB1、AFB2、AFG1和AFG2)污染, AF的浓度范围为0.8至12.3 ng/g。在检出的 AF 中, AFB1的浓度明显高于其他化合物(6.6 ng/g), 并且在被黄曲霉毒素污染的样品中,其中25%所含的黄曲霉毒素浓度高于欧盟法规规定的 MRL [7] (B1小于2.0ng/g,AF 之和小于4.0 ng/g)。 图6. 在30个实际样品中检出的真菌毒素的浓度分布;每个柱状图上的数字表示浓度中值以及在所有30个样品中阳性样品的数量;注:计算中不包括低于 LOD 的样品 该方法还被扩展用于分析花生酱。结果发现,10个花生酱样品全部被 AF和FB 污染, AF和FB的浓度范围分别为2.4至4.6 ng/g和6.9至20.1ng/g。花生酱中的其他真菌毒素均低于本方法的LOD。 上述筛查结果证明, AF 和 FB 是芝麻酱和花生酱中最常见的污染物。然而,这些真菌毒素无法通过 SPE 或 IAC 前处理进行同时分析,因为它们的化学结构和极性存在显著差异。本方法提供了一种采用 QuEChERS 的通用萃取和纯化方法,从而简化了多种真菌毒素的分析过程。 结论 本文开发了一种通用的 QuEChERS 方法, 采用该方法与经过优化的UHPLC-MS/MS 方法相结合对芝麻酱中26种常见的真菌毒素进行了定量分析。本研究开发的方法表明,通常情况下 LOQ均低于当前大多数食品基基中适用的最低 MRL。该方法具有高灵敏度、高选择性、高准确度和高通量的优势,已经成功应用于芝麻酱的真菌毒素筛查中,并且还被扩展用于如花生酱等类似的食品基质。 ( 参考文献 ) ( 1. Y. Liu,et al. J. Chromatogr. B, 970 68-76(2014) ) ( 2. E uropean Food Safety Authority (EFSA) Panel on Contaminants in t he FoodChain, EFSA J . 8 1626(2010) ) 3.DD.L. Sudakin. Toxicol. Lett. 143 97 (2003) 4.区欧盟委员会法规 (EC) No. 1881/2006 5. I. Sospedra, et al. J.Chromatogr. A 1217 1437 (2010) 6. M. Zachariasovaa, et al. Anal. Chim. Acta 662 51 (2010) 7. R. R. Rasmussen,et al.Anal. Bioanal. Chem.397 765(2010) 8. M. C. Spanjer,P. M. Rensen, J. M. Scholten.Food Addit.Contam.25 472 (2008) 9. E. Varga,et al. Anal.Bioanal. Chem.405 5087 (2013) 更多信息 查找当地的安捷伦客户中心: 这些数据仅代表典型的结果。有关我们的产品与服务的详细信息,请访问我们的网站 www.agilent.com。 www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 本文中的信息、说明和技术指标如有变更,恕不另行通知。 c 安捷伦科技(中国)有限公司,2015 2015年1月5日,中国出版 5991-5347CHCN Agilent Technologies 摘要本应用简报介绍了一种定量测定芝麻酱中26 种真菌毒素的方法,该方法基于Liu 等人发表的论文。首先使用实验室开发的改良QuEChERS 方案对样品进行萃取和净化,然后用Agilent 1290 Infinity 液相色谱系统串联Agilent 6460 三重四极杆质谱仪对所得的溶液进行分离和检测。本文开发的方法经过基质匹配外标校准,具有非常出色的线性动态范围,相关系数达到0.995 或更高。利用该方法检测了26 种真菌毒素,其定量限(LOQ) 几乎均低于当前中国、欧盟及其他监管机构规定的相应最大残留水平(MRL)。加标实验表明,大多数回收率都在60% - 120% 的范围内,各种分析物的RSD 均低于15%。本研究开发的方法具有极高的灵敏度、选择性和准确度,并且具有较高的通量,适用于对实际样品中的真菌毒素进行目标物筛查。前言各种农产品(包括原材料和加工后的食品)容易受到真菌毒素的污染,在适宜的气候条件下,真菌毒素主要由曲霉属、青霉属、镰刀菌属以及许多其他真菌物种分泌产生。这些真菌毒素多数都含有剧毒,甚至具有致癌性。目前,真菌毒素已受到许多机构的监管,尤其是在主要农产品(例如,谷物、玉米、牛奶和食用油)中。食品中真菌毒素的常规监测需要采用极其灵敏且可靠的方法。过去十年间,高效液相色谱与质谱尤其是串联质谱的联用系统(HPLC-MS/MS) 通过与免疫亲和净化(IAC) 或固相萃取(SPE) 相结合,已被应用于真菌毒素的检测中。QuEChERS 是一种更通用的萃取和净化方法,该方法已被扩展至分析一些常见食品基质(例如,小麦、面粉、谷物、葡萄酒等)中的真菌毒素。然而,芝麻酱作为另一种更加复杂的食品基质,尚未得到深入分析。芝麻酱主要由芝麻和花生制成,容易受到多类真菌毒素的污染,从而可能导致人类健康风险的增加。这种酱富含脂肪、碳水化合物、蛋白质和天然色素,因此很难净化。本研究的目的是通过结合通用的QuEChERS 方法与超高效液相色谱/质谱串联系统(UHPLC-MS/MS),开发出一种可靠的方法,对芝麻酱中的26 种常见真菌毒素进行高通量测定。结论本文开发了一种通用的QuEChERS 方法,采用该方法与经过优化的UHPLC-MS/MS 方法相结合对芝麻酱中26 种常见的真菌毒素进行了定量分析。本研究开发的方法表明,通常情况下LOQ 均低于当前大多数食品基质中适用的最低MRL。该方法具有高灵敏度、高选择性、高准确度和高通量的优势,已经成功应用于芝麻酱的真菌毒素筛查中,并且还被扩展用于如花生酱等类似的食品基质。
确定






还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《芝麻酱中真菌毒素检测方案(液相色谱仪)》,该方案主要用于半固态复合调味料中真菌毒素检测,参考标准--,《芝麻酱中真菌毒素检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent 1290 Infinity II Multisampler
推荐专场
该厂商其他方案
更多


















