方案详情
文
本指南表明,iCAP RQ ICP-MS 是测定药物产品中
杂质元素的理想解决方案。对于三种样品药物,方法检
出限比限值小五十倍,这表明 iCAP RQ ICP-MS 能轻而
易举地准确且精确测定 USP<232> 中规定的限值下所有
十四种元素。据此,考虑到 USP 及其它国家级和国际级
机构制定的规程持续变更,代表ICP-MS在微量元素杂质
分析的药物实验室永不过时。
最后,先进灵活的ISDS 软件中包含的安全特性范
围、数据管理以及追踪审计功能为“在受高度管制的制
药业环境下满足《美国联邦法规》21 CFR part 11 的要
求”提供必要支持。
方案详情

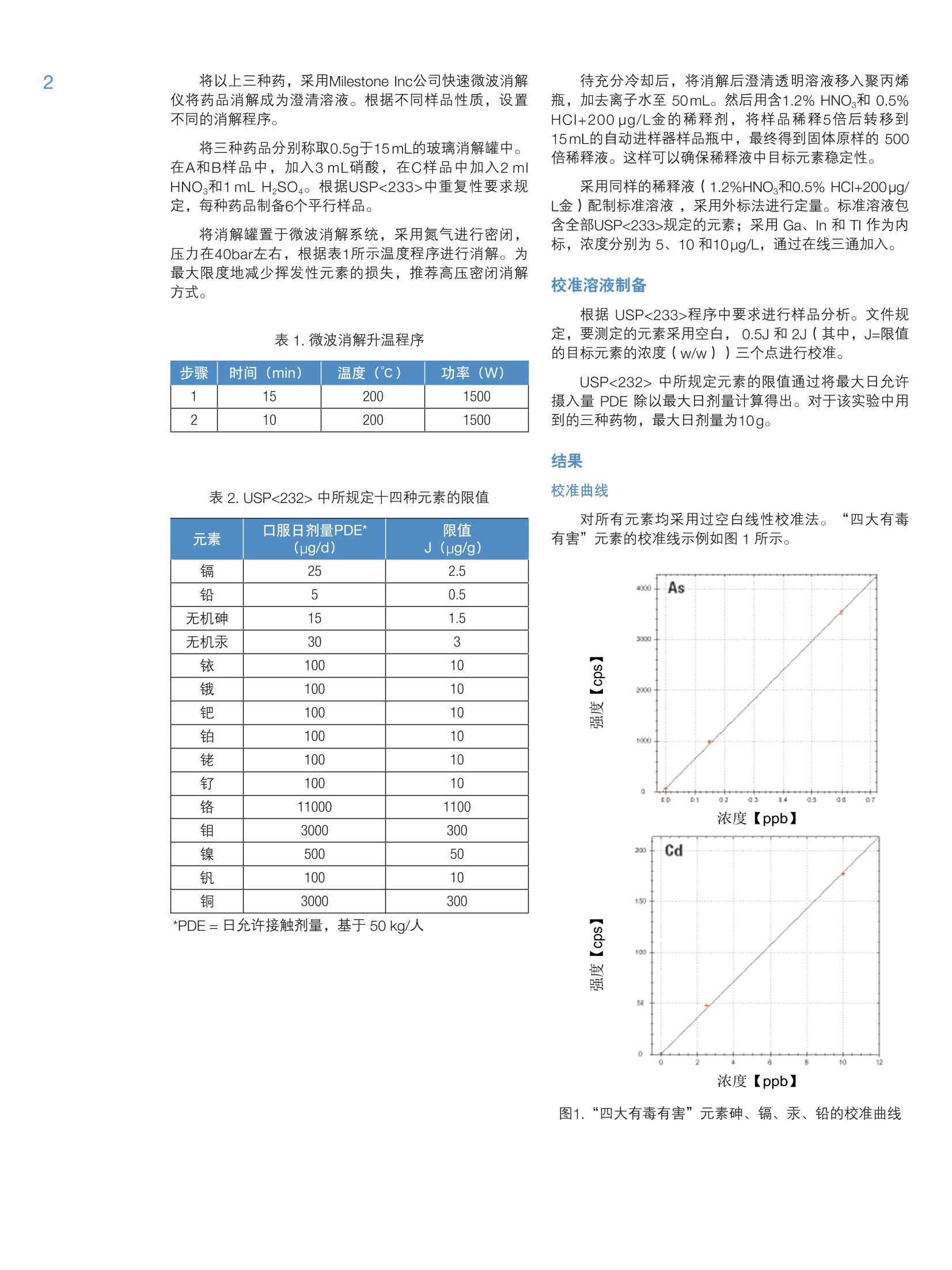
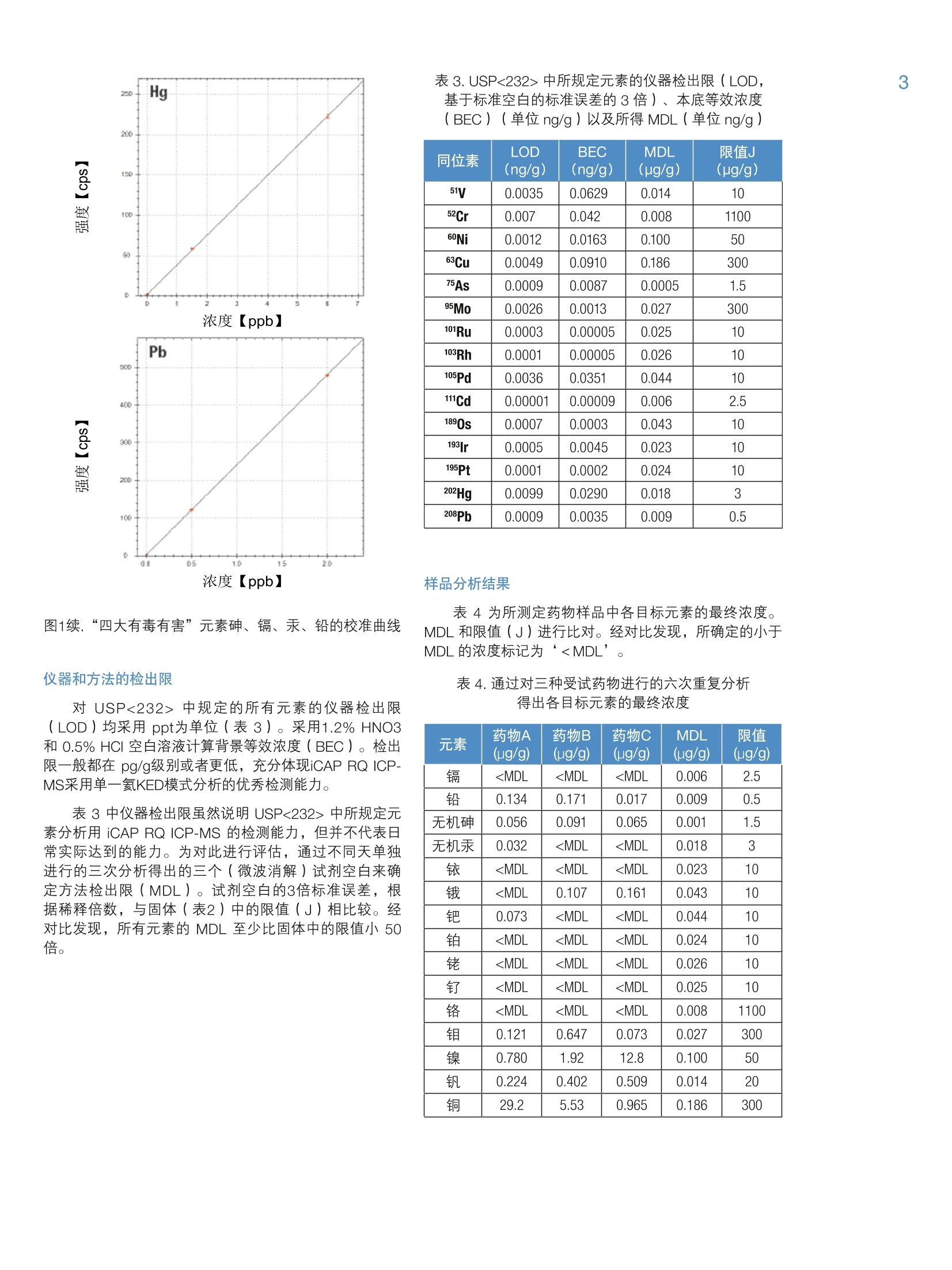
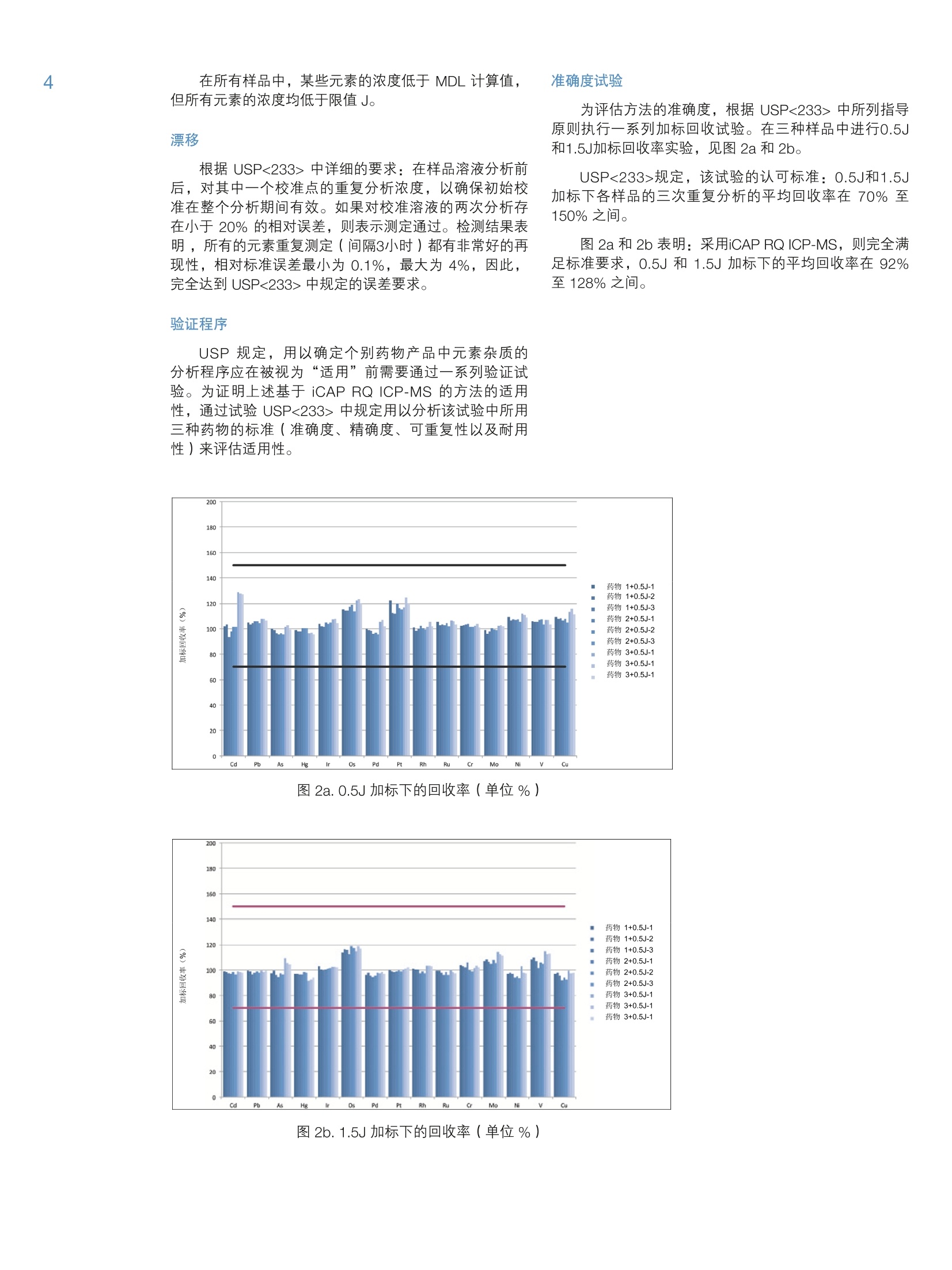
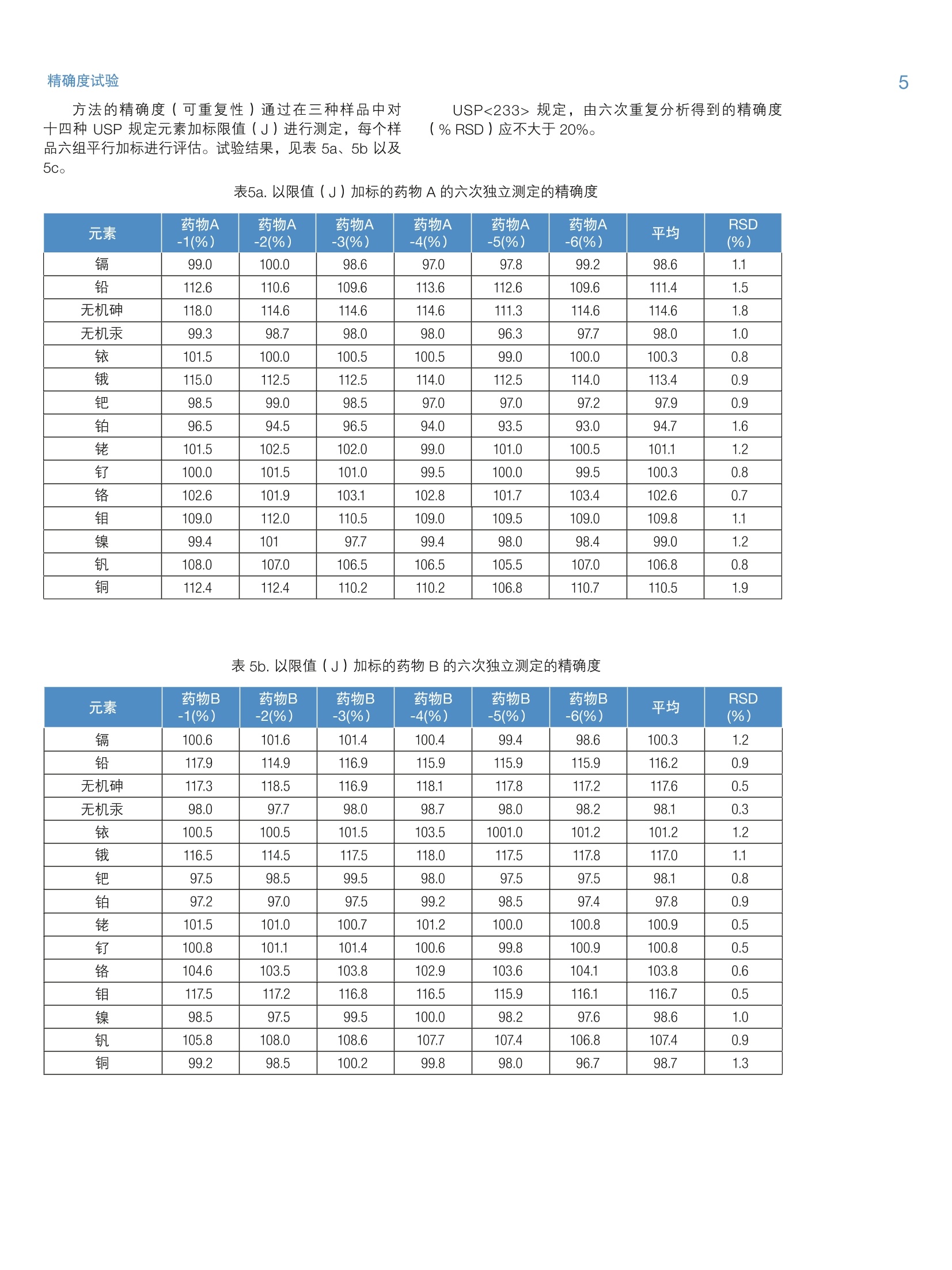
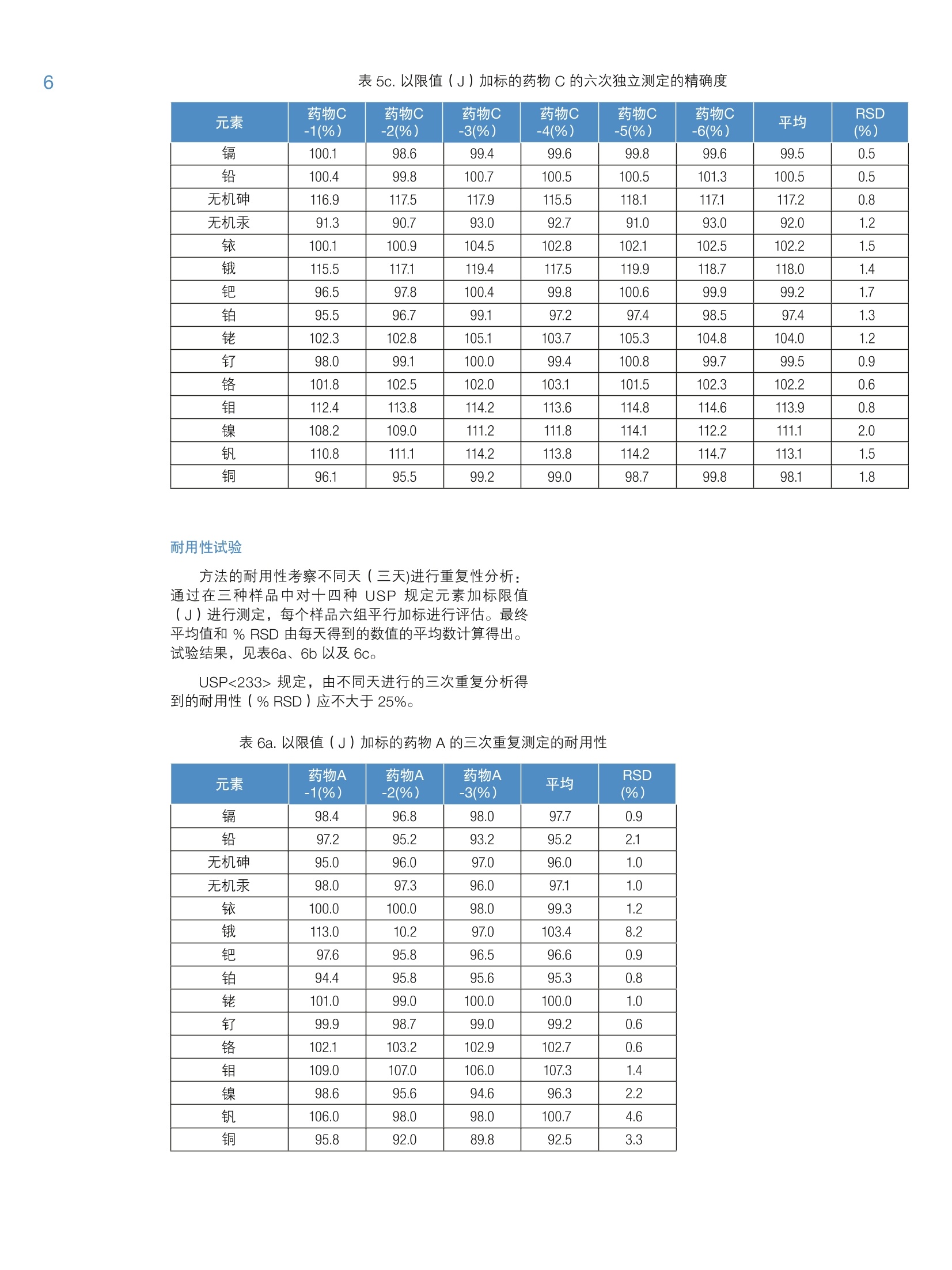
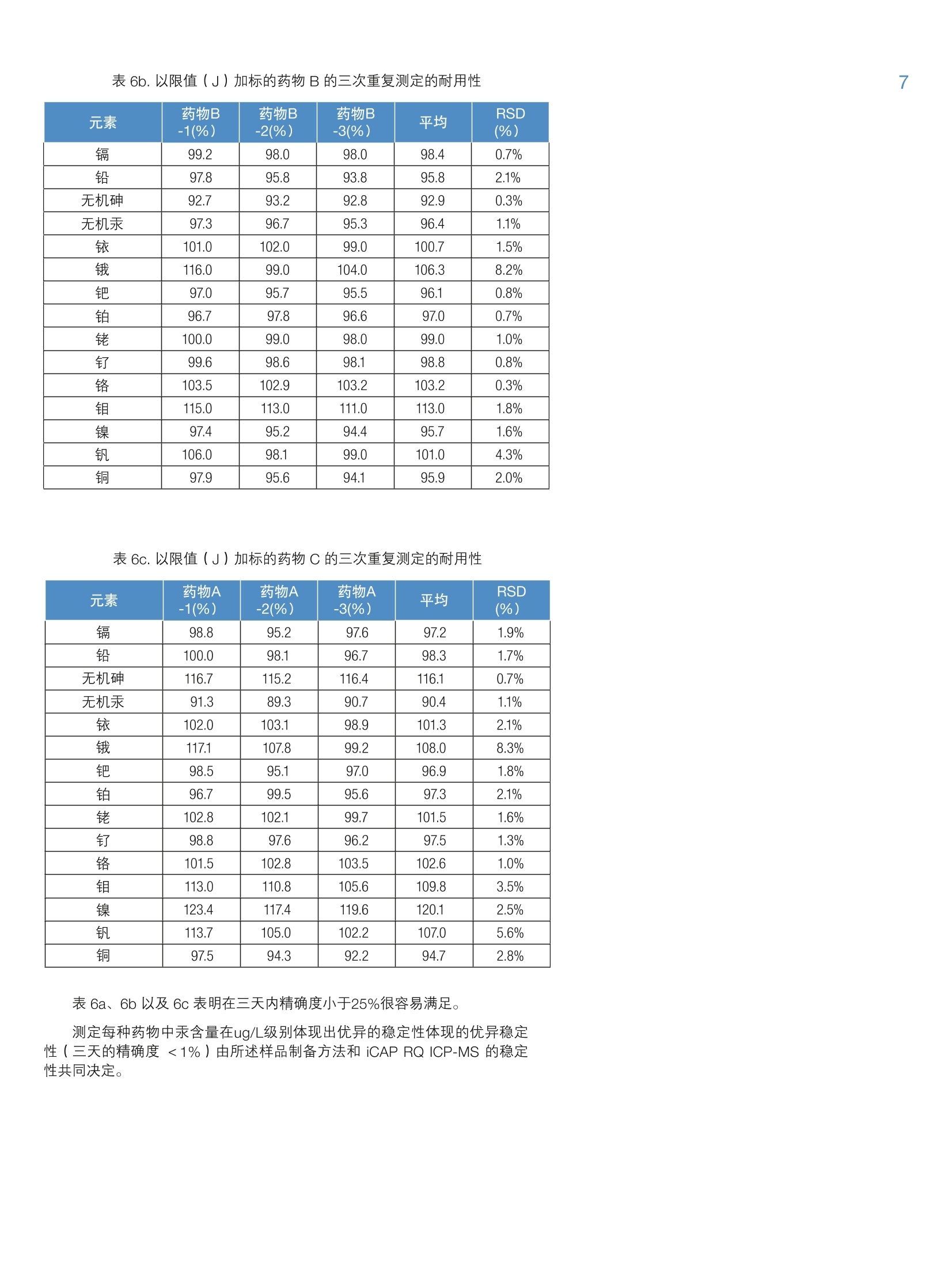
2 4 采用 Thermo Scientific iCAP RQ ICP-MS 分析药物产品中杂质元素 Julian Wills and Daniel KutscherThermo Fisher Scientific, Bremen, Germany 关键词: FDA 21 CFR Part 11;微波消解;药物合规性;药物制剂; 《美国药典》; USP 232; USP 233 目标:采用 Thermo ScientificTM iCAPTM RQ ICP-MS 可准确测定微波消解后药物样品中的元素杂质含量。所有样品的制备、测定以及数据评估过程均符合USP <232>“元素杂质-限度”章节和<233>“元素杂质-程序”章节。 引言 药物产品中杂质现已受到极大关注,不仅是因为特定污染物的遗传毒性,还因为污染物可能对药物稳定性和有效期产生的不利影响。这就使监测原料到成品的整个制药过程中的有机和无机杂质非常重要。我国在1905年引入的《美国药典》(USP)通则<231>,通则里规定十几种能与硫化物形成元素共沉淀,将沉淀后的溶液与10ppm 铅标准溶液目视比色法测定。 比色法测定的局限性很大(元素特异性,基于对微量金属毒性的差异性),因此, USP 又发布了下列两项新通则来替换通则<231>: 。新通则<232>元素杂质-限量;定义药物产品中十五种元素的最大限量。 。新通则<233>元素杂质-程序;定义这十五种元素的测定方法。 尽管USP 已经推新通则执行日期(目前预期于2018年1月1日正式生效),但旧通则<231>肯定不久将失效,到时所有元素杂质测定必须根据新通则<233>程序要求;并且需符合新通则<232>中的限量要求。 除了 USP 文件中提及的要求外,任何用于药物分析数据创建的分析方法还必须符合美国食品药品管理局(FDA)颁布的《美国联邦法规》(CFR) 21 CFR Part11关于电子化记录和电子化签名确认的要求。所述法规确保任何“人们创建、修改、维护、存档、检索或转移的电子化记录和电子化签名”的完整性和真实性。因此,制药过程中所使用分析仪器控制软件必须能够维持分析方法和所得结果的完整性。,为了确保提供透明的数据生成路径,控制软件应支持检查跟踪系统和电子化签名以及安全特性,确保如无明确的“XXX已因 XXX被XXX更改”指示,不做任何变更。 本方法根据 USP<233> 中规定的ICP-MS 方法,将Thermo Scientific iCAPTM RQ ICP-MS 应用于USP<232>中所规定15种目标元素的定性和定量分析。为了使数据符合《美国联邦法规》21 CFR Part 11, ThermoScientificTM QtegraTM Intelligent Scientific Data SolutionTM(ISDS)软件符合制药业GMP的要求,、审计跟踪、电子化签名支持以及综合安全数据管理的功能。 样品制备 样品直接水溶后进行测定符合USP233的要求;但是,微波消解法还是被公认为符合USP233最有效,最广泛的前处理方法。在 USP<232>中采用微波消解法的最重要优势对挥发性元素有效保留,尤其是汞。 有下列三种药物产品供本研究中分析用: 药物A:植物(草本)药 药物B:血管用药 药物C:抗焦虑药 将以上三种药,采用Milestone Inc公司快速微波消解仪将药品消解成为澄清溶液。根据不同样品性质,设置不同的消解程序。 将三种药品分别称取0.5g于15mL的玻璃消解罐中。在A和B样品中,加入3mL硝酸,在C样品中加入2 mlHNO和1mL HSO4。根据USP<233>中重复性要求规定,每种药品制备6个平行样品。 将消解罐置于微波消解系统,采用氮气进行密闭,压力在40bar左右,根据表1所示温度程序进行消解。为最大限度地减少挥发性元素的损失,推荐高压密闭消解方式。 表1.微波消解升温程序 步骤 时间(min) 温度(℃) 功率(W) 1 15 200 1500 2 10 200 1500 表2. USP<232>中所规定十四种元素的限值 元素 口服日剂量PDE* (ug/d) 限值 J(ug/g) 镉 25 2.5 铅 5 0.5 无机砷 15 1.5 无机汞 30 3 铱 100 10 100 10 钯 100 10 铂 100 10 铑 100 10 钉 100 10 铬 11000 1100 钼 3000 300 镍 500 50 钒 100 10 铜 3000 300 *PDE=日允许接触剂量,基于50kg/人 待充分冷却后,将消解后澄清透明溶液移入聚丙烯瓶,加去离子水至50mL。然后用含1.2% HNO 和 0.5%HCI+200 ug/L金的稀释剂,将样品稀释5倍后转移到15mL的自动进样器样品瓶中,最终得到固体原样的500倍稀释液。这样可以确保稀释液中目标元素稳定性。 采用同样的稀释液(1.2%HNO。和0.5% HCI+200pg/L金)配制标准溶液,采用外标法进行定量。标准溶液包含全部USP<233>规定的元素;采用 Ga、In 和TI作为内标,浓度分别为5、10和10pg/L,通过在线三通加入。 根据 USP<233>程序中要求进行样品分析。文件规定,要测定的元素采用空白,0.5J和2J(其中,J=限值的目标元素的浓度(w/w))三个点进行校准。 USP<232>中所规定元素的限值通过将最大日允许摄入量 PDE 除以最大日剂量计算得出。对于该实验中用到的三种药物,最大日剂量为10g。 结果 对所有元素均采用过空白线性校准法。“四大有毒有害”元素的校准线示例如图1所示。 图1.“四大有毒有害”元素砷、镉、汞、铅的校准曲线 图1续.“四大有毒有害”元素砷、镉、汞、铅的校准曲线 仪器和方法的检出限 对 USP<232> 中规定的所有元素的仪器检出限(LOD)均采用 ppt为单位(表3)。采用1.2% HNO3和0.5% HCI 空白溶液计算背景等效浓度(BEC)。检出限一般都在 pg/g级别或者更低,充分体现iCAP RQ ICP-MS采用单一氦KED模式分析的优秀检测能力。 表3中仪器检出限虽然说明 USP<232>中所规定元素分析用 iCAP RQ ICP-MS 的检测能力,但并不代表日常实际达到的能力。为对此进行评估,通过不同天单独进行的三次分析得出的三个(微波消解)试剂空白来确定方法检出限(MDL)。试剂空白的3倍标准误差,根据稀释倍数,与固体(表2)中的限值(J)相比较。经对比发现,所有元素的 MDL 至少比固体中的限值小50倍。 基于标准空白的标准误差的3倍)、本底等效浓度(BEC)(单位ng/g)以及所得 MDL(单位ng/g) 同位素 LOD (ng/g) BEC (ng/g) MDL (pg/g) 限值J (pg/g) 51V 0.0035 0.0629 0.014 10 52Cr 0.007 0.042 0.008 1100 60Ni 0.0012 0.0163 0.100 50 63Cu 0.0049 0.0910 0.186 300 75As 0.0009 0.0087 0.0005 1.5 95Mo 0.0026 0.0013 0.027 300 101Ru 0.0003 0.00005 0.025 10 103Rh 0.0001 0.00005 0.026 10 105Pd 0.0036 0.0351 0.044 10 111Cd 0.00001 0.00009 0.006 2.5 1890s 0.0007 0.0003 0.043 10 193 r 0.0005 0.0045 0.023 10 195Pt 0.0001 0.0002 0.024 10 202Hg 0.0099 0.0290 0.018 3 208Pb 0.0009 0.0035 0.009 0.5 表4为所测定药物样品中各目标元素的最终浓度。MDL和限值(J)进行比对。经对比发现,所确定的小于MDL的浓度标记为‘中详细的要求:在样品溶液分析前后,对其中一个校准点的重复分析浓度,以确保初始校准在整个分析期间有效。如果对校准溶液的两次分析存在小于20%的相对误差,则表示测定通过。检测结果表明,所有的元素重复测定(间隔3小时)都有非常好的再现性,相对标准误差最小为0.1%,最大为4%,因此,完全达到 USP<233>中规定的误差要求。 验证程序 USP 规定,用以确定个别药物产品中元素杂质的分析程序应在被视为“适用”前需要通过一系列验证试验。为证明上述基于 iCAP RQ ICP-MS 的方法的适用性,通过试验 USP<233>中规定用以分析该试验中所用三种药物的标准(准确度、精确度、可重复性以及耐用性)来评估适用性。 图2a.0.5J加标下的回收率(单位%) 准确度试验 为评估方法的准确度,根据 USP<233>中所列指导原则执行一系列加标回收试验。在三种样品中进行0.5J和1.5J加标回收率实验,见图2a 和2b。 USP<233>规定,该试验的认可标准:0.5J和1.5J加标下各样品的三次重复分析的平均回收率在70%至150%之间。 图 2a 和2b表明:采用iCAPRQ ICP-MS,则完全满足标准要求,0.5J 和1.5J加标下的平均回收率在92%至128%之间。 方法的精确度(可重复性)通过在三种样品中对十四种 USP规定元素加标限值(J)进行测定,每个样品六组平行加标进行评估。试验结果,见表5a、5b以及5c. USP<233>规定,由六次重复分析得到的精确度(%RSD)应不大于20%。 表5a.以限值(J)加标的药物A的六次独立测定的精确度 元素 药物A -1(%) 药物A -2(%) 药物A 3(%) 药物A -4(%) 药物A -5(%) 药物A -6(%) 平均 RSD (%) 镉 99.0 100.0 98.6 97.0 97.8 99.2 98.6 1.1 铅 112.6 110.6 109.6 113.6 112.6 109.6 111.4 1.5 无机砷 118.0 114.6 114.6 114.6 111.3 114.6 114.6 1.8 无机汞 99.3 98.7 98.0 98.0 96.3 97.7 98.0 1.0 铱 101.5 100.0 100.5 100.5 99.0 100.0 100.3 0.8 115.0 112.5 112.5 114.0 112.5 114.0 113.4 0.9 钯 98.5 99.0 98.5 97.0 97.0 97.2 97.9 0.9 铂 96.5 94.5 96.5 94.0 93.5 93.0 94.7 1.6 铑 101.5 102.5 102.0 99.0 101.0 100.5 101.1 1.2 钉 100.0 101.5 101.0 99.5 100.0 99.5 100.3 0.8 铬 102.6 101.9 103.1 102.8 101.7 103.4 102.6 0.7 钼 109.0 112.0 110.5 109.0 109.5 109.0 109.8 1.1 镍 99.4 101 97.7 99.4 98.0 98.4 99.0 1.2 钒 108.0 107.0 106.5 106.5 105.5 107.0 106.8 0.8 铜 112.4 112.4 110.2 110.2 106.8 110.7 110.5 1.9 表5b.以限值(J)加标的药物B的六次独立测定的精确度 元素 药物B-1(%) 药物B-2(%) 药物B3(%) 药物B-4(%) 药物B -5(%) 药物B-6(%) 平均 RSD (%) 镉 100.6 101.6 101.4 100.4 99.4 98.6 100.3 1.2 铅 117.9 114.9 116.9 115.9 115.9 115.9 116.2 0.9 无机砷 117.3 118.5 116.9 118.1 117.8 117.2 117.6 0.5 无机汞 98.0 97.7 98.0 98.7 98.0 98.2 98.1 0.3 铱 100.5 100.5 101.5 103.5 1001.0 101.2 101.2 1.2 116.5 114.5 117.5 118.0 117.5 117.8 117.0 1.1 钯 97.5 98.5 99.5 98.0 97.5 97.5 98.1 0.8 铂 97.2 97.0 97.5 99.2 98.5 97.4 97.8 0.9 铑 101.5 101.0 100.7 101.2 100.0 100.8 100.9 0.5 钉 100.8 101.1 101.4 100.6 99.8 100.9 100.8 0.5 铬 104.6 103.5 103.8 102.9 103.6 104.1 103.8 0.6 钼 117.5 117.2 116.8 116.5 115.9 116.1 116.7 0.5 镍 98.5 97.5 99.5 100.0 98.2 97.6 98.6 1.0 钒 105.8 108.0 108.6 107.7 107.4 106.8 107.4 0.9 铜 99.2 98.5 100.2 99.8 98.0 96.7 98.7 1.3 表5c.以限值(J)加标的药物C的六次独立测定的精确度 元素 药物C -1(%) 药物C -2(%) 药物C -3(%) 药物C -4(%) 药物C -5(%) 药物C-6(%) 平均 RSD (%) 镉 100.1 98.6 99.4 99.6 99.8 99.6 99.5 0.5 铅 100.4 99.8 100.7 100.5 100.5 101.3 100.5 0.5 无机砷 116.9 117.5 117.9 115.5 118.1 117.1 117.2 0.8 无机汞 91.3 90.7 93.0 92.7 91.0 93.0 92.0 1.2 铱 100.1 100.9 104.5 102.8 102.1 102.5 102.2 1.5 115.5 117.1 119.4 117.5 119.9 118.7 118.0 1.4 钯 96.5 97.8 100.4 99.8 100.6 99.9 99.2 1.7 铂 95.5 96.7 99.1 97.2 97.4 98.5 97.4 1.3 铑 102.3 102.8 105.1 103.7 105.3 104.8 104.0 1.2 钉 98.0 99.1 100.0 99.4 100.8 99.7 99.5 0.9 铬 101.8 102.5 102.0 103.1 101.5 102.3 102.2 0.6 钼 112.4 113.8 114.2 113.6 114.8 114.6 113.9 0.8 镍 108.2 109.0 111.2 111.8 114.1 112.2 111.1 2.0 钒 110.8 111.1 114.2 113.8 114.2 114.7 113.1 1.5 铜 96.1 95.5 99.2 99.0 98.7 99.8 98.1 1.8 耐用性试验 方法的耐用性考察不同天(三天)进行重复性分析:通过在三种样品中对十四种 USP 规定元素加标限值(J)进行测定,每个样品六组平行加标进行评估。最终平均值和% RSD 由每天得到的数值的平均数计算得出。试验结果,见表6a、6b以及6c。 USP<233>规定,由不同天进行的三次重复分析得到的耐用性(%RSD)应不大于25%。 表6a.以限值(J)加标的药物A的三次重复测定的耐用性 元素 药物A-1(%) 药物A-2(%) 药物A -3(%) 平均 RSD (%) 镉 98.4 96.8 98.0 97.7 0.9 铅 97.2 95.2 93.2 95.2 2.1 无机砷 95.0 96.0 97.0 96.0 1.0 无机汞 98.0 97.3 96.0 97.1 1.0 铱 100.0 100.0 98.0 99.3 1.2 113.0 10.2 97.0 103.4 8.2 钯 97.6 95.8 96.5 96.6 0.9 铂 94.4 95.8 95.6 95.3 0.8 铑 101.0 99.0 100.0 100.0 1.0 钉 99.9 98.7 99.0 99.2 0.6 铬 102.1 103.2 102.9 102.7 0.6 钼 109.0 107.0 106.0 107.3 1.4 镍 98.6 95.6 94.6 96.3 2.2 钒 106.0 98.0 98.0 100.7 4.6 铜 95.8 92.0 89.8 92.5 3.3 表6b.以限值(J)加标的药物B的三次重复测定的耐用性 元素 药物B -1(%) 药物B -2(%) 药物B -3(%) 平均 RSD (%) 镉 99.2 98.0 98.0 98.4 0.7% 铅 97.8 95.8 93.8 95.8 2.1% 无机砷 92.7 93.2 92.8 92.9 0.3% 无机汞 97.3 96.7 95.3 96.4 1.1% 铱 101.0 102.0 99.0 100.7 1.5% 116.0 99.0 104.0 106.3 8.2% 钯 97.0 95.7 95.5 96.1 0.8% 铂 96.7 97.8 96.6 97.0 0.7% 铑 100.0 99.0 98.0 99.0 1.0% 钉 99.6 98.6 98.1 98.8 0.8% 铬 103.5 102.9 103.2 103.2 0.3% 钼 115.0 113.0 111.0 113.0 1.8% 镍 97.4 95.2 94.4 95.7 1.6% 钒 106.0 98.1 99.0 101.0 4.3% 铜 97.9 95.6 94.1 95.9 2.0% 表6c.以限值(J)加标的药物C的三次重复测定的耐用性 元素 药物A -1(%) 药物A -2(%) 药物A -3(%) 平均 RSD (%) 镉 98.8 95.2 97.6 97.2 1.9% 铅 100.0 98.1 96.7 98.3 1.7% 无机砷 116.7 115.2 116.4 116.1 0.7% 无机汞 91.3 89.3 90.7 90.4 1.1% 铱 102.0 103.1 98.9 101.3 2.1% 117.1 107.8 99.2 108.0 8.3% 钯 98.5 95.1 97.0 96.9 1.8% 铂 96.7 99.5 95.6 97.3 2.1% 铑 102.8 102.1 99.7 101.5 1.6% 钉 98.8 97.6 96.2 97.5 1.3% 铬 101.5 102.8 103.5 102.6 1.0% 钼 113.0 110.8 105.6 109.8 3.5% 镍 123.4 117.4 119.6 120.1 2.5% 钒 113.7 105.0 102.2 107.0 5.6% 铜 97.5 94.3 92.2 94.7 2.8% 表6a、6b以及 6c表明在三天内精确度小于25%很容易满足。 测定每种药物中汞含量在ug/L级别体现出优异的稳定性体现的优异稳定性(三天的精确度<1%)由所述样品制备方法和 iCAP RQ ICP-MS的稳定性共同决定。 结论 本指旨表明, iCAP RQ ICP-MS 是测定药物产品中杂质元素的理想解决方案。对于三种样品药物,方法检出限比限值小五十倍,这表明 iCAP RQ ICP-MS 能轻而易举地准确且精确测定 USP<232>中规定的限值下所有十四种元素。据此,考虑到 USP 及其它国家级和国际级机构制定的规程持续变更,代表ICP-MS在微量元素杂质分析的药物实验室永不过时。 最后,先进灵活的ISDS软件中包含的安全特性范围、数据管理以及追踪审计功能为“在受高度管制的制药业环境下满足《美国联邦法规》21 CFR part 11 的要求”提供必要支持。 1. Multi-element Determination in PharmaceuticalPreparations Using the Thermo Scientific iCAP QICP-MS According to the February 2013 USP Regulations,Thermo Scientific Application Note AN43143. 仅供研究用。 赛默飞世尔科技(中国)有限公司 免费服务热线:800810 5118 400 6505118(支持手机用户) ThermoFisher S CIENTIFIC S CIENTIFIC AN_ 药物产品中杂质现已受到极大关注,不仅是因为特定污染物的遗传毒性,还因为污染物可能对药物稳定性和有效期产生的不利影响。这就使监测原料到成品的整个制药过程中的有机和无机杂质非常重要。我国在 1905 年引入的《美国药典》(USP)通则<231>,通则里规定十几种能与硫化物形成元素共沉淀,将沉淀后的溶液与 10 ppm 铅标准溶液目视比色法测定。
确定


还剩6页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《药物产品中杂质元素检测方案(等离子体质谱)》,该方案主要用于化药制剂中鉴别检测,参考标准--,《药物产品中杂质元素检测方案(等离子体质谱)》用到的仪器有赛默飞iCAP TQ电感耦合等离子体质谱仪
相关方案
更多
该厂商其他方案
更多










