
方案详情
文
2012年,美国药典(USP)推出了一个全新的ICP-OES/ICP-MS方法,用于测定医药产品中的一组金属污染物。该方法主要是通过将样品中的重金属离子与硫化物形成沉淀,然后再将其与10ppm铅标准溶液形成的沉淀进行颜色比较,从而完成对重金属总量的测定3。虽然这个方法已经被使用超过一百年了,但人们普遍认为它很容易出现错误,并且这种方法对分析人员正确解释颜色的要求很高。本研究将集中探讨采用配置有prepFAST在线自动稀释和自动校准样品传输系统的NexION 300X ICP-MS对不同药物产品中的一组具有毒性作用的元素进行分析时的实际优势,重点关注杂质元素限值和推荐的分析步骤。本研究还将对一些常见的药物产品进行分析,并列出采用本系统测定的满足USP对该方法验证要求的数据。
方案详情

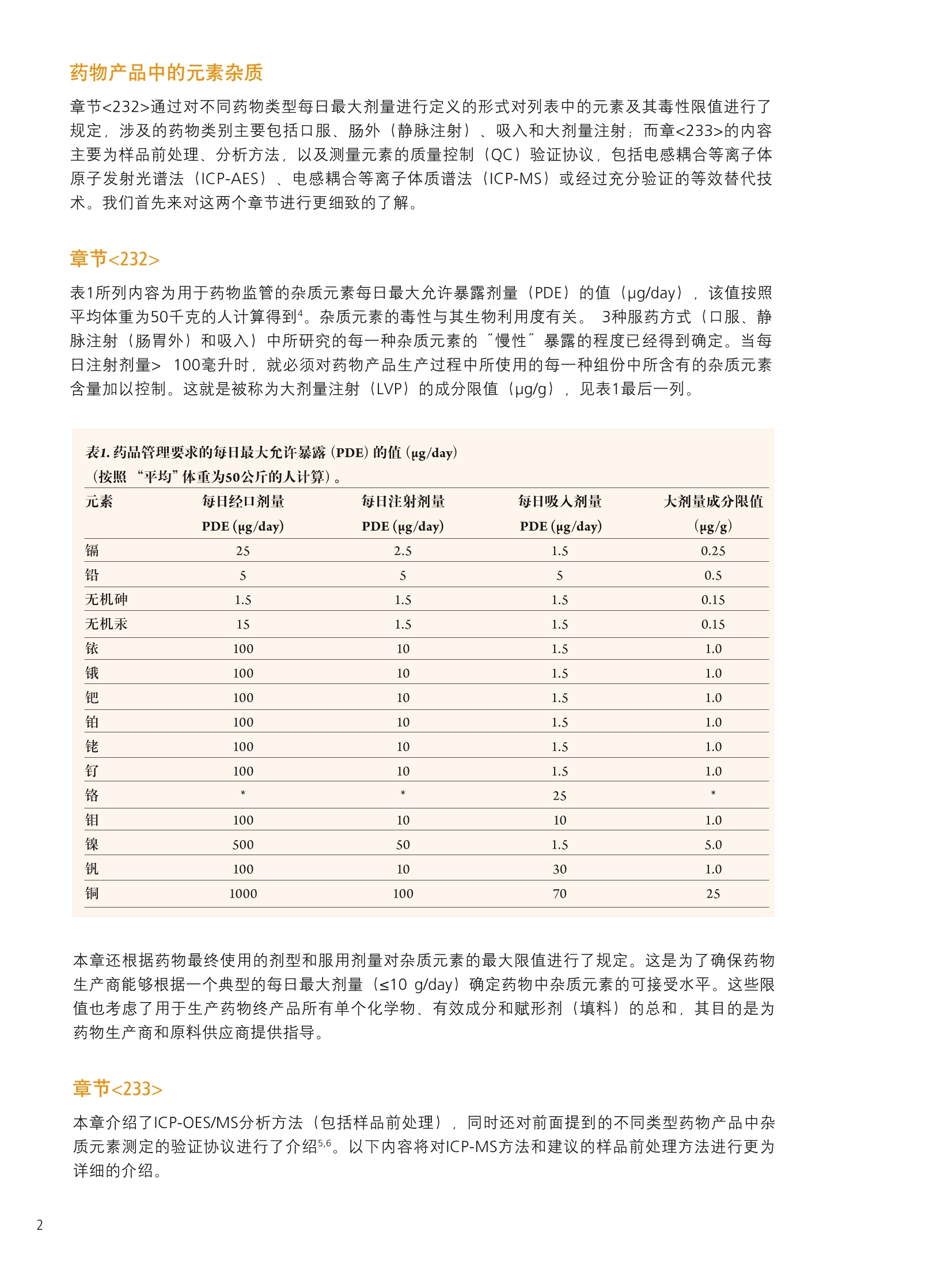
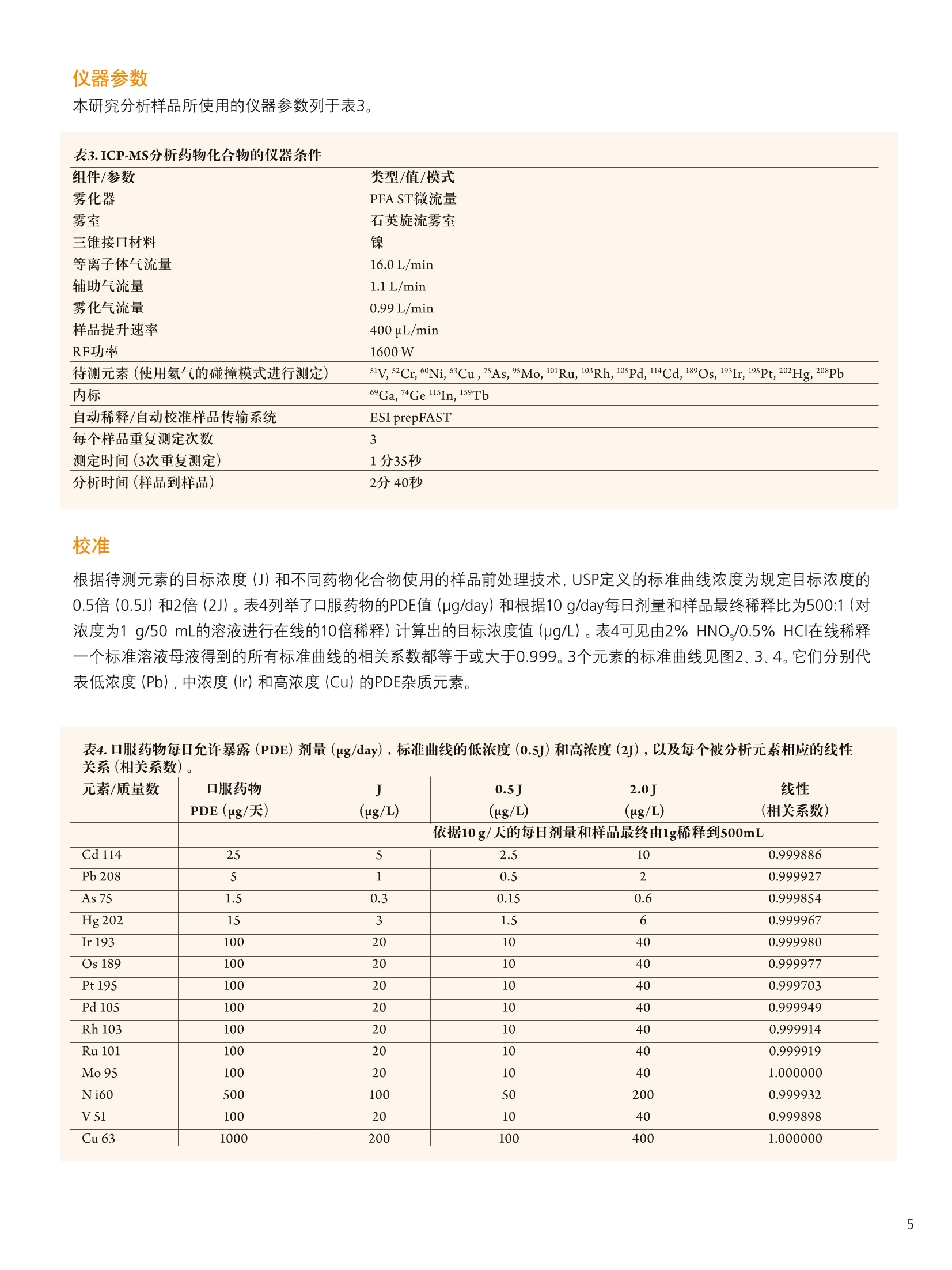
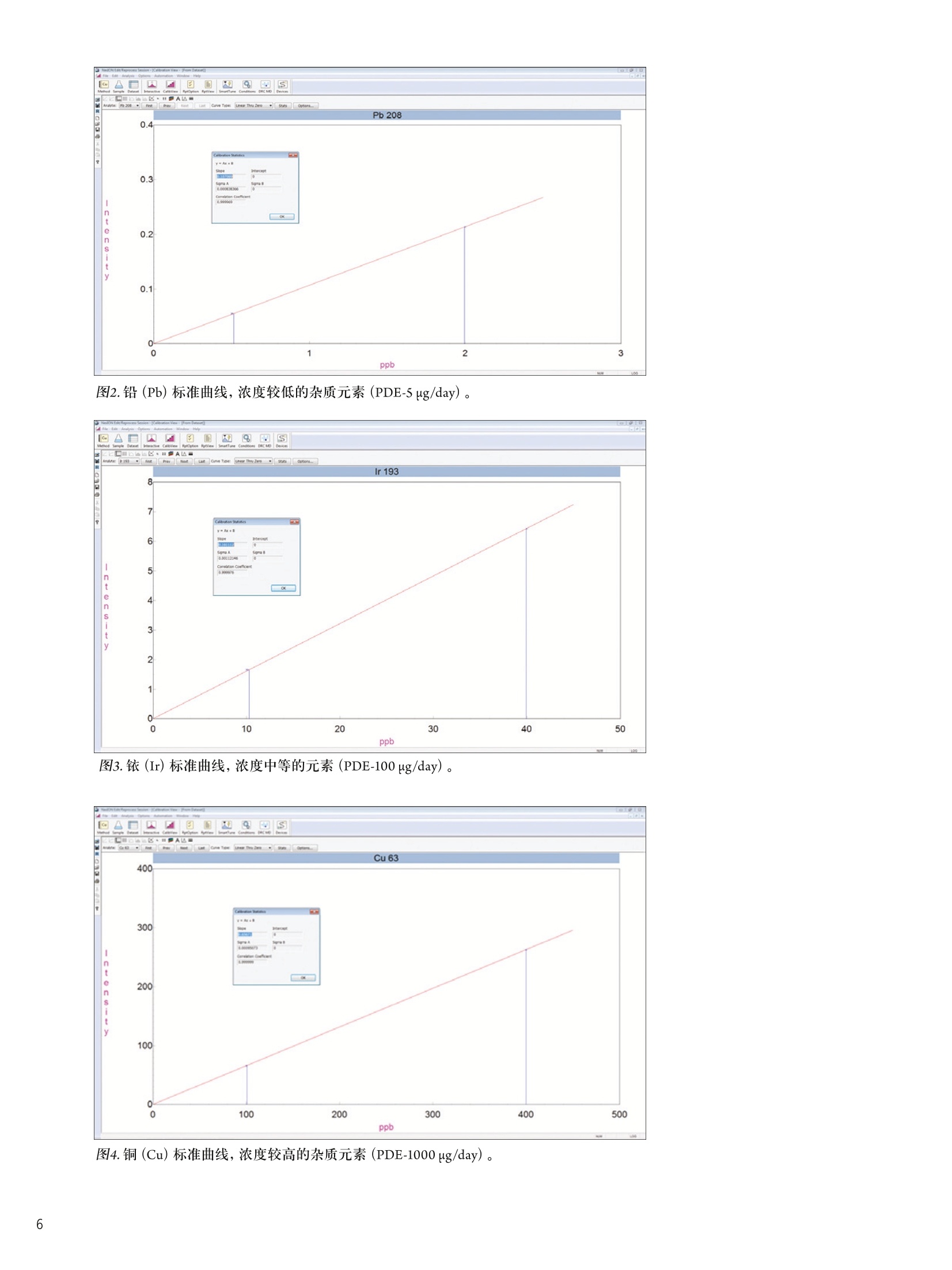
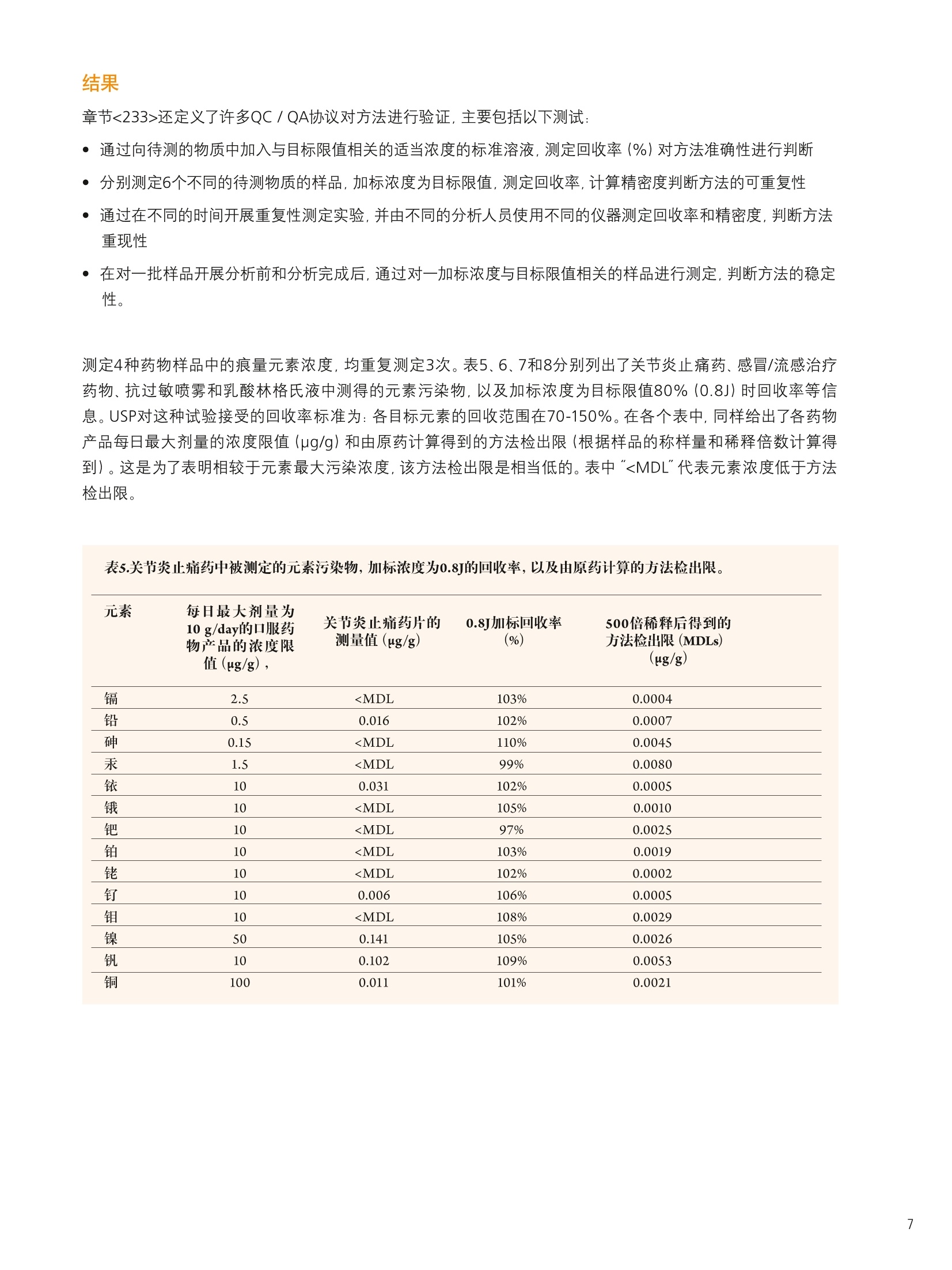
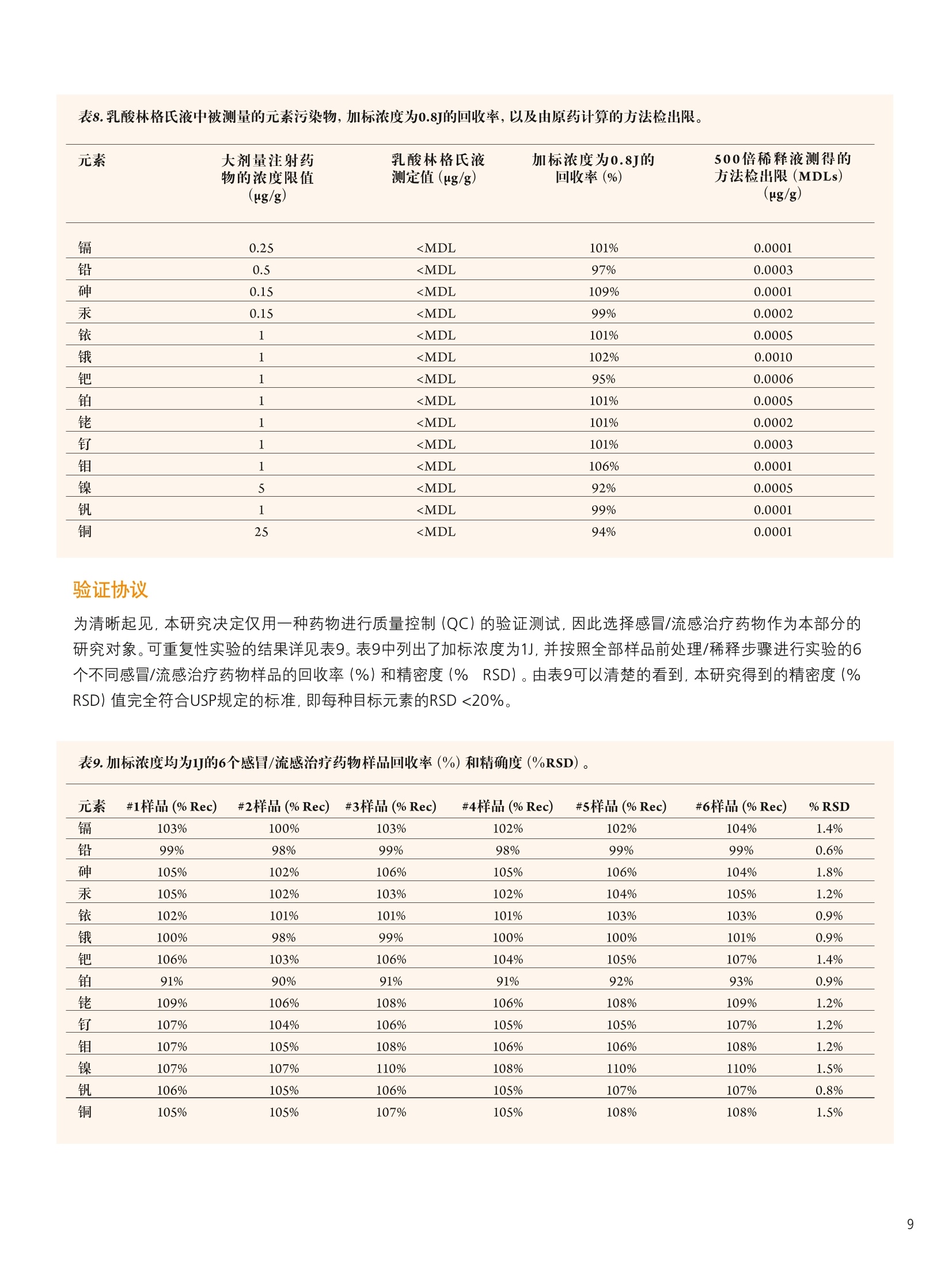
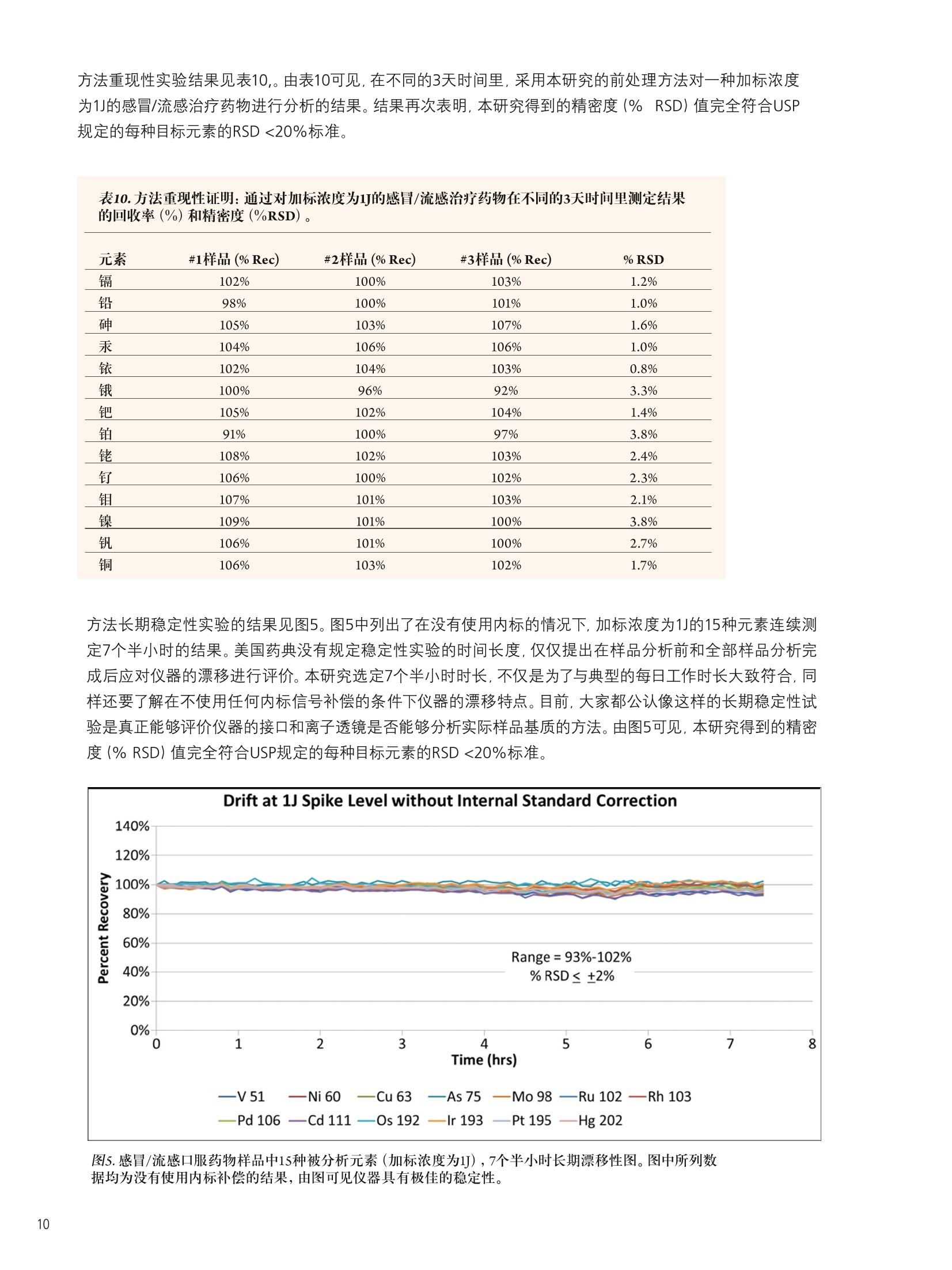
仪器参数 结论 使用带有prepFAST 在线自动稀释/校准系统的NexION300X ICP-MS帮助执行美国药典 (USP) 中元素杂质新规定的优势分析 前言 2012年4月,美国药典(USP)推出了一个全新的ICP-OES/ICP-MS方法,用于测定医药产品中的一组金属污染物。该方法被总结在章节<232>和<233>中,题名为元素杂质-限值和测试步骤" 1.2,取代了章节<231>。章节<231>的方法主要是通过将样品中的重金属离子与硫化物形成沉 淀,然后再将其与10ppm铅标准溶液形成的沉淀进行颜色比较,从而完成对重金属总量的测定3。虽然这个方法已经被使用超过一百年了,但人们普遍认为它很容易出现错误,并且这种方法对分析人员正确解释颜色的要求很高。 本研究将集中探讨采用配置有prepFAST在线自动稀释和自动校准样品传输系统的NexlON@300X ICP-MS对不同药物产品中的一组具有毒性作用的元素进行分析时的实际优势。本文将首先对USP方法进行简要的介绍,并重点关注杂质元素限值和推荐的分析步骤。本研究还将对一些常见的药物产品进行分析,这些产品将涉及主要的服药方式类型::口服、静脉注射和吸入剂型,并列出采用本系统测定的满足USP对该方法验证要求的数据。 药物产品中的元素杂质 章节<232>通过对不同药物类型每日最大剂量进行定义的形式对列表中的元素及其毒性限值进行了规定,涉及的药物类别主要包括口服、肠外(静脉注射)、吸入和大剂量注射;而章<233>的内容主要为样品前处理、分析方法,以及测量元素的质量控制(QC)验证协议,包括电感耦合等离子体原子发射光谱法 (ICP-AES)、电感耦合等离子体质谱法((ICP-MS)或经过充分验证的等效替代技术。我们首先来对这两个章节进行更细致的了解。 章节<232> 表1所列内容为用于药物监管的杂质元素每日最大允许暴露剂量量(PDE)的值 (ug/day),,该值按照平均体重为50千克的人计算得到4。杂质元素的毒性与其生物利用度有关。 3种服药方式(口服、静脉注射(肠胃外)和吸入)中所研究的每一种杂质元素的“慢性”暴露的程度已经得到确定。当每日注射剂量>100毫升时,就必须对药物产品生产过程中所使用的每一种组份中所含有的杂质元素含量加以控制。这就是被称为大剂量注射 (LVP)的成分限值(u(pg/g), 见表1最后一列。 表1.药品管理要求的每日最大允许暴露(PDE)的值(ug/day) 元素 每日经口剂量 每日注射剂量 每日吸人剂量 大剂量成分限值 PDE(ug/day) PDE(ug/day) PDE(g/day) (ug/g) 镉 25 2.5 1.5 0.25 铅 5 5 0.5 无机砷 1.5 1.5 1.5 0.15 无机汞 15 1.5 1.5 0.15 铱 100 10 1.5 1.0 锇 100 10 1.5 1.0 钯 100 10 1.5 1.0 铂 100 10 1.5 1.0 铑 100 10 1.5 1.0 钉 100 10 1.5 1.0 铬 * * 25 * 钼 100 10 10 1.0 镍 500 50 1.5 5.0 钒 100 10 30 1.0 铜 1000 100 70 25 本章还根据药物最终使用的剂型和服用剂量对杂质元素的最大限值进行了规定。这是为了确保药物生产商能够根据一个典型的每日最大剂量 (≤10 g/day) 确定药物中杂质元素的可接受水平。这些限值也考虑了用于生产药物终产品所有单个化学物、有效成分和赋形剂(填料)的总和,其目的是为药物生产商和原料供应商提供指导。 章节<233> 本章介绍了ICP-OES/MS分析方法(包括样品前处理)),同时还对前面提到的不同类型药物产品中杂质元素测定的验证协议进行了介绍5.6。以下内容将对ICP-MS方法和建议的样品前处理方法进行更为详细的介绍。 ICP-MS方法:章节中对仪器方法的介绍是通用的,没有关于仪器参数或最佳分析质量数选择的详细说明。它基本上包括了一些QC/QA验证协议,以确保检测方法的正常运行。该法规定: 根据药品剂型和每日最大剂量,|目标示i(元素)限值(即“”值)被定义为被分析杂质元素的可接受浓度。 校准曲线系列为两个基体匹配的标准溶液和一个基体匹配的空白溶液。每个元素标准溶液高浓度为目标限值的2倍(2J),低浓度为目标限值的一半(0.5J)。 将样品进行稀释,确保样品浓度不超过目标限值的2倍(2J)). 根据仪器生产商推荐的仪器条件和待测元素质量数进行样品的分析,并采取适当的措施对基质引发的多原子干扰进行校正。 可以使用碰撞/反应池减少多原子光谱干扰。 必须按照一系列的质量控制(QC)验证协议确保按该方法得到的数据可靠,协议包括加标回收率、准确度、精密度和稳定性试验。 可以用四种不同的方法对样品进行前处理: 如果样品是适当浓度的液体形式,分析未稀释的样品。 如果样品是水溶性的,使用酸性水溶液稀释样品。 如果样品是不溶于水的,使用适当的有机溶剂稀释。 使用密闭微波容器加酸消解不溶性样品。 应当认真考虑酸的选择,因为酸的选择不当会对ICP造成潜在的由基质所产生的光谱干扰。 仪器 本研究的目的是对配置了prepFAST在线自动稀释和自动校准系统 (ElementalScientific,美国内布拉斯加洲奥马哈)的NexlON300X电感耦合等离子体质谱仪 (ICP-MS) (铂金埃尔默公司,美国康涅狄格 州谢尔顿)的实验性能进行评价。NexlON300技术已在相关文献中有所介绍,它可以同时提供了传统碰撞池技术和具有优越检出限的反应池技术,具有简单性和方便性。使用专利的通用池技术: (UniversalCellTechnologyTM , UCT). 可以在某一特定分析中选择最适合的碰撞或反应池技术。加上仪器的三锥接口(TCI)和四级杆离子检测器 (QJD)技术,可以将漂移减小到最低,也可以将接口区域的污染降低,并且日常维护和清洗也保持在绝对最低水平。NexION 300X ICP-MS是单通道版本,使得仪器可以使用碰撞模式 (KED),,反应池模式 (DRC) (并且两种模式都只使用一种反应气),以及标准(或普通)ICP-MS操作模式7。 图1 prepFAST系统加载样品进入进样环和在线稀释的两个步骤。 prepFAST是一个自动稀释系统,它与NexlON 300X ICP-MS可以完全融合,从而对样品和标准溶液母液进行 在线自动稀释8。溶液可以从每一个自动进样器的位置被快速、重复的真空加载到进样环。这一过程可见图1。在第一步进样针复位过程中,进样环被迅速(真空)清洗和加载样品,而雾化器和雾室则通过加载的溶液清洗。在第2步中,样品沿流动路径被注入到NexlON ICP-MS中,并在流动路径中通过阀门加入稀释剂(端口3)和内标物质(端口7),然后混合。所有溶液使用进样针进样保证了稀释的准确和精确,同时也保持总流速的恒定。稀释、加入内标和溶液混合全部都通过在线混合阀实现。高精度的进样针传输既保证了精密、准确的稀释倍数,同时还保持了样品总流速的恒定。该系统被用于NexION ICP-MS校准曲线的自动配制和对样品溶液的在线稀释。该方法对于实验任务量较大的药物分析实验室而言,还具有以下优势: ·实时稀释最大到200倍 ·稀释阀头 消除了手动稀释造成的误差 。稀释倍数较高时减少所需的试剂使用量 快速提升和冲洗 降低污染风险 药物产品评估 表2中列出了所调查的药物,分别代表表1中定义的三种不同类别的药物产品-口服、吸入和大体积的非肠道(静脉内注射)药物产品。 药物 服用方式 剂型 样品前处理 稀释因子 关节炎止痛药 口服 片剂 微波消解 1g到50mL 感冒/流感药物 口服 粉剂 电热板消解 1g到50 mL 过敏/哮喘喷雾(a) 吸入 溶液 稀释 1g到50mL 乳酸林格氏液(b) 大剂量注射 溶液 稀释 1 g到50mL (b)乳酸林格氏液是一种渗透压和粘度与人体血液相同的液体,与静脉内给药的药物化合物配合使用。这种溶液的成分较多,但它通常含有钠、钾和/或氯化钙(1%),以乳酸钠形式存在的乳糖,以及一种葡萄糖溶液。 样品前处理 取1g样品,并使用2% HNO,/0.5% HCI混合酸将样品溶解。将关节炎止痛药样品制成粉末,使用Multiwave 3000微波消解系统(铂金埃尔默公司,美国康涅狄格州谢尔顿)对样品进行消解,并将样品最终定容到50mL。流感/感冒治疗药物使用混合酸溶解,在电热板上加热加速溶解后定容至50mL。抗过敏药物和乳酸林格氏溶液本来就是以液体形式存在,因而直接取1g样品溶液定容到50mL。对于口服药物样品再利用prepFAST系统进行在线10倍稀释,使得样品最终稀释倍数达到500。需要强调的是,如果在实验过程中,分析的样品种类很多,并且这些样品每日服用剂量不同,元素的目标限值(J)也不相同,就要求对样品进行额外的稀释或者是重新配制校准曲线。 prepFAST在线自动稀释方法的一个主要优势就在于它能够实现完全的自动化,而无需进行额外的手动稀释。 本研究分析样品所使用的仪器参数列于表3。 组件/参数 类型/值/模式 雾化器 PFA ST微流量 雾室 石英旋流雾室 三锥接口材料 镍 等离子体气流量 16.0 L/min 辅助气流量 1.1 L/min 雾化气流量 0.99L/min 样品提升速率 400 uL/min RF功率 1600 W 待测元素(使用氦气的碰撞模式进行测定) 5V,5²Cr,60Ni,63Cu,7As,sMo,10lRu,103Rh,105Pd,114Cd,189Os, 193Ir,195Pt, 202Hg, 208Pb 内标 69Ga,7+Ge11sIn,1s9Tb 自动稀释/自动校准样品传输系统 ESI prepFAST 每个样品重复测定次数 3 测定时间(3次重复测定) 1分35秒 分析时间(样品到样品) 2分40秒 校准 根据待测元素的目标浓度(J)和不同药物化合物使用的样品前处理技术, USP定义的标准曲线浓度为规定目标浓度的0.5倍(0.5J)和2倍(2J)。表4列举了口服药物的PDE值(pg/day) 和根据10 g/day每日剂量和样品最终稀释比为500:1(对浓度为1 g/50 mL的溶液进行在线的10倍稀释)计算出的目标浓度值(ug/L)。表4可见由2% HNO.,/0.5% HCI在线稀释一个标准溶液母液得到的所有标准曲线的相关系数都等于或大于0.999。3个元素的标准曲线见图2、3、4。它们分别代表低浓度(Pb), 中浓度(Ir) 和高浓度(Cu) 的PDE杂质元素。 表4.口服药物每日允许暴露(PDE) 剂量(ug/day),标准曲线的低浓度(0.5J)和高浓度(2J),以及每个被分析元素相应的线性关系(相关系数)。 图2.铅(Pb)标准曲线,浓度较低的杂质元素 (PDE-5 ug/day)。 图3.铱(Ir)标准曲线,浓度中等的元素 (PDE-100 ug/day)。 图4.铜(Cu)标准曲线,浓度较高的杂质元素 (PDE-1000 ug/day)。 结果 章节<233>还定义了许多QC/QA协议对方法进行验证,主要包括以下测试: ·通过向待测的物质中加入与目标限值相关的适当浓度的标准溶液,测定回收率(%)对方法准确性进行判断 ·分别测定6个不同的待测物质的样品,加标浓度为目标限值,测定回收率,计算精密度判断方法的可重复性 ·通过在不同的时间开展重复性测定实验,并由不同的分析人员使用不同的仪器测定回收率和精密度,判断方法重现性 ·在对一批样品开展分析前和分析完成后,通过对一加标浓度与目标限值相关的样品进行测定,判断方法的稳定性。 测定4种药物样品中的痕量元素浓度,均重复测定3次。表5、6、7和8分别列出了关节炎止痛药、感冒/流感治疗药物、抗过敏喷雾和乳酸林格氏液中测得的元素污染物,以及加标浓度沐目标限值80%(0.8J)时回收率等信息。USP对这种试验接受的回收率标准为:各目标元素的回收范围在70-150%。在各个表中,同样给出了各药物产品每日最大剂量的浓度限值(ug/g)和由原药计算得到的方法检出限(根据样品的称样量和稀释倍数计算得到)。这是为了表明相较于元素最大污染浓度,该方法检出限是相当低的。表中"和<233>规定对药物产品中一组杂质元素进行分析。研究还表明,该技术可以很轻松的取得章节<232>中关于四种主要服药方式药物规定的每日允许暴露剂量 (PDE)限值。本研究实验的数据也证明了该仪器能够很容易达到章节<233>中规定的质量控制和验证协议。 此外,使用在线自动稀释/自动校准样品传输系统使得该方法可以通过自动完成标准曲线系列配制、样品稀释和内标添加等劳动密集型工作,从而很好的满足实验任务量较大的药物分析实验室的要求。而且还可以显著降低人员操作错误和样品、标准溶液、空白溶液污染的风险,因为所有这些功能的实现都是在线完成,并没有分析人员的人为干预。 ( 参考文献 ) ( 1. United States Pharmacopeia General Chapter < 231> H e avy Metals Test i n USP National Formulary (NF) ) ( 2. United States Pharmacopeia General Chapter <232> Elemental Impurities - Limits: 2nd Supplement of USP 35-NF 30. ) 3. United States Pharmacopeia General Chapter <233> Elemental Impurities-Procedures: 2nd Supplementof USP 35-NF 30. 4. United States Pharmacopeia General Chapter <1151> Pharmaceutical Dosage Forms-Routes ofAdministration in USP National Formulary (NF). 5. United States Pharmacopeia General Chapter <730> Plasma Spectrochemistry Method in USP NationalFormulary (NF). 6. United States Pharmacopeia General Chapter <1225> Validation of Compendial Procedures in USPNational Formulary (NF). ( 7. E. Pruszkowski, C. Bosnak, The Analysis of Drinking Waters by U .S. EPA M ethod 200.8 Us i ng the NexION 300X ICP-MS in S t andard and Collis i on Modes, P e rkinElmer I n c. A pplication Note. ) .8. PrepFAST On-line Auto-dilution and Auto-calibration Sample Delivery System: Elemental Scientific Inc.Application Note. 致谢 PerkinElmer公司非常感谢Elemental Scientific 公司 (ESI) 的Paul Field博士, Austin Shultz和Kyle Uhlmeyer,感谢他们对本研究的重要贡献。 ESI提供了像本研究中使用的prepFAST系统这样的高品质创新技术,与PerkinElmer的痕量金属分析仪器实现了完美结合。 PerkinElmer, Inc. 珀金埃尔默仪器(上海)有限公司 地址:上海张江高科技技区张衡路1670号邮编:201203 电话:021-60645888 传真:021-60645999 www.perkinelmer.com.cn 要获取全球办事处的完整列表,请访问http://www.perkinelmer.com.cn/AboutUs/ContactUs/ContactUs 版权所有 C2012, PerkinElmer, Inc.保留所有权利。PerkinElmer@是PerkinElmer, Inc. 的注册商标。其它所有商标均为其各自持有者或所有者的财产。010599_01_CN
确定





还剩9页未读,是否继续阅读?
珀金埃尔默企业管理(上海)有限公司为您提供《化学药中特殊物质和基团检测方案 》,该方案主要用于化药制剂中限度检查检测,参考标准--,《化学药中特殊物质和基团检测方案 》用到的仪器有等离子质谱仪PerkinElmer
该厂商其他方案
更多









