“量体裁衣“ZFN,从源头降低岩藻糖!
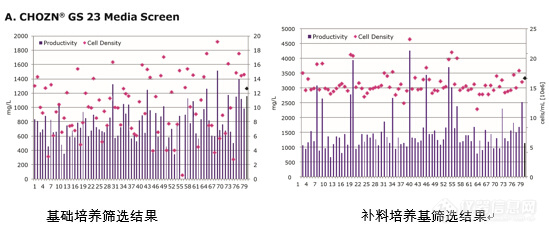
“量体裁衣“ZFN,从源头降低岩藻糖!前言在理解锌指核酸酶之前,我们首先来回顾一下其他的核酸酶是如何切割特异性的DNA序列,从中我们可能会得到一些启示,如何对核酸酶进行改造,让它们能特异性地切割我们想要的序列。限制性内切酶在原核生物中普遍存在,其主要目的是识别外源DNA并将其摧毁,从而抵御病毒的入侵。根据限制酶的结构,辅因子的需求切位与作用方式,可将限制酶分为三种类型:Ⅰ型限制酶为复合功能酶,具有限制-修饰两种功能,但在 DNA链上没有固定的切割位点,一般在离切割位点1kb到几kb的地方随机切割,不产生特异性片段。Ⅲ型酶与Ⅰ型酶基本相似,不同的是Ⅲ型酶有特异性的切割位点,但这两类酶对DNA酶切分析的意义不大,通常所说的限制性内切酶是指Ⅱ型酶,它能够识别与切割DNA链上的特定的核苷酸顺序,产生特异性的DNA片段。基因编辑三件套剪刀FokI是一种存在于细菌Flavobacterium okeanokoites的II型限制酶,由位于N端的DNA结合结构域(N-terminal DNA-binding domain)以及位于C端的非专一性DNA切割结构域(C-terminal DNA cleavage domain)组成。FokI的分子量为65.4 kDA,含有587个氨基酸。和典型的II型限制酶一样,FokI核酸酶只要被招募到DNA上可以发挥功能,还有一个重要的特点就是,FokI核酸酶只有在二聚的情况下才能发挥功能。如下图所示,蓝色和绿色表示的两个FokI分子形成的二聚体结构,DNA recognition domain识别和结合位点是5’-GGATG-3’DNA序列,然后cleavage domain在距离识别位点下游的9-13个核苷酸的位置,对任意序列的核苷酸进行切割。 所以,我们在进行基因工程改造时,可以利用FokI核酸酶的cleavage domain,然后将其组装到其他的recognition domain上,就可以对特定的序列进行切割。 定位锌指首先在Aaron Klug实验室的爪蟾非洲爪蟾的转录研究中发现,是一种小的蛋白质motif,其特征在于结合一个或多个锌离子(Zn2+)以稳定折叠,由于结构类似手指而由此得名。在真核生物中从酵母到人类广泛存在,在人类的基因组中近1500种基因里包含锌指结构。根据残基的数量和顺序对不同类型的锌指进行分类(例如,Cys2His2, Cys4, 和 Cys6),其中最常见的是Cys2His2 ZFs。锌指结构在1985年被发现,在1990s时期被深入研究,通过比较锌指蛋白的DNA识别区域的氨基酸序列以及特异性结合的DNA序列,得到以下结果:DNA识别域是由一系列 Cys2-His2锌指蛋白串联组成,其共有序列为(F/Y)-X-Cys-X2−5-C-X3-(F/Y)-X5-ψ-X2-His-X3−5-His,其中X为任意氨基酸,ψ是疏水性残基,形成一个简单的ββα折叠,这个锌离子位于反平行的β折叠和α螺旋之间,并且与β折叠中的两个半胱氨酸残基和α螺旋螺旋羧基端部分的两个组氨酸残基形成四配位化合物,如下图所示,这是锌指蛋白和DNA结合的三维结构图,锌指蛋白是结合在双链DNA的大沟处,每个锌指蛋白识别并结合3′到5′方向DNA链上一个特异的三联体碱基以及5′到3′方向的一个碱基。而锌指蛋白和DNA识别的特异性是取决于特定位置上的氨基酸。氨基酸的5′到3′方向上第6,3,2,-1号位置的不同的氨基酸分别对应结合的碱基,我们可以设计不同的氨基酸序列组合从而结合特定的DNA序列。例如5′-Arg6-His3-Ser2-Arg-1-3′这段氨基酸序列结合的DNA序列为5′-G-G-G-C-3′。 缝合识别由锌指部分完成,切割由FokI核酸酶的cleavage domain完成,那切割后的DNA片段如何形成完整DNA序列呢?这就要引出细胞内部本身的一套系统--DNA修复机制,和用于定位的锌指蛋白、发挥剪刀功能的FokI核酸酶一样,DNA修复机制在细胞里已经存在了亿万年,自然也不是专门为我们给基因编辑的任务准备的。它的首要使命是保证基因组DNA的完整性,保证哪怕历经严酷的环境挑战,生命的遗传物质都不会被轻易破坏。当锌指核酸酶在基因组中找到合适的位置并进行剪切之后,细胞自身就可以完成缝缝补补的针线活。其中存在两种不同的缝补办法。如果仅仅对基因组DNA一剪了之,没有现成模板可利用的细胞只能用一种简单粗暴的办法进行修复--非同源末端连接(Non-homologous end-joining, NHEJ),就是找到两个DNA断点,不管三七二十一直接粘上就行。这样的好处是简单快捷,坏处是难免会出现不该有的序列错误。为了避免这种错误,细胞会在附近找找有没有序列相似的DNA分子,以它为模板进行修复。这样万一真的出现了不该有的丢失或增加,也可以及时改正。如果在剪切的同时主动给细胞提供一段可供参考的模板序列,细胞就会启动另一种修复机制--DNA的同源重组机制(DNA homologous recombination),按照模板的序列信息老老实实地修复断裂的DNA。这两种缝补办法其实各有各的用处!如果我们想破坏掉一个正常基因的功能,就像破坏掉正常人体内的CCR5基因以期阻止HIV的入侵,前一种不够精确的缝补方法就可以帮助我们达到目的。如果我们想要修复一个原本就有问题的基因,就像镰刀形红细胞贫血症患者体内的HBS基因,那么后一种缝补方法正好能满足需求。 讲到这里,我们已经找到了精确基因编辑所需的工具三件套:●基因组定位:锌指蛋白;●基因组剪刀:FokI核酸酶的剪切模块;●基因组缝合:细胞内天然存在的两套DNA修复机制; 有了这三件套之后,我们就能在感兴趣的地方进行缝缝补补。针对靶序列设计若干个锌指结构域,将这些锌指结构域连在FokI核酸酶上,便可实现靶序列的双链断裂(Double strand break, DSB),最后利用DNA修复机制进行缝合。 基因编辑工具ZFN剪辑有以下特点:1.FokI cleavage domain 没有序列特异性,而且只能以二聚体的形式发挥功能。2.对FokI cleavage domain 进行改造,减少脱靶效应。3.需要构建两组ZFN结构,每组最佳为4个锌指结构,一共识别24个碱基对,增加了对靶序列识别的特异性。除了锌指核酸酶,还有两种基因编辑工具也备受瞩目,那就是转录激活因子样效应因子核酸酶 (transcription activator-like effector nucleases, TALEN)和CRISPR/Cas 系统(CRISPR associated)。下面就简单介绍一下这两种基因编辑工具: TALEN:和锌指核酸酶技术类似,科学家们发现了另一种DNA识别模块TALE蛋白, TALE蛋白是一种源自植物致病菌——黄单包杆菌(Xanthomonas)的天然蛋白,其中也含有DNA结合结构域。由于TALE具有序列特异性结合能力,研究者通过将FokI核酸酶与一段人造TALE连接起来,形成了一类具有特异性基因组编辑功能的强大工具,即TALEN。自2010年正式发明 TALEN技术以来,全球范围内多个研究小组利用体外培养细胞、酵母、拟南芥、水稻、果蝇及斑马鱼等多个动植物体系验证了TALEN的特异性切割活性。近年来,随着TALEN技术逐渐成熟,全球范围内各实验室已广泛使用TALEN技术来 完成基因打靶操作,但是该技术主要用于科研用途,暂时没有商业化产品可以使用。 CRISPR/Cas 系统:CRISPR/Cas作为原核生物中普遍存在的一种免疫系统,最初的功能就是识别外源性入侵的核酸序列,并对其进行特异性降解,以达到抗病毒的作用。其中CRISPR由一系列高度保守的重复序列(repeat)与同样高度保守的间隔序列(spacer)相间排列组成。CRISPR区域第一个重复序列上游有一段CRISPR的前导序列(Leader sequence),该序列作为启动子来启动后续CRISPR序列的转录,转录生成的RNA被命名为CRISPRRNA(简称crRNA)。CRISPR/Cas系统中crRNA与tracrRNA(反式激活的crRNA)形成嵌合RNA分子,即单向导RNA(Single guide RNA,sgRNA)。sgRNA可以介导Cas9蛋白在特定序列处进行切割,形成DNA双链断裂(Double-Stranded Break, DSB),完成基因定向编辑等的各类操作。CRISPR/Cas 系统现有基因编辑和基因修饰里面效率最高、最简便、成本最低、最容易上手的技术之一,成为当今最主流的基因编辑系统。2017年2月15日,美国专利局正式宣布,认可了哈佛大学-麻省理工学院博德研究所(Broad Institute)张锋团队拥有其开发的CRISPR/Cas9基因编辑工具的专利权,所以现在如果商业化使用该技术,需要支付高昂的专利费。 ZFN——商业化首选虽说对ZFN的研究已经很深入,但是对于大部分研究人员来说,如果想要设计两组ZFN蛋白对靶序列进行切割,需要大量的实验探索,因为如前文所描述,每一根锌指并不是完美对应3碱基序列,手指会稍微“长”那么一点点,覆盖到前后的DNA碱基上。因此,当把几根锌指串联起来时,就有可能存在互相干扰,如果想设计出靶向目标序列且不互相干扰的锌指结构,是天文数字般的手指组合以及漫长的信息积累过程。哪些手指组合值得留意?到底怎么计算两根手指的相似性?这些问题筑起了高高的技术壁垒,直到今天,筛选组装出一套好用的锌手指也不是一件轻而易举的事情。 ZFN技术由Sangamo生物科学公司所拥有,被用来开发基因及细胞治疗产品。走在最前面的是和辉瑞合作开发的治疗A型血友病的基因疗法,已经进展到三期临床,还有3个基因和细胞治疗产品进展到1/2临床,十多个产品在临床前阶段,涵盖了罕见病、神经性疾病、肿瘤疾病及自身免疫疾病等多个方面,目标是开发出改变患者生活的基因组药物。 不过,对于ZFN在基因编辑的商业应用,Sangamo则授权给了Sigma-Aldrich,随着sigma被Merck收购,ZFN专利所有权属于Merck。公司投入了大量资金用于研究ZFN算法,最终推出了CompoZr 锌指核酸酶产品,Merck提供定制锌指核酸酶服务,您可扫描文末二维码留言,我们将尽快和您取得联系。 除了定制化的锌指核酸酶服务,Merck也提供一些目录产品。谷氨酰胺合成酶(GS)是生物制药行业最常用的可选标记之一。谷氨酰胺是细胞生长所必需的氨基酸。GS酶负责谷氨酸转化为谷氨酰胺。没有这种酶活性,细胞就不能再内源性合成谷氨酰胺,如果培养基中没有补充谷氨酰胺,细胞就会死亡。CHOZN® GS-/-细胞株利用Merck公司的专利技术CompoZr锌指核酸酶(ZFN)技术在亲本CHO-K1细胞中进行基因修改造,敲除了谷氨酰胺合成酶(GS),形成GS缺陷型的CHOZN® GS-/-细胞系,目前这个细胞系已经在国内外生物医药市场广泛应用。
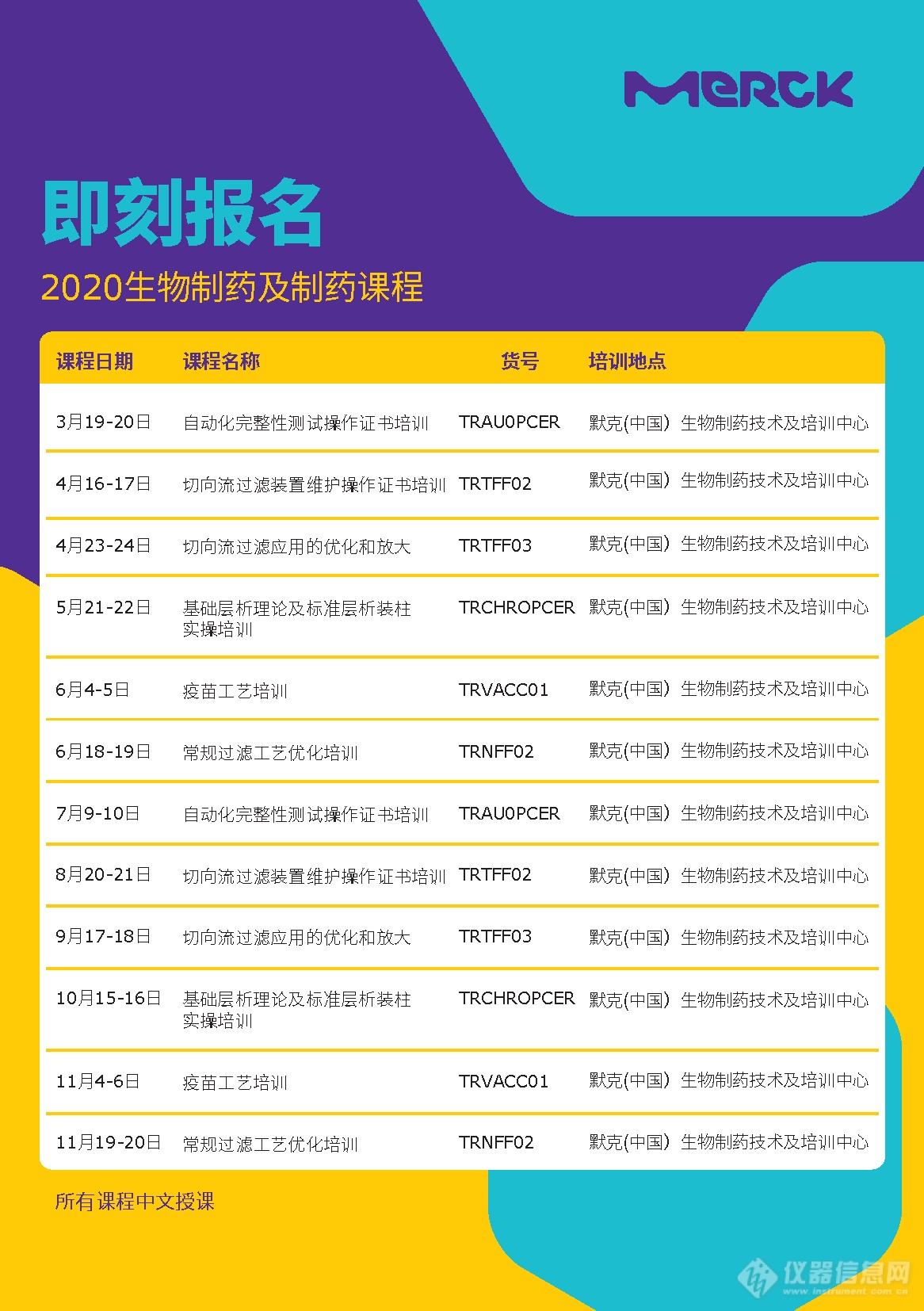
参数原理
2022.04.06
使用高剪切湿法制粒工艺充分发挥Delta晶型甘露醇的优势
前言药用辅料是影响最终制剂质量的重要因素,包括制剂的稳定性、安全性、制剂性能以及生物利用度。近年来,甘露醇因其具有低吸湿性、良好的可压性和安全性等特点,越来越广泛被用作片剂的填充剂。甘露醇至少有三种不同的晶型;α、β和δ晶型,其中β晶型是最稳定的晶型。在湿法制粒过程中,δ晶型甘露醇转变成β晶型,转晶后其形态发生了变化,比表面积[1]显著增加。 与β晶型甘露醇相比,使用δ晶型甘露醇处方的溶出速率得到了显著地提高。溶出速率与比表面和孔隙体积有关。δ晶型甘露醇湿法制粒后颗粒的比表面积和孔隙率显著地高于β晶型甘露醇制得的颗粒.此外,原料药与δ-甘露醇混合后共制粒的表现明显比相应物理混合物的表现好。这是因为共同制粒后物料的润湿性更好,同时药物在甘露醇[2]中的分散度更高。本研究对比了不同的湿法制粒工艺(z型捏合、低剪切和高剪切制粒)对δ晶型甘露醇湿法制粒后片剂性能的影响。实验方法Parteck® Delta M (Delta polymorph甘露醇) 由德国Merck公司提供。使用Glatt Mezcladora GLT MAV-10 (Glatt,Binzen Germany)湿法制粒设备进行高剪切制粒。预混2 min后,以25 g/min的流速加入去离子水,然后制粒10 min。对湿物料整粒后(孔径为1.5 mm),将湿颗粒在真空烘箱 (50 °C, 100 mbar) 中干燥48 - 72小时。使用Hobart 混合机进行低剪切和Z-型捏合混合制粒(Hobart,Offenburg,Germany)。预混1分钟后,通过漏斗缓慢加入去离子水,并制粒10分钟。对湿物料整粒(孔径为1.5 mm)后在流化床中 (Uni Glatt;Glatt Binzen,Germany) 干燥。干燥后的颗粒加入1.5% Parteck® LUB MST(硬脂酸镁)进行总混,使用Korsch EKO-DMS单冲压片机(Korsch,Berlin,Germany) 对总混物料压片。使用11 mm平斜冲;主压力分别为5、10、20、30 kN;片重400 mg。结果和讨论 采用3种不同制粒方法,同时改变水的用量 (去离子水: 5%、10%、15%、20%、25%、30%)对δ-甘露醇的湿法制粒工艺进行优化。晶型转变的分析结果显示,需要加入至少10%的水才能到确保80%以上δ晶型转变成β晶型(图1),从而获得显著增加的表面积和良好的压片性能(图1 B和C)。增加水的用量至20%,不稳定的α晶型的量可以降低到1-5%以下。 将不同制粒方式获得的物料进行压片,结果表明,高剪切湿法制粒工艺制备的片剂具有非常好的性能(硬度高、崩解时间短、脆性低、出片力低)。 这一现象是由于高剪切制粒获得的物料具有优良的粉体/颗粒特性:更小的休止角和更高的堆密度,如图1B和C所示。 另一个重要的原因是,δ-甘露醇在高剪切制粒后具有独特的表面结构,如图2A所示,其具有典型的独特细棒状和针状结构。而在其它两种湿法制粒方法中没有观察到这种独特的结构(图2B和C)。这种细棒状和针状的微观结构被认为是压片得到优异片剂性能的重要原因。 同时,这些细棒状和针状微观结构增加了颗粒的比表面积,从而有利于加快片剂的溶出。结论 高剪切制粒是一种能够充分利用δ-甘露醇独特性能的理想的制粒方式。制粒过程中水的用量对晶型转换和片剂性能具有显著的影响。 总的来说,δ-甘露醇在湿法制粒过程中会从δ晶型转变为β晶型,该转晶过程伴随着比表面积的显著增加。同时实验结果表明,高剪切制粒过程中加水量达到20%时,可以制备具有优异流动性的颗粒,以及优化的片剂性能。参考文献[1] Yoshinari T., Forbes R. T., York P. and Kawashima Y. (2002). “Moisture induced polymorphic transition of mannitol and its morphological transformation.” Int J Pharm 247(1-2): 69-77[2] Könnecke T., Moddelmog G., and Langguth P. (2012). “Influence of beta and delta mannitol on dissolution of low soluble fenofibrate.” Poster presentation at American Association of Pharmaceutical Sciences, Annual Meeting and Exhibition
参数原理
2022.04.06
一个“金牌”元件出马,载体“更高更快更强大”
载体构建中的挑战-低转染效率 目的基因随机整合到异染色质和启动子DNA的甲基化是抑制基因表达的主要机制。在生物制药过程中,稳定和高水平的目的转基因表达是快速筛选单克隆细胞的基础,因此迫切需要我们发现一种或多种基因调控元件,它 们可以有效防止基因沉默,并使目的基因在细胞内长时间保持高水平表达。染色质修饰元件(chromatin-modifying elements) 促进转基因转录的染色质调控元件(chromatin-modifying elements)可大致分为以下两类:(1)作为边界或边界元件限制异染色质标记扩散到常染色质区域,包括绝缘子(Insulator)、支架/基质附着区(scaffold/matrix attachment region, S/MAR)和稳定抗阻遏元件(stabilising anti-repressor element, STAR);(2)通过显性染色质重塑机制发挥积极调控作用的元件,包括基因座位控制区(locus control region, LCR)和泛染色质开放元件(ubiquitous chromatin opening elements, UCOE)。 绝缘子可分为两大类:增强子阻遏绝缘子和屏障绝缘子,存在于开放染色质(常染色质)和封闭染色质(异染色质)之间,能阻止因临近的异染色质传递而造成的位置效应差异。最常用的绝缘子是cHS4,它对红系鸡细胞、人红白血病K562细胞系和转基因小鼠非常有效,但对CHO细胞的作用比较有限。S/MAR具有AT富集区域,能够促进染色质环状结构的形成,作为DNA复制的起点调节基因转录,并且与绝缘子一样,也可以阻止异染色质标记扩散到常染色质区,从而抵抗基因沉默,促进外源基因稳定表达。但只有全长MAR片段(约3 kb)能够增加转基因的表达水平和稳定性,并且MAR的作用弱于UCOE。MAR体积大,并且其作用机制尚未完全清楚,这使得MAR在操控上不可预测,但进一步的研究肯定会有助于更好地理解MAR。因此,MAR目前仍然以科学研究为主,并未在工业生产上广泛应用。通过从500 bp-2.1 kb的人类基因组片段中随机筛选,确认STAR能够抵消染色质相关抑制因子的负面影响。STAR7和STAR40显示出类似的抗阻遏“强度”,在人类和CHO-K1细胞中都是活跃的,并赋予更高数量的阳性菌落和拷贝数依赖的报告蛋白表达。然而另一项研究显示STAR40在CHO细胞中活性有限。STAR元件对细胞存活和转基因表达产生的促进作用很小,尤其是对无血清悬浮液生长的细胞影响更有限。虽然早期研究发现STAR的抗阻遏作用似乎非常有效且有希望,但该系统在工业用途尚未全面发展。LCR是一种具有显性染色质重塑功能的转录调控元件,包含一系列DNA酶I超敏位点以及高密度转录因子结合位点,能够进行染色质重构进而建立可转录的开放染色质区,并且它还能阻止异源染色质扩散,防止位置效应转变,但LCR是组织特异性的,只能在一定条件下发挥作用,限制了其广泛使用。UCOE®是一种具有显性染色质重塑功能的DNA结构域,能够使插入任何染色质位点的DNA进入转录活跃的“开放”状态,但它是组织非特异性的,并且不包含LCR特有的多个DNase I超敏位点,也不需要同时在5′和3′端侧翼插入转基因以发挥其功能(如绝缘体和S/MAR),因此具备商业应用价值。 UCOE®在生物制药领域中的应用UCOE®的发现:染色质(染色体)是细胞遗传物质存在的形式,按其形态特征和活性状态分为两类:常染色质和异染色质。常染色质折叠压缩程度低,相对伸展,不易被甲基化,处于转录活跃的状态;异染色质折叠压缩程度高,处于聚集状态,容易被甲基化,没有基因转录活性。外源基因整合入常染色质是基因转录的必要条件,然而细胞中大部分是异染色质,这就导致外源基因的无效整合。前面小默提到的UCOE®,其结构特点与功能完美的解决了因位置效应引起的基因沉默。看家基因是维持细胞最低限度功能必不可少的基因,如组蛋白基因、核糖体基因及糖酵解酶基因等等,这类基因几乎在所有类型细胞中都表达,是维持细胞基本结构和代谢功能的基础。如前所述,UCOE®正是发现于看家基因启动子附近,并且大多处于两个基因之间,序列横跨两个差异启动子,包含CpG岛结构域,具有开放染色质和防止DNA甲基化的功能,正是因为UCOE®的这种功能才能保证看家基因持续稳定的表达。利用UCOE®的这种特性,将其应用于转基因表达载体,能够显著降低转基因的表观遗传沉默,提高其表达和稳定性,实现转基因的有效整合。UCOE®作用机制:普通质粒携带转基因随机整合入基因组,当其整合位点刚好在常染色质,则转录激活;而当其整合在异染色质,则处于封闭状态,发生转录沉默。将UCOE®元件置于转基因开放阅读框之前形成基于UCOE®的质粒,当UCOE®质粒随机整合入基因组,不管是在常染色质还是异染色质,UCOE®都能打开转基因附近的染色质使其处于开放状态,同时防止启动子的DNA甲基化沉默,从而促进转录活性,使转基因持续稳定的表达。UCOE应用案例:【案例】早在2002年,科学家就发现A2UCOE能够调控转基因在无血清悬浮生长的CHOS细胞中快速表达,A2UCOE通过增加重组蛋白的拷贝数促进表达,并且显著缩小了细胞间的表达差异[4-5]。在CHO-S细胞中,与使用标准hCMV启动子相比,添加4 kb的A2UCOE序列能够显著提高抗体整体表达水平,并且稳定高表达克隆明显增多,在1L反应器中蛋白生产水平也明显优于对照[6]。将基于A2UCOE的系统与市售免疫球蛋白表达载体(pFUSE)进行比较,转染无血清CHO细胞,以确定人源化抗C2单克隆抗体的重链和轻链的表达水平和稳定性,发现基于UCOE®的载体能够产生大量稳定克隆,重组抗体表达水平也显著提高[7]。【案例】从初始转染到鉴定和培养高水平表达转基因的克隆细胞群的时间是重组抗体生产的限速步骤。研究人员使用3kb Rps3 UCOE和8kb A2UCOE与表达IgG-1和IgG-4轻重链的启动子连接,开发了一种用于早期细胞系发育和悬浮CHO细胞克隆分离的快速方法,使用基于UCOE®的载体与ClonePix筛选相结合,使研究人员仅在四周内就从转染筛选获得高表达克隆[8]。使用UCOE®载体在CHO细胞中稳定表达EGFP和促红细胞生成素(EPO)能够改善细胞生长和存活率,并保持稳定的蛋白表达[9-10]。与不含UCOE®的载体相比,使用UCOE®有效降低了染色体重排,并且在长期培养中维持染色体位点整合的同质性[11]。【案例】为了确定生产单克隆抗体最有效的染色质修饰元件,研究人员将核心1.5 kb的A2UCOE亚片段与一系列边界型基因调控元件进行了比较,这些元件定位于由hCMV启动子驱动的重链和轻链抗体转录单元的不同位置,在稳定转染CHOK1和阳性选择细胞池后,与S/MAR、cHS4和STAR载体相比,含有A2UCOE的载体使抗体表达增加六倍以上,细胞传代(120代)稳定性良好,并且还显著降低了转基因启动子DNA甲基化数量,有助于维持起始表达水平。这些结果说明,UCOE®是该单克隆抗体表达系统中效用最高的元件[12]。默克工艺解决方案自2002年发现UCOE®至今刚好20年,UCOE®的结构特点及其作用机制已被科学家研究的非常清晰,很多数据证明UCOE®是目前应用于工业生产最优的染色质重塑元件,其优势不言而喻。Merck Millipore拥有UCOE®全球独家专利技术,并向全球提供含有UCOE®元件的即用型质粒,该UCOE®质粒与CHOZN® CHO GS-/-细胞系配套使用,能够有效提高外源蛋白表达并增加高表达克隆的比例,大大降低筛选通量,节约人力物力成本。CHOZN-UCOE®应用案例分享目前国内已有多家企业使用默克的CHOZN®-UCOE®表达系统,并买断了CHOZN®-UCOE®的商业化授权,可以不限分子不限年限使用该表达体系,并且不会发生知识产权纠纷。已有客户使用该表达系统进行了上市申请,得到了监管机构的完全认可。案例1:将两个UCOE®元件分别置于抗体重链和轻链启动子前构建UCOE®质粒,在96孔板中通过数百组的Mini-pool评估了UCOE®所带的益处。与非UCOE®质粒相比,UCOE®的使用能够大大提高高表达克隆的形成率,进而能够很大程度上节约我们获得高表达克隆的时间。更多数据请点击CHOZN®&UCOE®组合平台 SAFC®工艺解决方案。案例2:UCOE®应用于单抗、双抗、EPO蛋白的表达。案例3:CHOZN®-UCOE®的补料优化案例。图8总结了来自另一个IgG细胞系开发项目(mAb03)的三个克隆的单一补料优化结果,使用EX-CELL® Advanced CHO Feed 1和Cellvento® 4Feed补料混合生成。克隆偏好不同的补料混合物,克隆的表现提高原因也不同。例如,克隆D更喜欢单一的4Feed,而克隆E更喜欢50:50的混合补料;克隆F更喜欢50:50和75%的Feed混合补料(75:25)。在机制方面,克隆D和克隆E显示出活细胞密度的提高,导致滴度更高;对于克隆F,Qp有所提高。案例4:CHOZN®-UCOE®表达系统的反应器放大性良好。参考文献[1] Romanova N , Noll T . Engineered and Natural Promoters and Chromatin‐Modifying Elements for Recombinant Protein Expression in CHO Cells[J]. Biotechnology Journal, 2017:1700232.[2] Antoniou M , Harland L , Mustoe T , et al. Transgenes encompassing dual-promoter CpG islands from the human TBP and HNRPA2B1 loci are resistant to heterochromatin-mediated silencing[J]. Genomics, 2003, 82(3):269-279.[3] A J J N , B J O , B K M , et al. Ubiquitous Chromatin-opening Elements (UCOEs): Applications in biomanufacturing and gene therapy[J]. Biotechnology Advances, 2017, 35( 5):557-564.[4] Benton T , Chen T , Mcentee M , et al. The use of UCOE vectors in combination with a preadapted serum free, suspension cell line allows for rapid production of large quantities of protein[J]. Cytotechnology, 2002, 38(1-3):43-46.[5] Betts Z , Dickson A J . Assessment of UCOE on Recombinant EPO Production and Expression Stability in Amplified Chinese Hamster Ovary Cells[J]. Molecular Biotechnology, 2015, 57(9):846-858.[6] Boscolo S , Mion F , Licciulli M , et al. Simple scale-up of recombinant antibody production using an UCOE containing vector.[J]. New Biotechnology, 2012, 29(4):477-484.[7] Dharshanan S , Chong H , Cheah S H , et al. Stable expression of H1C2 monoclonal antibody in NS0 and CHO cells using pFUSE and UCOE expression system[J]. Cytotechnology, 2013, 66(4):625-633.[8] Hou J , Hughes B S , Smede M , et al. High-throughput ClonePix FL analysis of mAb-expressing clones using the UCOE expression system.[J]. N Biotechnol, 2014, 31(3):214-220.[9] Betts Z , Dickson A J . Assessment of UCOE on Recombinant EPO Production and Expression Stability in Amplified Chinese Hamster Ovary Cells[J]. Molecular Biotechnology, 2015, 57(9):846-858.[10] Betts Z , Croxford A S , Dickson A J . Evaluating the interaction between UCOE and DHFR-linked amplification and stability of recombinant protein expression[J]. Biotechnology Progress, 2015, 31(4).[11] Betts Z , Dickson A J . Ubiquitous Chromatin Opening Elements (UCOEs) effect on transgene position and expression stability in CHO cells following methotrexate (MTX) amplification[J]. Biotechnology Journal, 2016, 11(4):554-564.[12] Fay S , Berni S , Antoniou M N , et al. Chromatin Function Modifying Elements in an Industrial Antibody Production Platform - Comparison of UCOE, MAR, STAR and cHS4 Elements[J]. Plos One, 2015, 10(4):e0120096.[13] Rocha-Pizaa M D R , Ascencio-Favela G , BM Soto-García, et al. Evaluation of changes in promoters, use of UCOES and chain order to improve the antibody production in CHO cells[J]. Protein Expression and Purification, 2017, 132:108-115.[14] Zhang F , Thornhill S I , Howe S J , et al. Lentiviral vectors containing an enhancer-less ubiquitously acting chromatin opening element (UCOE) provide highly reproducible and stable transgene expression in hematopoietic cells[J]. Blood, 2007, 110(5):1448-1457.[15] D Niraja, Maroun K , Citra M , et al. Long-Term Reproducible Expression in Human Fetal Liver Hematopoietic Stem Cells with a UCOE-Based Lentiviral Vector[J]. PLoS ONE,9,8(2014-8-12), 2014, 9(8):e104805.[16] Vincent Y C K , Sonia F , Simon N W , et al. Haemophilia B Curative FIX Production from a Low Dose UCOE-based Lentiviral Vector Following Hepatic Pre-natal Delivery[J]. Current Gene Therapy, 2016, 16(4):-.
参数原理
2022.04.06
宿主细胞使用的技术梳理
宿主细胞使用的技术梳理 摘要:从妥妥的技术角度深度讲解CHOZN® GS-/-系统使用过程中的关键点 Step1: 宿主细胞选择中的难点Step2: 宿主细胞使用的技术梳理Step3: 培养基优化能不能加胰岛素等物质?Step4: 如何在控制风险的基础上优化培养基?Step 5 如何通过过程控制保障产品质量?Step 6 走进MLabStep 7 上游生产阶段如何审计培养基质量Step 8 走进南通培养基工厂上一期小默介绍了野生型CHO细胞和缺陷型CHO细胞各自的优劣以及如何进行选择的问题,同样,在挑选完宿主细胞后的宿主细胞使用过程中也充满了重重险阻。小默将大家在这部分遇到的问题分为了质粒、转染、筛选、克隆成像、培养基、稳定性、工艺和宿主细胞8大类一一解答: 关于质粒小明:上次提到UCOE®质粒可以用更少资源获得更多高产克隆,我非常感兴趣,但UCOE®质粒的提取其实是很多企业没有接触,这其中需要注意什么呢?小默:首先,UCOE®质粒提取所需的感受态细胞类型,建议使用Stbl2或Stbl 3系列的感受态细胞,我们国内MLabTM实验室多次测试过是可行的。除了选择合适的感受态细胞,同时建议低温转化和培养,推荐温度是30℃。转化后需孵育1小时再涂板,平皿培养在30℃培养,培养时间不超过24小时。 具体数据请参考,点击下方链接CHOZN®&UCOE®组合平台 SAFC®工艺解决方案 小明: CHOZN® GS-/- 配套质粒是环状,那质粒到底是线性化好还是环状更好呢?小默:理论上,线性化利于整合,环状利于进入细胞,哪个效率更高并不能准确判断。因此建议在自己平台的基础上,选择表现较好的类型即可。而默克的CHOZN® GS-/-平台小默强烈推荐直接使用环状质粒进行转染,CHOZN® GS-/-在转染时并不注重转染效率的小幅提高,因为CHOZN® GS-/-本身可以在不添加MSX筛选压力的条件下进行minipool筛选,恢复率很高接近100%。而且CHOZN® GS-/-平台的优势就是便于客户使用,线性化质粒增加了操作的复杂性。 关于转染小明:当遇到转染后24 h细胞活率很低,只有30-40%,甚至更低的时候怎么办?小默:首先要保证转染用的质粒浓度高于1 mg/ml,内毒素含量低于10 EU/ml。另外建议电转实验设计一个阴性对照(ddH2O),确保电转体系没有问题,通常阴性对照在电转后以及电转后24小时活率均在90%以上,细胞密度也会增长。如果确定转染体系没有问题,可以尝试减少加入的质粒量,优化电转条件。 小明:那CHOZN® GS-/-平台转染后的操作流程是什么样的?以及为什么minipool几乎全部生长出来了,会不会没有筛选效果?小默:CHOZN® GS-/-转染后静置培养24h后以5000 cells/孔进行minipool铺板,铺板数量6~8块,基本每个孔都能逐渐长满。铺板培养基是80%cloning medium+20%CD Fusion,后续补液及逐级放大都是使用CD Fusion培养基,一般2-3周左右细胞可以达到80%汇合度。该工艺是优化后的工艺,选择这一工艺是希望用较少的孔板拿到高产的minipool,在保证筛选通量的同时也可以减少工作量。值得注意的是,CHOZN® GS-/-细胞在整个筛选过程中是不需要加MSX的,所以筛选流程与其他宿主细胞不太相同。 小明:那如果使用CHOZN® CHO K1进行细胞株开发,需要加MSX吗?小默:CHOZN® CHO K1minipool铺板时需要添加MSX,使用浓度建议10uM-30μM之间,后续及单克隆筛选不再需要添加MSX。 关于筛选小明:接下来如果用CHOZN® GS-/-筛选出来的minipool进行有限稀释,一般按什么密度去铺板?平均一块96孔板大概形成多少克隆?小默:有限稀释一般常用0.3-0.5 cell/孔的密度铺板,现在很多企业都有成像系统仪器,可以结合成像系统的图像去确定单克隆。MLabTM实验室常用0.5 cell/孔的密度进行有限稀释,不同的minipool会有不同的克隆形成率,平均一块96孔板会形成10-30个克隆。 小明:在CHOZN® GS-/- 平台minipool或克隆阶段,96孔板中的minipool或克隆为什么要传代然后再做7天静置培养,然后根据7天静置培养结果去筛选克隆?小默:在minipool或克隆阶段,96孔板中的minipool或克隆传代,可以平衡各个minipool或克隆的生长,如果孔板中的细胞较少,可以传代时多保留一些细胞。这样就相当于在细胞接种密度相对平衡的条件下,进行7天静置培养,以此来评估产量,然后再根据产量去筛选,这样筛选更加合理。 小明:在我们挑选克隆时产物质量是否重要?是否有必要重视乳酸产生及糖耗情况,便于后续细胞放大培养?小默:细胞克隆筛选前期通量较大时,我们可以不用将考察的因素放那么广,前期应以产量和质量为主,类似药以质量为主。在克隆筛选后期,多个克隆进入备选,并且通过稳定性的测试以后,我们会进一步考察生长和代谢相关的指标,比如乳酸产生、耗糖量及Qp等,一般考察备选克隆的这些因素时会在小试生物反应器中进行。 关于克隆成像小明:在我们进行有限稀释后是否可以离心拍照?单克隆成像仪拍照的细胞飘移现象怎么解决?如果成像图片背景不太干净,是否会影响药物IND申报?小默:有限稀释后,如果时间允许,考虑静置2-3小时再成像拍照,如果时间不充裕,可以离心后成像拍照,注意要清洁一下离心机的孔板架,防止灰尘等吸附至孔板底部,影响成像图片质量。单克隆成像仪拍照的细胞飘移现象是行业内普遍关注的问题。时间允许我们建议在单克隆铺板之后静置4小时之后放入仪器中进行拍照,这个时间足够细胞沉到孔板的底部,这样细胞不易产生移动。当然,即便这样操作可能还会出现这样的问题,那我们尽可能选择近距离的缓慢移动。进行候选克隆筛选时,尽可能选择没有争议,溯源清晰的克隆,假如恰巧候选克隆成像图片背景不太干净,可以将杂质标记出来做好说明,证据一定要充分。 关于培养基小明:使用CHOZN® GS-/-细胞时从EX-CELL® CD CHO Fusion转换到EX-CELL® Advanced CHO Fed-batch Medium中,需要很长的适应时间吗?细胞生长怎么样?小默:这个问题可以从两个细胞阶段性的实验来解释,一个是培养基转变进行Fed-batch去评价产量,这个过程是不需要额外进行培养基驯化,可以直接转换去评估;另一个是培养基转变进行细胞传代,从MLabTM实验室的数据看,一般都不需要很长的适应过程,有的细胞转换培养基细胞生长并不受影响,有的细胞转换培养基后,与EX-CELL® CD CHO Fusion传代细胞相比,细胞生长稍慢一些,但传代2-3次后细胞生长就恢复正常了。 关于稳定性小明:CHOZN® GS-/-平台筛选出来的细胞株稳定性怎么样?一般稳定性研究会做到PDL多少?小默:默克美国研发实验做的稳定性结果显示,10个候选克隆连续传代10周,PDL大约为65,8个候选克隆最终的产量与最初的产量相比,产量维持在75%以上,其中稳定的克隆中有5个最终产量与最初产量相比,产量维持在90%以上。现在一般稳定性研究会做到PDL60,但是最合适的方法是根据项目实际工艺需求,推算出应该进行至PDL多少。如果PDL60能够满足项目最终商业化生产的要求,稳定性研究做到PDL60即可;如果PDL60不能够满足项目最终商业化生产的要求,稳定性研究就需要做到更高的PDL。 关于工艺 小明:14天Fed-batch培养,除了使用说明书上推荐的培养基和Feed,你们会尝试其他的培养基和Feed组合吗?小默:在minipool和克隆筛选阶段,14天Fed-batch选择说明书上推荐的EX-CELL® Advanced CHO Fed-batch Medium和EX-CELL® Advanced CHO Feed 1即可。待筛选到合适的候选minipool或克隆,会尝试不同的培养基和Feed进行一些早期的工艺开发,例如浓缩和混合等优化补料方案。 详细策略及案例可参考,点击下方链接快速提升蛋白产量策略与案例详解 关于建库小明:宿主细胞是否需要在GMP条件下建二级或三级库?小默:从目前的法规,并未明确宿主细胞一定要在GMP条件下建二级或三级库,但是细胞出入库记录必须完整准确。如果有GMP条件可以建二级或三级库,推荐建二级或三级库。 CHOZN® GS-/-自推向市场已来,已覆盖全球超100+企业,目前以CHOZN® GS-/-作为宿主细胞的30+项目已经在全球多个国家推进到临床实验和商业化生产阶段。众多的参考案例进一步避免了企业在国内外申报进程中的挑战。本地化支持助力工艺供应双升级CHOZN®细胞平台通过上海的MLabTM为企业提供售前培训、技术支持等一系列本地化服务,让企业不再为售后问题发愁;同时, CHOZN® GS-/-平台的培养基已通过南通工厂实现本地化供应,为企业提供稳定的货源、更短的货期,致力于为企业提供最优质的产品和服务,为企业的生产工艺保驾护航。
参数原理
2022.04.05
默克完成收购生物制药CDMO公司Exelead,并计划投资逾5亿欧元提升技术能力
默克完成收购生物制药CDMO公司Exelead,并计划投资逾5亿欧元提升技术能力 · 默克计划未来十年持续投资提升Exelead实力· 继新成立生命科学CDMO(合同开发和制造组织)事业部后,该收购将助力默克进一步布局其生物制药全球多模式的CDMO能力· 默克可为客户提供mRNA全产业链一体化端到端服务 2022年2月23日,德国达姆施塔特 - 全球领先科技公司默克今日宣布,其已在获得监管机构批准并满足其他惯例成交条件的前提下,以约7.8亿美元(近50亿人民币)现金完成收购Exelead公司。此后,默克的生命科学业务将能为客户提供mRNA(信使核糖核酸)全产业链一体化端到端CDMO(合同开发和制造组织)服务。与此同时,默克计划于未来十年持续投资逾5亿欧元(约35.6亿人民币),进一步提升Exelead技术能力。 默克执行董事会成员、默克生命科学首席执行官Matthias Heinzel表示:“获得Exelead公司领先技术和专业团队的加持,使此次收购成为默克历史上又一重要的里程碑式事件;默克将有能力成为全球mRNA疫苗和治疗领域领先的CDMO重要参与者,提供从临床前研究到商业化落地的mRNA全产业链一体化CDMO服务。除Covid-19治疗外,mRNA技术亦在其他相关领域具备广阔前景,我们将进一步投资该技术,深挖其无限潜力。”Exelead系一家生物制药 CDMO企业,专注于研发聚乙二醇化(PEGylated)产品和高端复杂的可注射制剂,包括基于脂质纳米颗粒(LNP)的药物递送技术。这项技术是用于开发Covid-19和其他诸多适应症mRNA疫苗及药物的关键。从LNP制剂临床前开发到商业合同制造(包括填充和完成)的所有开发阶段,Exelead均具备丰富经验。此次收购Exelead将进一步夯实默克脂质生产(其已于该领域深耕20余年)和mRNA制造能力(默克因2020年宣布收购AmpTec获得该能力)。默克一体化端到端产品和服务将助力客户加速简化供应链复杂性,提升其药品的上市速度,更高效地为患者提供能够挽救生命的疫苗产品和治疗方案。 过去两年,默克生命科学业务通过收购、扩张,持续投资推进传统和创新制药的开发——如单克隆抗体(mAb)、抗体偶联物(ADC)、高性能原料药(HP-API)、病毒载体和mRNA的研发。此次收购Exelead,是默克通过针对性地收购颇具影响力的中小型企业,加速默克工艺解决方案和生命科学业务创新的又一里程碑式见证(工艺解决方案为默克“三大重要增长动能”之一)。
新品
2022.04.05
Sorry, We’re Closed! Mobius® TF2S密闭切向流系统全新上市
Mobius® TF2S密闭切向流系统全称:配备密闭TFF Smart Flexware® 组件的Mobius® FlexReady TFF 系统,这是一种灵活的自动化,一次性使用的超滤系统,有功能性密闭和完全密闭两种应用模式,最高流速20L/min,适配最大面积为5㎡的平板Pellicon 2 and 3 超滤膜包(功能性密闭),Pellicon Capsule 囊式超滤膜包1.5㎡(完全密闭)。可应用于临床阶段和大规模分离和纯化mAb,疫苗,血液制品,病毒载体,重组蛋白。 生物工艺过程中,预防污染比过程检测和清除更为有效。密闭工艺是一种强大的生产方式,ISPE Sterile Product Manufacturing Facilities 将密闭工艺定义为:一个工艺步骤(或系统)中,产品和产品接触的表面不直接暴露于生产环境中。密闭工艺通过提供与环境中存在的潜在污染因素的必要隔离,来防止污染,同时减少或消除对环境控制的依赖。应用密闭工艺,终端用户能够减少生产区域洁净区划分和更衣要求,如简化生产区域的平面设计、减少占地面积和实施模块化设施设计,同时保持最高质量标准。 随着药物生产的蓬勃发展,ADC药物,病毒,疫苗及细胞治等产品对于环境控制有着比较高的要求,密闭闭工艺会是这些产品分离和纯化的理想选择。在《药品生产质量管理规范-细胞治疗产品附录》(征求意见稿)的第十一条【密闭系统】中也同样提到,对于细胞治疗产品,宜采用密闭系统或设备进行细胞产品的生产操作;密闭系统或设备放置环境的洁净度级别可适当降低。 Mobius® TF2S密闭超滤切向流系统,在原有开放式TF2S超滤切向流系统的基础上创新而成的全新系统(以下下简称为TF2S 密闭系统),延续了创新性一次性流路的设计,使用了CPC® AseptiQuik® 无菌连接器,可与 Pellicon® 2/3 板式超滤膜包或 Pellicon® 囊式超滤膜包配套使用来实现系统的功能性密闭和完全密闭。 系统的特点: 灵活性 — 标准硬件平台支持多产品和多规模生产,最大程度地提高投资的灵活性。100% 一次性流道 — Smart Flexware® 一次性组件易于使用、可以提供稳定可靠的重现性、消除前一批次的残留物。密闭式操作模式 — 使用专门设计的流路和设备,可以降低污染风险,同时提高灵活性和效率。全自动化 — 使您能够轻松且始终如一地生产临床和临床前规模的高价值药物。用户友好 — 该系统与Merck 的其他系统共享通用设备要素,例如软件、设计和维护组件,方便跨生产规模和验证程序的培训与验证。支持业界行业领先超滤装置 — 包括Pellicon® 超滤膜包和Capsule 囊式超滤膜包。 密闭系统的P&ID设计带有无菌连接器的一次性镶嵌式流道 • 与传统的一次性系统比较,减少了接头数量,从而降低了完整性破坏的风险• 回流和透过端集成NovaSeptum® 取样组件,实现生产中密闭无菌取样• 主要流道在制造过程中都经过100% 完整性检测,保证了可靠稳定的性能 • 减少死角,最大限度地提高产品纯度、产品回收率和渗滤效率 • 与Pellicon® Capsule囊式超滤膜包配套使用时,封闭式操作模式可降低污染风险,同时提高生产效率和灵活性系统采用CCP®软件控制平台 CCP®软件为默克通用全自动软件管路平台,使您在过程的每个步骤都具有熟悉的界面,并减少了对操作员的培训时间。该软件专为cGMP设施而设计,符合针对自动化软件的GAMP®5的要求,并符合FDA准则21 CFR Part 11对电子记录和签名的要求。适配不同形式的超滤膜包 Pellicon® 超滤膜包:设备最大可以兼容5㎡的平板式超滤膜包。这些先进、高性能的膜包非常适合用于高滴度治疗性抗体,以及需要更高操作压力、温度和腐蚀性清洁方案的更苛刻的过滤过程。Pellicon® Capsules 囊式超滤膜包:设备最大可以兼容1.5㎡的囊式超滤膜包,该囊式超滤膜包采用自密封设计,无需夹具,可实现快速灵活的产品转换。膜包经过伽马预灭菌,提供自带无菌连接器的配置,囊式膜包可在几分钟内连接入密闭工艺中使用。
新品
2022.04.05
好景有时,相逢不迟——疫情影响下默克工艺解决方案致客户的一封信
Valued Customer,尊敬的客户,Merck has always prided itself on the high levels of service we bring to our customers in our drive to help your success. We have many employees, from Account Managers to Tech Service, Customer Service, Field Service and other supporting functions, always ready to help respond to your questions and solve your problems.一直以来,默克致力于为客户提供高质量的服务,帮助客户取得成功。我们的团队,从客户经理、技术服务、客户服务到现场维修服务以及相关职能部门,随时待命回应您的需求,尽我们所能解决您的问题。With the recent increase in COVID cases across the country, we welcome the rapid action to control the outbreak. The requirement to isolate and test so many people does lead to some disruptions in our ability to move our people and goods around the country, however. As well as this, we are also experiencing an increase in our employees involved in some type of lockdown.随着近日全国新冠确诊病例增加,我们积极配合响应疫情控制行动。然而,疫情反复使我们在全国各地人员和货物的调配受到部分影响,部分地区因配合疫情控制而暂时进行封闭式隔离的员工数量也有所增加。This means we expect our face-to-face services (Field Service, Account Manager visits, Scientist on-site trials, etc.) will be hit by disruption. Even whilst we have teams across the country, we are still experiencing restrictions that, in some cases, do not allow us to visit your sites. Our services that are provided to you via telephone, WeChat etc, are unaffected at this time, although a slight disruption in from “working from home” might occur.这意味着我们的线下服务,如现场维修服务、客户经理拜访、科学家现场试验等,将受到一定限制。虽然我们在全国各地部署专业的团队,但在某些限制下,我们无法提供现场服务。为应对这些挑战,我们将通过电话、微信等方式尽一切所能确保为您提供及时的服务和响应。“在线工作”对您工作可能带来的不便,敬请谅解。We have set up teams to minimize this disruption and ask for your flexibility in the modes of communication we will use – virtual meetings/virtual visits etc.我们已迅速成立专门的工作小组,尽可能减少给您带来的不便。此外,我们将使用更灵活的沟通方式(如线上会议、云拜访等形式)为您服务,并感谢您的配合。We are able, at this time, to maintain the flow of goods to your sites, as our national network of warehouses and logistics are not currently affected. We do know that some cities are restricting the inward flow of goods, however. This situation is very dynamic and unpredictable; be assured we have teams working on this, constantly, to ensure your deliveries are not affected.目前,我们全国仓库和物流网络目前仍正常运营。但是我们也了解到一些城市的物流运输受到了一些限制,这种情况是非常动态和不可预测的。请您放心,我们有专业团队正竭尽全力工作,以期将货品顺利交付至您的手中。RegardsIan CarmichaelVP & Head of BioProcessing, ChinaLife Science business of Merck麦轩恺默克生命科学中国生物工艺副总裁
企业动态
2022.03.31
细胞株GMP建库及检测法规解读
细胞株GMP建库及检测法规解读!ICH指导原则国际人用药品技术要求协调委员会( ICH ) 将监管机构和制药行业聚集在一起讨论药品开发,注册科学和技术,旨在简化流程与组织结构,以加速医药开发管制流程,缩短病患采用新医药所需要的时间。2017年ICH会议通过了中国国家食品药品监督管理总局的申请,总局成为国际人用药品注册技术协调会正式成员。目前,ICH指导原则已成为国际通用的指导原则。ICH指导原则分为四类,Q:质量指导原则;S : 安全性指导原则;E : 有效性指导原则;M : 多学科指导原则,其中章节对细胞库的质量有如下规定:一、细胞基质的来源、历史和产生为确保制品的质量和安全性,需提供一份支持性文件,记载生产生物技术产品及生物制品的细胞基质的历史,还应记载它们母细胞系的历史,以便将细胞基质在研究和开发阶段所发生的事件与生产制品所用的特定细胞基质相联系来全面评估其风险。1、细胞的起源、来源和历史应说明所用细胞基质的细胞来源(实验室制备或来源于菌种库),引证科学文献上的相关参考资料。直接从实验室获得的资料是首选的,如果没有这些资料,也可以利用文献。对于动物来源细胞系,应提供物种、品系、饲养条件、组织或器官的起源、地理位置、年龄和性别、致病因子的检查结果以及原供体的一般生理状况。应记录细胞的培养历史,包括最初分离细胞的方法、细胞体外培养的方法以及建立细胞系的方法(例如,任何物理、化学或生物学的方法,或附加的核苷酸序列)。还应提供所有对基因操作和筛选的描述、细胞内源性和外源性因子的鉴别、特性和检测结果等资料。关于细胞基质的产生,应提供详细的制备过程中接触的外源因子。应提供培养基的组分,特别是提供关于人或动物来源的物质,如血清、酶、水解产物或其他活细胞方面的资料。提供的资料还应包括来源、制备和质控方法、检测结果和质量保证。还应提供有关上述方面的文献。这些资料将用于分析外源因子来源的可能途径,并作为制品风险评估的一部分。二、细胞库用连续传代培养的细胞生产生物技术产品及生物制品的最大优点是每批产品都有一个经检定过的共同起源。二级细胞库即主细胞库(MCB)和工作细胞库(WCB)。WCB来源于一支或多支MCB。WCB是直接用于生产的细胞。生产商有责任对每个细胞库进行检验,以确保其质量。§ 生产商应说明所用建库系统的类型、细胞库的大小、所用的容器(瓶子、安顿或其他合适的器皿)和密闭系统,用于制备细胞库的方法包括所用的冻存剂、培养基以及细胞保存和贮藏的条件。§ 生产商应阐明避免微生物污染和避免被实验室中其他类型细胞交叉污染的方法,还应介绍可追踪细胞库容器的方法,包括记录系统,以及能经受保存、贮藏和从贮藏中复苏时容器的标签不会丢失。§ 生产商应说明细胞建库的过程,应保证细胞库的均一性,还应使细胞保持一定的生存能力,来满足生产及产品一致性的要求。三、细胞库鉴定和检测细胞库检测包括以下内容:1、鉴别试验应采用合适的试验证明建库的细胞就是它本身。鉴别试验可利用细胞的表型或遗传型特征,但不必作所有的试验。通常对MCB作鉴别试验。对于人或动物细胞,可采用形态学分析与其他试验相结合的方法。在大多数情况下,同工酶分析足以确证人或动物细胞库的种属来源;依据细胞系的历史情况,可采用其他合适的试验。用染色体条带分析或种属特异性抗血清的方法可以用于鉴定种族来源,或者用染色体细胞遗传学来检测独特的标记染色体,或用DNA分析来检测基因组多态性(例如STR)。2、纯度检测评估MCB和WCB的生物学纯度,即游离的外源微生物和外源细胞污染,是细胞开发和建库的关键部分。在设计和进行这些试验时,应考虑选择性试剂和抗生素对检测外源微生物污染的影响,主要检测细菌、真菌、支原体的存在。对于细胞基质中可能污染病毒的检测,应根据细胞系的培养史,通过筛选和相关的特异性试验,选用可检测广谱病毒的方法。申请人应就病毒安全性问题参考ICH指南:3、细胞基质的稳定性细胞鉴定的另一个目的是考察细胞在生产中的适用性。细胞基质稳定性主要应考虑两个方面进行,即生产产品的一致性和贮存在规定条件下的细胞能否维持其生产能力。评估培养期间的稳定性,至少应考察两个时间点。一个时间点是采用最少传代数的细胞,另一个时间点是申请上市的生产中达到或超过细胞体外传代限度的细胞。细胞基质稳定性的验证通常在每个产品上市申请时进行一次。4、细胞核学和致瘤性试验根据细胞类型、产品的性质以及生产工艺,决定是否有必要采用胞核学和致瘤性试验来评价二倍体细胞系的安全性或鉴定一个新的细胞系。采用广泛的分析方法测定非整倍染色体细胞的相对丰度未必有用。啮齿类动物细胞系或已知为非二倍体的新细胞系不需要作细胞核学测定,因细胞遗传学分析足以评估细胞基质的特性或纯度。对文献已记载具有致瘤性的细胞不需重复进行致瘤性试验。面对法规对于文件全面性的严格要求,选择细胞株供应商就变得格外重要,一个能提供全面文件系统的供应商可以帮助企业更加快速的上市实现商业化。2005年默克(SAFC)从ECACC获得一株CHO-K1,随后对该细胞进行无血清悬浮驯化并建库,2009年采用ZFN技术对CHO-K1进行GS双等位基因敲除,通过多轮高通量筛选,经过基因型、表型、无菌和病毒检测,最终获得单克隆宿主细胞,于2011年进行GMP建库,并正式命名为SAFC CHOZN® GS-/-。CHOZN® GS配套全面的申报文件系统。提供细胞株来源和传代数据,所涉及的试剂物料信息,细胞库鉴定报告。CHOZN® GS申报文件CHOZN® GS自推向市场已来,已覆盖全球超100+企业,目前以CHOZN® GS做为宿主细胞的30+项目已经在全球多个国家推进到临床实验和商业化生产阶段。众多的参考案例进一步避免了企业在国内外申报进程中的挑战。
应用实例
2022.03.31
如何选择过滤器应对生物负荷挑战?看这篇就够了!
应用实例
2022.01.14
默克收购拉曼企业,拓展生命科学产品线
近日,默克公司宣布收购法国的生物过程分析公司:Resolution Spectra Systems,拓展了其生命科学产品的产品线。Resolution Spectra Systems主要经营药品生产质量管理规范的拉曼光谱产品和软件。目前收购细节尚未披露。默克生命科学部门主管安德鲁·布尔平(Andrew Bulpin)表示:"此次收购进一步推进了我们提供强化、互联生命科学产品的计划。拉曼检测仪器、以及分析和管理数据的软件,使我们能够提供更多独特和系统的解决方案,帮助客户优化其生物研究过程。Resolution Spectra System专注于基于拉曼技术的生物处理监控传感器,该技术可对生物样品提供实时监控和过程控制,并分析诸多生物参数,包括葡萄糖、乳酸、活性细胞密度以及其他相关杂质,使用单个探头便可同时监控所有参数。此次收购也是进一步支持了默克最近推出的Bio4C™ 软件套件,这个软件类似生态系统,集过程控制、分析和工厂级自动化于一体,是默克扩展BioContinuum™ 平台的最新组件,它将强化工艺和数字技术的融合,从而提高工艺速度、产品质量及生产灵活性,同时降低生产成本。拉曼技术传感器和软件的加入,补充了 Bio4C™ 软件套件的"收集"数据的维度,此次收购后,默克将能够提供独特和系统的生命科学解决方案。
媒体关注
2020.07.06
补料优化降低抗体生产过程中宿主细胞蛋白残留的研究
补料优化降低抗体生产过程中宿主细胞蛋白残留的研究CHO细胞被广泛应用于重组医疗蛋白的生产,在其培养过程中,细胞分泌或释放一系列的宿主细胞蛋白(Host Cell Protein,HCP)。HCP是抗体生产过程中主要的杂质之一,它可能会诱发受体的免疫响应,产生抗药抗体(Anti-drug Antibody),从而影响药效;同时,部分蛋白酶和二硫还原酶催化降解产品,对其质量及稳定性产生负面影响。 面临的挑战:目前单克隆抗体生产工艺中,下游的亲和层析以及阴离子层析是去除HCP的主要工艺步骤;然而,HCP中的某些成分会与产品本身发生相互作用,导致其无法通过纯化去除并保留至最终产品中,同时,越来越高的HCP残留水平也给下游纯化工艺不断提出更高的挑战。 解决方案:目前已经有研究从基因序列、细胞系、细胞活率以及培养周期等角度对上游收获料液中HCP水平进行探讨,但总体上,文献报道仍然较少。在本研究中,通过在小试反应器工艺开发过程中的对比研究考察了两种不同的商品化补料对于上游反应器生产过程中细胞生长、代谢、蛋白表达和收获液中HCP水平的影响;并通过补料体积优化以及金属离子添加,尝试进一步降低HCP水平。 结果:下图为4个3L反应器中的表达量和HCP的结果。4个条件下的表达量差异较小,但使用补料II的2个条件(B2和B4)中HCP水平明显低于使用补料I的2个条件(B1和B3)。(注:补料I为商品化补料培养基,包含两种成分;补料II为默克的Cellvento® 4Feed。)默克上海BioReliance® E2E生物工艺开发中心恢复全面运营 默克上海E2E生物工艺开发中心为全球客户与合作伙伴提供细胞株开发、工艺开发以及GMP临床样品生产服务。该中心计划在2020年完成产能扩建,提供2,000L的GMP临床样品生产服务。上海的E2E生物工艺开发中心是默克全球生物工艺开发中心网络的一部分,其他两个基地分别位于法国马蒂拉克和马萨诸塞州波士顿。 默克的BioReliance® E2E解决方案提供最高质量水平的生物制药工艺开发和生产服务,其团队成员拥有30多年的工艺开发经验,已开发了超过260多种生物大分子项目。 为应对新冠疫情,默克采取了积极措施,确保员工安全和满足客户需求,并确保按时完成项目。默克BioReliance® E2E生物工艺开发亚太区总监陶菊红女士阐述了她的团队是如何积极应对和采取预防措施,在保证员工安全情况下,保持业务持续性的。 Q: 默克上海生物工艺开发中心是否已恢复全面运营? A: 是的,已投入全面运营,我们正在进行多个全球客户有关治疗药物开发的新项目。为确保项目能够按时完成,我们密切关注全球供应的进展,并尽量通过默克产品的供应来确保供应的持续性。例如,如果客户与我们商谈细胞株开发项目,我们可选择默克自有的CHOZN®细胞株立即启动项目。在该情况下,我们的供应链可独立于其他供应商。 Q: 为确保生物开发中心在特殊时期能够保持运营,你们采取了什么措施? A: 保持公开和密切的沟通至关重要。从新冠病毒疫情爆发的早期阶段开始,我们预计到将对正在开展的项目造成潜在影响,并通过虚拟会议主动告知客户。与此同时,我们照常举行相关会议,通过电邮进行及时沟通。 在之前的特殊时期,我们设法安排有限的现场人员来维持与细胞培养和生物反应器相关的基本业务运营。我们的科学家们前往实验室参加重要的项目和实验,团队的其他成员则在家中工作。在进入中心前,员工将测量体温并必须佩戴口罩。 为支持当前项目及新项目的正常进行,我们组成了一支由多个职能部门组成的团队,其中包括来自法规管理、采购、进出口和海关服务各个部门的支持,确保客户的物料(如:细胞)安全、及时地运抵。 我们具有稳健的质量体系,我们的质量团队将一如既往地检查和审查项目数据,确保可追溯性和数据完整性。 Q: 您认为在这个特殊阶段取得成功的关键因素是什么? A: 在我们所采取的措施中,以下两方面对于项目的持续进行以及恢复全面服务至关重要:●主动与员工和客户沟通相关决策;●确保员工的健康和安全是我们的首要任务。我们每日监控团队成员及其家庭的健康状况。对于在什么条件下可恢复全面运营,所获得的报告和图表为我们提供了重要的信息。这种关注为我们所做出的决定以及恢复全面服务的时机提供了有利的指导。 新冠疫情无疑为全球带来了前所未有的挑战。作为全球领先的科技公司,我们将持续积极地推动患者所需的新药开发和推广,默克上海BioReliance®端到端生物工艺开发中心将继续与客户和合作伙伴一起共同战役,包括大流行病的治疗方法的开发,一如既往地为生物制药行业提供协助。
厂商
2020.06.03
Bio4C™ ProcessPad软件
上周我们介绍了为什么生物工艺离不开软件分析与自动化,并介绍了Bio4C™ 自动化管理平台。今天,我们荣幸地为您介绍Bio4C™ ProcessPad 软件。轻松地获取、整合和分析生物工艺数据 生产能进行高效运行的最大促进因素之一是充分利用工艺执行数据。在生产中,为了避免偏差,需要对分散的工艺和产品数据进行复杂、耗时的收集整理和分析,这些都会影响高效生产的能力。 Bio4C™ ProcessPad是一个数据可视化、工艺监控和分析的平台,它支持生物工艺生命周期管理、报告、调查和持续工艺验证(CPV)。 它将来自不同来源的工艺数据智能地组合到一个经验证的单一数据源中,确保数据在整个产品生命周期中是最新的、完整的和相关的。ProcessPad可以收集整合各种数据来源:手动数据、设备数据、历史数据、外部数据(如QMS,MES, LIMS),并进行实时监测,生成报告。主要特点:l 基于浏览器的直观界面l 自动将数据聚合成分析好的格式l 收集和管理来自不同来源的不同格式的数据l 专为适用于生物工艺分析的数据可视化和分析工具l 轻松生成报告l 符合GMP和21 CFR第11部分的合规性l 在整个产品生命周期中,充分整合研发数据,进行高效的技术转移l 全球各地团队、CMO和供应商都可以访问数据、分析和可视化图表l 通过工艺分析工具、权限和端到端的数据管理, 实现持续的工艺验证 为客户提供的价值:l 节省人力和时间——更快的批次审查/报告l 据BPOG的示例估计,基于多站点的自动化数据管理系统的持续工艺验证(CPV)工作的成本节约为每年12.5万美元l 工程师和科学家将80%的时间用于搜寻、收集和格式化工艺数据,只将20%的时间用于分析。有了Bio4C™ ProcessPad,科学家和工程师可以将80%以上的时间用于数据分析和可视化图表,从而获得对改进产品和工艺的提供意见l 加快被调查的批次的处理、放行l 更好的合规性——及时关闭偏差、CAPA、变更控制、改进报告l 从工艺开发到生产规模的扩大,更方便的进行技术转移l 即时可用的数据可视化和分析工具,意味着用户不需要成为数据专家就可以理解、研究、分析数据
厂商
2020.06.03
《药品记录与数据管理规范(征求意见稿)》 | 第四版与第三版的对比
国家药监局在2020年02月25号发布了《药品记录与数据管理规范(征求意见稿)》,这是关于数据管理规范的第四版的征求意见稿。全文分六个章节,共29个条款,整篇规范的文章结构如下(见图1):相对第三版征求意见稿《药品数据管理规范(征求意见稿)》,第四版征求意见稿改动很大。 一、从文章的结构方面 《药品记录与数据管理规范(征求意见稿)》(图二) 的主体内容是第二章到第五章:记录与数据管理基本原则、纸质记录管理要求、电子记录管理要求和数据管理要求。 整篇文章围绕者记录与数据展开,就篇幅而言,在小编看来是偏重于记录的管理。《药品数据管理规范(征求意见稿)》(图三)的主体内容也是第二章到第五章,分别是质量管理、人员、数据基本要求和系统。 整篇文章从对企业管理体系的要求,人员的要求(包括管理层),数据的基本要求和系统的要求(包括产生纸质记录和电子数据的系统要求),文章的重点偏重于数据的基本要求,围绕ALCOA原则展开具体的要求。二、从文章的内容方面 就范围而言,《药品记录与数据管理规范(征求意见稿)》说的是“药品研制、生产、经营和使用活动中产生的依法需要向药品监督管理部门提供的记录与数据”;《药品数据管理规范(征求意见稿)》说的是“药品研发、生产、流通、上市后监测与评价等产品生命周期中全部活动的数据管理”。 《药品记录与数据管理规范(征求意见稿)》中的第二章节和第三章节中与记录有关的内容都是新加的内容。第三章纸质记录管理中的内容是可以参考《药品生产质量管理规范》中第八章节文件管理。 《药品记录与数据管理规范(征求意见稿)》中相对于第三版,基本删除了对于风险管理和管理层责任的要求。 《药品记录与数据管理规范(征求意见稿)》的第四章电子记录管理要求(图三),其内容和《药品数据管理规范(征求意见稿)》中的第五章系统(图四)的内容相似,但是没有提到审计追踪和数据安全。 《药品记录与数据管理规范(征求意见稿)》的第五章数据管理要求。只是对不同类型的数据的要求,没有像《药品数据管理规范(征求意见稿)》中第四章数据基本要求那样,从ALCOA原则的各个内容进行展开要求。
厂商
2020.05.26
Bio4C™自动化管理平台
为什么生物工艺需要软件分析与自动化? 对生物制药而言要达到更高效、更高产能、更好的产品质量,必须充分利用收集的过程工艺数据,并把这些数据转换成可以指导提高和优化工艺的措施。 为了最大化能收集和处理这些工艺数据,必须借助软件分析和自动化管理; 为了助力我们的客户实现未来的高度集成的,紧密联系的和连续流工艺的目标,在BioContinuum™平台下,我们推出了符合工业4.0要求的自动化和分析软件平台。 什么是Bio™ 4C 自动化管理平台? Bio4C™ 自动化管理平台,是专门为生物制药生产提供的软件解决方案,它提供整合的、开放的、数字化管理,并且符合法规的要求。同时它可以无缝的与其他软件控制兼容。 它涵盖了4个关键的C:Control, Connect, Collect,Collaborate,即:控制、通讯、收集、合作。 它让数据的传递和分析变得简单,使得生产可以借助数据的分析做出快速的响应,从而让生产过程乃至整个工厂被数字化、智能化管理。 它的直观的交换界面和权限管理,可以使在不同地理位置的管理者实现全球化的统一控制、监视和或分析设备、工艺过程、结果以及实时数据。 The Bio4C™ 软件平台包含了所有的自动化软件和分析产品 其中前三个即将上市的软件为: 1. COLLECT(收集):Bio4C™ ProcessPad软件–于2020年4月29号上市; 2. CONNECT(通讯):Bio4C™ Orchestrator工业软件管理平台–将于2020年第四季度上市; 3. CONTROL(控制):Bio4C™ Application Control Engine (ACE)(应用控制)软件–将于2021年上半年上市。 Bio4C™ 自动化管理平台加速您的数字化转变需求
厂商
2020.05.26
不负所托,全心为您,默克又添四个登记备案辅料
各位药企的研发,采购的同仁们,还在为寻找高品质小众辅料发愁么,还在为供应商资质的难题担忧么?默克药用原辅料不负所托,再次帮您安排的明明白白。 在半个多月的时间里,连续成功注册了四个产品: 苯甲酸苄酯:货号101806 备案号F20200000061甘氨酸(颗粒):货号103669 备案号F20200000036甘氨酸(晶体):货号100590 备案号F20200000037氯化钠:货号137017 备案号F20200000063 以上四个产品均已可向客户出具授权信。 其中,101806 苯甲酸苄酯,是广泛用于油性和非水性的,口服及注射制剂的防腐剂/抑菌剂,在酸性条件下效果最佳。 103669 甘氨酸(颗粒),作为蛋白质保护剂,缓冲剂广泛应用于高风险应用中,为解决甘氨酸晶体自结块的问题(固有性质,与环境湿度无关),进行了预制粒,确保使用过程中的便利。针对甘氨酸常用于高风险制剂或工艺,故控制其内毒素<2.0 IU/g,需氧菌总数(TAMC)≤10 CFU/g,霉菌/酵母菌总数(TYMC)≤10 CFU/g。 100590 甘氨酸(晶体)的指标与用途与甘氨酸颗粒,仅形态为晶体状,未作预制粒处理。 137017氯化钠作为辅料在制剂中使用时,可用作致孔剂、渗透剂、张度剂,广泛应用于固体/液体/半固体制剂中,为降低在高风险制剂或工艺中应用的风险,故控制其内毒素<2.5 IU/g,需氧菌总数(TAMC)≤10^2 CFU/g,霉菌/酵母菌总数(TYMC)≤10^2 CFU/g。 默克药用辅料登记备案动态更新 目前默克可以提供授权信(LOA)的药用辅料(截至2020年05月)下表为正在进行登记备案资料准备的默克药用辅料,同时还有更多药用辅料在申报计划中,如有其他药用辅料需要登记备案支持,可与默克员工联系。根据国家药监局2019年第56号文:《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》,以下是默克可以豁免登记备案的药用辅料清单(可豁免的品种包括但不限于附录3中提及的品种,只要是属于豁免类别即可)。默克药用原辅料产品:为您提供逾400种药用辅料,满足小分子与大分子药物在固体,半固体与液体制剂应用中的多种要求,主要产品涵盖了:药用级无机盐,药用级有机溶剂,低内毒素产品线,甘露醇系列产品,聚乙烯醇系列产品,山梨醇系列产品,PLA/PLGA系列产品,聚乙二醇系列产品,合成磷脂类产品等。同时提供包括叶酸类产品在内的一系列目录原料药,关键原料药中间体与高活性药物的定制合成服务,抗体偶联药物(ADC)的全工艺流程定制生产服务。 默克通过提供高品质的药用级物料,全面的应用技术与法规支持,及持续不懈地对医药行业的投入与关注,助力医药企业的快速研发与高效生产。
厂商
2020.05.25
默克BioReliance®检测服务应邀参加2020第三届中国精准医学与肿瘤免疫治疗峰会
继抗体免疫疗法的高速发展后,以CAR-T产品为代表的体内/体外基因治疗策略已经成为进5年来药物开发的新兴行业。据初步统计,全球已经有超过1000个细胞基因治疗的临床实验。这预示着新型的基因治疗疗法全面到来。然而在新兴产业进入全面产业化布局的过程中,仍然存在着诸多有待解决或提高的方面。其中,生产工艺中原材料,过程产品和终产品的合规化检测技术发展和灵活高效的测试需求是商业化放大中集中关注的热点。如何以高效,准确,合规的检测技术方式确保药物的安全有效,一直是默克BioReliance®检测服务持续努力的方向。 作为一家有着70多年历史的检测服务机构,默克BioReliance®检测服务始终以法规更新作为服务导向,具备符合EMA,FDA,ICH等不同法规要求的专业服务体系,向全球客户提供了包括生物安全性检测,细胞株建库鉴定,病毒清除验证,产品批放行测试,生物分析检测,产品表征测试等超过1000种经验证的检测服务。已为全球超过1000家生物制药和基因治疗客户提供过高质量的检测技术服务。为切合当下“整合产业科技,助力制药创新“的主题,默克BioReliance®检测服务应邀参加2020第三届中国精准医学与肿瘤免疫治疗峰会,和600多位与会嘉宾共话基因治疗产品质量检测考量的主题。会议中,王鑫博士代表默克BioReliance®检测服务向与会嘉宾介绍了基于基因治疗生产工艺所衍生的产品质量风险点以及合规化的检测技术方案。特别针对在CAR-T细胞治疗类产品中关于慢病毒可复制性(RCL)检测方面进行了重点阐述,作为中国境内少数能提供RCL测试的服务方,默克BioReliance®检测已经为多家中国客户提供过相关服务。新型的基因治疗类产品,通常依托核酸,病毒载体,细胞载体等具有生物活性的介质发挥其治疗作用。与传统意义上的药物相比,在安全性和质量放行方面有更为严格的要求。因此,FDA于2020年出正式出版了关于基因治疗类产品的CMC指导,我国2020版药典中也增加了人用基因治疗类产品总论。为积极响应全球不同法规体系的更新,默克BioReliance®检测服务以科学与法规的专业知识,全面的技术覆盖(理化,分子,细胞,动物等)为客户提供包括病毒库/菌种库/细胞库建库,细胞系鉴定,质粒/病毒过程产品检测,终产品批释放检测以及产品表征检测等合规化服务。并依托全球化的业务集群为产品,特别是生物治疗(抗体,基因治疗)产品的多地检测申报提供灵活便捷渠道。在此,我们诚挚期待与您携手,以专业的服务态度,共同加速新型基因治疗类产品的商业化进程。
厂商
2020.05.18
纯化工艺的原材料管理之层析填料的安全供货
如何保证供应商对于产品的安全供货,是制药企业越来越关注的问题,尤其是对已上市产品的原材料稳定供货至关重要。在2020年新冠肺炎爆发后,欧美疫情趋向严重的情况下,货物供应更提升到了第一优先级。 如何来保证安全供货呢?强有力的品牌是第一选择,大的品牌会投入更多的资金建立完善的供货体系,从而确保供货稳健性。 有着350年历史的默克公司,通过建立领先的稳健供货体系及管控策略,来确保层析填料的安全供货。 保持领先的稳健供货及控制策略 由于生产层析填料的工艺过程的验证时间长且成本高,通常由单一供应商提供。因此,供货安全对于我们的客户和默克而言是非常重要的。为了有效提高默克层析填料的供货的可靠性和保证持续稳定的产品质量,我们已经在实施稳健的控制策略,包括:?1 原料选择和表征统一质量控制和供应商管理 在选择填料基架和表面修饰物的过程中,默克确保同样的质量和数量,就如同和您工艺放大过程中对原材料的选择一样来进行:●工艺开发过程中的详细原材料表征;●在不同的填料生产基地,统一化管理原材料的质量和供应商。2 整合填料基架的生产控制关键物料的物流和质量 ▲基架的生产是层析填料生产的关键步骤生产Eshmuno® 和 ProSep®基架的工厂拥有先进的专用生产设施,并和Fractogel®基架及其他关键原料供应商建立了强有力的供应和质量协议,从而保障日益增加的层析填料需求,确保填料的批次一致性以及稳健的变更控制和预先通知我们的客户。3 全球多个生产基地以及全球化的统一标准确保不同生产基地的一致高质量标准 基于健全的全球化工业用填料质量体系,灵活的设备及几十年的生产经验,我们的制造工厂可生产多种填料。全球化工业用填料质量体系,通过应用工业/ ISO标准和实施标准的全球质量手册,确保了层析填料在全球各地执行同一个质量标准。 此外,每个生产基地都有一个生产持续性计划,通过采用多种策略,如增加原材料的安全库存,增加原材料第二供应商,以及及时增加产能来确保层析填料根据客户的需求稳健供货。与此同时,每个产地也有灾难恢复计划,记录潜在的风险,并提前设定灾难发生后所需采取的行动以加速产能恢复。4 产品和工艺表征确保批次间稳定性 原料和操作的一致性缺乏会对生产的填料性能产生很大的影响,从而导致使用过程中无法预料的变化。为了解决这一问题,我们利用丰富的工艺知识和生产经验,实现稳健的过程表征和控制方法学来确保批次一致性。5 稳健的工艺过程控制最小化由变化带来的影响 我们的目标是安全供货,批次间的一致性,并尽量减少各种变化对产品质量的影响。我们为您提供所需要的信息,以可比性研究的形式,在实施之前评估和接受这些变化。与此同时,我们也为您准备了变更后生产的填料样品以满足您进行对比测试的需求。6 Emprove® 文件体系层析填料的快速法规支持 我们正在扩大Emprove®体系,以帮助您满足最新的法规监管要求,风险评估,并加快通过监管审查的速度。
厂商
2020.05.14
默克与您携手抗疫——病毒疫苗收获液澄清与核酸去除工艺开发
在病毒疫苗的澄清工艺中,除了滤器的载量会作为重要的考察因素外,病毒回收率也十分重要。根据病毒的带电性和粒径特点,在病毒收获液的澄清中往往会选择低吸附的深层滤器,如默克Millistak+® CE系列深层滤器;或玻璃纤维/混合纤维素酯材料的表面滤器,如PolysepTM II。这样的滤器选择在保证澄清效果的同时也维持了很高的回收率。 下面让我们来看看COVID-19同源病毒或工艺相近的病毒澄清和核酸去除工艺的应用。 悬浮细胞Coronavirus疫苗病毒澄清工艺 Coronavirus为包膜病毒,粒径75-160nm。 选择深层过滤器Millistak+® CE50做为一级滤器,表面过滤器PolysepTM II 2.0/1.2um作为二级滤器进行澄清时,料液浊度可以从100NTU以内的初始值降低至20NTU以下。同时滤器的载量可以达到400L/m2以上,回收率>90%。 ?图1. Coronavirus 澄清过滤中CE50和PolysepTM II的载量与回收率 Millistak+® CE系列深层滤器的填充材料为纤维素,从23cm2到1.1m2规格,覆盖小试到大规模生产,简化您的澄清工艺。作为一款高颗粒物容纳,低残留体积的深层滤器,CE50的孔径约0.6-1um,适用于细胞密度、浊度较低的收获液澄清,对于病毒类产品,可以保证很高的回收率。而PolysepTM II表面滤器的材质为玻璃纤维/混合纤维素酯,兼具深层滤器的高颗粒物容纳特性和膜滤器的截留能力,同样具有低吸附的特点,常用的规格有2.0/1.2um、1.0/0.5um、1.0/0.2um等,可作为低浊度料液的澄清滤器,或者在培养基、中间产品等料液的除菌过滤步骤前用作保护性滤器。良好的可放大性,支持小试工艺开发到大规模生产应用。Vero细胞微载体悬浮培养条件下的病毒澄清工艺 在Vero细胞微载体悬浮培养的包膜病毒疫苗澄清工艺中,考虑到简化工艺步骤和优越的浊度控制,我们使用了具有较强吸附能力的深层滤器Millistak+® HC Pro C0SP,当高载量使用时(500L/m2以上),总回收率则达到90%,浊度20NTU以内。可见虽然C0SP吸附能力很强,但由于其同时具有高载量的特点,从而保证了较高的回收率。Millistak+® HC Pro系列深层滤器,用合成材质聚丙烯酸纤维和二氧化硅代替了传统的硅藻土和纤维素,在单抗和疫苗澄清中,载量通常是传统深层滤器的两倍以上。同时由于人工合成材质相比传统材质更为清洁,在工艺放大后,可以节省大量的冲洗用水,节约成本和时间。通常C0SP用于高密度细胞收获液的单级澄清。 腺病毒病毒澄清工艺 腺病毒病毒广泛应用于疫苗和基因治疗领域,在腺病毒的澄清工艺中,默克不同系列的深层滤器在高细胞密度和裂解细胞的情况下都能到达良好的澄清效果,并保持很高的回收率。下图是Millistak+® HC和Millistak+® HC Pro系列滤器在腺病毒澄清中的常规表现。在病毒疫苗工艺中,核酸残留是客户非常关心的质控指标。Benzonase®核酸内切酶不但可以对料液中的核酸进行高效切割,并且内切酶和切割后核酸碎片可以在下游工艺中的超滤步骤轻松除去,无残留风险。 Benzonase®核酸内切酶在病毒载体疫苗中的应用 对于Vero、CHO等细胞表达的疫苗类生物制品,残余DNA含量通常被限定为或10pg/剂。Benzonase®核酸内切酶可以在37°C条件下,迅速将料液中的核酸切割成3-8bp的片段,从而大幅降低工艺过程中的核酸残留,使得DNA残余量达到要求。这些切割后的片段和Bensonase®内切酶可以在下游的300kD超滤中轻松去除。试验数据表明,在经过8个CV的透析换液之后,残留的核酸片段和内切酶可以达到99.9%的去除率。 下图可见,经过4min反应后,Bensonase®内切酶对于核酸的切割效率。反应后琼脂糖凝胶电泳图 在病毒疫苗的澄清工艺中,根据不同的细胞培养方式、病毒类型、病毒原液收获模式,默克Millistak+® Pod深层滤器和PolysepTM II表面滤器都可以很好的满足工艺需求,并可实现从小试到生产线性放大。而非动物源Bensonase®核酸内切酶,能简单快速地降低工艺过程中核酸残留,为疫苗安全性提供了强有力的保障。
厂商
2020.05.14
生物安全精选 | 使用Millipak® Final Fill过滤器及吹扫步骤达到最大化产品收率
?Millipak® Final Fill过滤器的特殊层叠式设计可最大程度地减少残留体积,从而增加产品回收。过滤器吹扫亦可有效降低折叠膜和层叠式过滤器使用后的残留量。 Millipak® Final Fill层叠式过滤器和吹扫的组合可最大化终产品产出,对于高价值的注射剂产品生产带来可观的经济利益。 对于注射剂产品而言,在最终除菌过滤中最大限度地提高产品回收率是至关重要的,即使几毫升产品的损失都可能导致数万元的收入下降,降低工艺效率。 过滤膜的选择基于工艺料液的兼容性以及用户的独特需求,而过滤器的形式将直接影响产品回收率和工艺产量。在过滤后被保留在膜层间与过滤器连接处的液体,被称为残留体积,尽可能的减少最终产品过滤时的残留体积可以为生产过程带来可观的经济效益。 本次内容对比了Millipak® Final Fill层叠式过滤器的及普通折叠膜除菌级过滤器,在重力排空及气体吹扫的方式下残留体积的对比。 实验方法对一系列市售包含折叠膜的PES和PVDF除菌级囊式过滤器的残留体积进行对比。在重力排空或使用超出泡点20psi的压力吹扫1分钟后,将折叠膜囊式过滤器的残留体积与Millipak® Final Fill过滤器进行比较。在所有测试中,残留量是排干的过滤器与过滤器干重之间的重量差。 结果与讨论 吹扫的好处对于PES和PVDF折叠式过滤器,在所有过滤面积中,在高于膜泡点的压力下用空气吹扫过滤器可有效减少过滤器中的残留体积,与重力排干相比,液体回收率有着显著的提高。 在使用吹扫排空后,在相同的过滤面积下,Millipak® Final Fill过滤器的残留体积比折叠膜过滤器低得多。尽管在较大的过滤面积时这种差异更加明显,但即便是较小面积,折叠膜过滤器的残留体积也是Millipak® Final Fill过滤器的1.5-5倍。 这些结果说明了高压吹扫的好处,在恒定流量操作中也可以减少过滤器残留量。如果泵在过滤后可以保持空转运行,则过滤器上游的料液体积将最小化,从而减少残留量并提高回收率。 降低残留体积带来更高的收益尽管吹扫程序可以同时提高折叠膜和层叠式过滤器的产品回收率,但增加吹扫这一步骤对于Millipak® Final Fil层叠式过滤器具有更加深远的好处,尤其是在较大面积过滤器及高价值产品过滤时。随着产品价值的升高,最小化残留体积带来的经济收益越发明显。
厂商
2020.05.14
默克中国无锡Mobius®一次性技术产品生产基地开始投产
近年来,全球尤其是中国市场对生物制药的需求增长迅猛,注重改进制药生产工艺中的每个环节。为更好地为中国的生物制药和生物技术客户提供便捷的服务,加速其药物开发,默克中国无锡首个Mobius®一次性产品生产基地于2018年落成,历经一年半,我们完成了洁净区验证、工艺以及设备验证、运输验证、产品灭菌验证、SAP 系统、确认变更管理和员工培训等。目前无锡工厂已经开始接受客户审计,并已正式投产。在今年3月,无锡工厂已向中国第一个客户交付了货物。这一更新,我们将确保快速实现客户定制,大大缩短了订单到货时间,提供本土化的技术支持服务和快速响应:- 我们在全球范围内拥有的生产基地,无锡工厂进一步保证了中国供应链的稳定性。 - 将大大缩短和简化运输流程,更简单的运输流程将降低货物在运送中被损坏的风险,保证您收到高质量的产品。 - 服务于中国市场,大幅度缩短交货时间。麦轩恺 (Ian Carmichael)默克副总裁,工艺解决方案中国总经理默克副总裁,工艺解决方案中国总经理麦轩恺(Ian Carmichael) 博士表示:“保持供应链的稳定性是我们的主要目标之一。很高兴能够见证无锡工厂一次性产品生产基地的进度正按计划有条不紊地进行,目前无锡工厂已开始生产高质量Mobius®系列一次性组件。我们希望能够为中国客户在药品开发、中试及生产阶段提供高效、灵活的一次性解决方案,助力中国生物制药行业的腾飞。” 该生产基地位于无锡新吴区,由当地员工组成,依托于全球团队成熟的技术经验和协作模式,其核心是超过 1,400 平方米的一次性产品洁净生产车间,用于制造一次性产品的端口粘接、最终组装、完整性测试、检验和包装,与默克位于美国马塞诸塞州丹佛斯的一次性技术产品卓越中心生产基地采用同样的质量生产体系及标准。基地现有2条生产线,按照市场需求进行规模设计,能满足中国所有客户的订单需求,并可根据市场需求扩展覆盖到更多区域。同时,该基地所在的无锡生命科学中心也是默克生命科学亚太区的全球包装基地,拥有先进的生化试剂生产技术,产品销往德国、美国、日本、澳大利亚、新加坡、韩国和印度。如果您有任何问题,请联系我们当地销售同事。
厂商
2020.04.21
默克培养基样品KIT | 助力CHO细胞培养基快速筛选
为帮助用户实现CHO细胞培养基的高效筛选,默克为广大用户推出惊喜小神器:上游培养基试用装!更关键的是,试用装申请 免费!免费!免费!重要的事情说三遍。?本试用装内含5中表现优异的目录培养基和2中修饰化氨基酸,不仅如此,申请成功的用户还将获得默克上游工艺开发技术团队为您提供的全面技术支持。主要用于克隆筛选、扩增、传代及批次培养的EXCELL® CD CHO Fusion(24365C),可以实现由克隆筛选到批次培养的顺利过渡;主要用作Fed-batch培养中的基础培养基EX-CELL® Cellvento™ 4 CHO(1037950100)和经典的EX-CELL® Advanced CHO Fed-batch Medium(24366C),营养均衡,对于各种细胞系均具有良好的适应性。流加用培养基:适用于高浓度补料策略的EX-CELL® Cellvento™ 4 Feed(1037960050),可以减小补料体积,提升产量;经典的EX-CELL® Advanced CHO Feed 1(24368C),黄金营养比例达到快速的产量提升。修饰化氨基酸磷酸化酪氨酸二纳盐(1371191000)、磺基半胱氨酸钠盐(1371161000)。可直接高浓度溶解到流加培养基中,补料时不需要额外添加碱性氨基酸溶液,操作简单,对细胞培养环境的影响更小,优化使用比例后更可以提高目的蛋白产量。以上全部培养基均为CD(化学成分限定)培养基。所有基础培养基和流加培养基都不含有谷氨酰胺,可以根据细胞系的不同,在培养过程中适量添加。 除此之外,默克上游工艺开发技术团队将在您的整个培养基筛选过程中提供详尽的技术支持服务,包括培养基配制方法及注意事项、培养基筛选试验方案的沟通和制定、试验后的结果分析及进一步优化策略等。根据客户的试验条件和要求,我们可以提供模板化的8-11组筛选组合,一次性对试用装内基础培养基进行筛选,选择最优的一种或两种培养基进行流加培养基筛选。我们还将为您提供修饰化氨基酸等其他细胞添加物的使用方案,进一步提升目的蛋白产量和质量。
厂商
2020.04.08
上游工艺精选 | 高通量筛选平台(HTS)助力抗体药物开发
细胞株开发和培养基优化是生物药物的开发的第一步,工业界一直致力于寻找一个高效快速的解决方案,我们将分两期给大家介绍一下默克提供的解决方案。这一期将分享HTS技术。HTS全称为高通量筛选(High Throughput Screen ),这里要划一下重点:1)高通量,是指通过大量不同的培养基筛选,以实现筛选出一个高表达的培养基组合,简单说就是“大力出奇迹”。这时候小伙伴们要问:得筛多少培养基才最合适,答案是:“人有多大胆,地有多大产”。你只要有足够得勇气去筛选上百个培养基甚至更多,那么你最终实现细胞株的表达量一定是在一个较高的水平。如果你有朋友摇晃这几个小摇瓶,还怕污染,那你最好劝他还不如放弃。 2)大力一定出奇迹吗?真不一定,要看你的培养基库的多样性,这个才是制胜的法宝。目前世面上的培养基厂商很多,品牌也很多,相信各位的冰箱里面没少堆放,但是在测试的时候会发现,很多培养基的差异性是不大的,在默克的培养基进化树上可以称之为同一支。如下图,几十种培养基一分析,就4个种类。所以大家实验做的挺辛苦,但是结果却不好,要不表达量不高,要不表达高质量不好。下面还是卖瓜,默克的HTS平台具有以下几个特点:1)培养基多,可以从5(基础)*5(补料)扩展到384*384种,实在是筛选利器。这么多实验该这么开展呢,这就要借助默克的高通量平台中的设备了,欢迎大家来实验室参观讨论。在这就不安利给大家了。2)培养基种类多,默克的培养基库是通过科学设计的,把类似的配方合并,并且通过数据模型计算设计出各种不同的培养基原型,这样保证培养基的显著多样性。下图显示在spin tube基础培养基bath工艺和补料工艺的结果,两步实验就可以确定最佳组合。 如果这是一个新药分子,后面的直接做PD开发,轻松上5啊! 但是碰到的蛋白质质量问题,怎么办?继续优化。我们做培养基优化的时候,碰到最头疼的问题就是不知道培养基组分信息,也不知道哪个是关键组分,无从下手。默克的MVA平台就很好的解决了这个问题,在前面HTS的结果,直接通过计算机模型抓取出与质量相关的关键成分。对这些关键成分进行DoE实验,很快就能解决问题,如右图所示,对画红圈的几个组分进行DoE实验,事半功倍!
厂商
2020.04.01
惊喜翻倍!默克中国上游官网已上线,带你重启2020
你是否对以下场景感到似曾相识? 同事甲:Advance Fed-batch基础培养基超好用哦!我:Σ( ° △ °|||)︴网页上为啥搜不到? 主管乙:有个补料培养基不错,货号:1.03796.0005,你去试试看。我:Σ(っ °Д °;)っ 这个又是什么? 在纷繁的产品信息与技术资料面前,是否总觉得自己弱小可怜又无助?别担心,从今天开始,默克上游工艺解决方案移动端官方网站,正式上线!默克上游生态系统包括细胞系和培养基平台,细胞系开发,细胞系和产品表征服务,一次性生物反应器,工艺开发服务以及新一代工艺。 我们的专家将为您节省宝贵的时间,优化性能,提高可行性和可持续性,同时为下游成功奠定基础。 ??????撒花鼓掌???????全新默克上游产品移动端官网,页面大气,内容简洁,覆盖全面。 新概念的产品页面设计,基于使用习惯的内容排版,更有种类齐全的产品资料与技术文献,猛戳右下角,即可轻松下载阅读。有事无事翻一翻,也许,trouble shooting的答案,就在藏下一份文档中。更让人惊喜的是,上游官网收纳的热门文档均经过精心排版,内容完全适应手机屏幕大小,让你不再因迷你字体而崩溃,告别眯眯眼?(? ? ??)~( ̄▽ ̄~) 你品,你细品(~ ̄▽ ̄)~ 除此之外,官网未来将不定期更新上游最新资料,以及专业的培训教程视频,整合全网资料,让您对上游的需求,在这里一步到位。现在登陆官网,更有神秘惊喜大礼包免费申请! 还在等什么,扫描下方二维码进入默克上游工艺解决方案移动端官方网站,别忘了点击右上角收藏,方便下一次访问哦。
厂商
2020.03.27
设备工艺精选 | 利用缓冲液浓缩液和自动稀释系统
简介生物制药产业为应对市场压力(包括市场的迅速扩大,持续的不确定性,新的治疗方法和成本压力)而在不断发展演变。相应地,强化工艺和提高整个单元操作中的生产效率已成为重点,近期的关注点是设备生产效率的提高。其中一个提高设备生产效率的机会则是围绕缓冲液制备。传统的从干粉开始的缓冲液制备需要很多步骤,典型痛点包括:设施占地面积大,劳动力需求量大,繁琐的质量管理体系以及超过了供应产能后导致的失误。传统的缓冲液制备的替代方案包括即用型缓冲液,缓冲液混合与缓冲液稀释。其中用缓冲液稀释系统可以很好的解决这些痛点。 它通过缓冲浓缩液(高达50倍浓度)、缓冲稀释系统(用于制备高准确度和精密度的即用型溶液)和一次性组件的组合来解决整个产房的缓冲液供给。这种方式可以提高设备的灵活性,减少占地面积、劳动力和资金投入的需求。 为了证明缓冲液稀释系统,能配制出高精度的可以即时使用的缓冲液。这里我们进行了一系列的实验。 实验采用MERCK 缓冲液稀释系统(BDS 17) 进行此次分析。该稀释系统是基于体积流速控制的策略。 为什么是体积流速控制策略?因为相比pH 或是电导的探测,流量计和泵的精度更精确。具体原因如下:基于pH 控制策略的特点依赖于传感器的精度, ≥ 1%此外: 偏移记忆效应的影响需要经常校正基于电导的控制策略特点依赖于传感器精度, ≥ 1%此外: 需要经常校正 所以基于体积流速控制可以带来更好的准确性和精确度BDS17系统采用 Lewa Ecodos® Intellidrive® 专利泵技术体积流速精度偏差可以做到50:1的稀释比 所有的测试均通过系统的稀释顺序自动化执行。系统评估为了评估系统性能,测试了最大流速和最小流速,和即时流速。 对流速结果和不同的稀释倍数, 见如表1所示: 表1.被评估到的稀释倍数和流速 (? ), 系统可以做到的稀释倍数和流速,但该实验未评估(??) , 不推荐流速准确度的结果如表2所示。该结果表明,在14.8L/min的流速下,除50倍稀释外的所有条件下误差小于1%。表2. 稀释泵和浓缩泵不同的稀释比和流速浓缩液评估为了评估输出流速的准确度,用1M磷酸钠溶液,测试在不同的稀释比例中的表现。每个测试均测试了每个稀释比率下的最大流速和最小流速,50倍稀释仅评估最大流速(表3)。在表4列出的条件下,通过系统稀释1M磷酸钠溶液来同手动操作配制的溶液进行比较,以证明缓冲液稀释系统的准确度。当比较给定稀释比例内的最小和最大流速的结果时,pH和电导率是一致的,偏差小于0.1pH单位或0.5mS电导率。缓冲液生产为了评估稀释系统的性能是否能满足即时可用的解决方案,我们从浓缩液中制备6种工艺相关的缓冲液。被评估的缓冲液通常用于清洗、冲洗、洗脱和平衡等步骤,被评估的缓冲液具有范围宽广的电导率(1M至5M)和稀释倍率(3倍至40倍),且其配制的缓冲液在pH、电导率和摩尔浓度上各有不同,因此对系统的性能具有一定挑战。表5概述了用稀释系统和手动操作配置缓冲液的比较。该实验测试了,3倍稀释3M Tris,以配制pH8.4的1M Tris; 8倍稀释 0.8M的醋酸钠,4.0M氯化钠以配制0.1M醋酸钠,0.5M pH5.5的氯化钠溶液;以及用1.5M柠檬酸钠15倍稀释配制0.1M pH5.4柠檬酸钠溶液。两种制备方法的pH和电导率的对比结果表明,稀释系统运行结果和手动操作方法配制达到的稀释结果是一致的,两者仅有些许的偏离。该实验未控制温度,这可能是导致Tris缓冲液pH值细微偏移的原因。此外,该偏移也可能是制备方法导致。 此外这里评估了额外三种更高浓度的缓冲液,包括30倍稀释1.5M Tris醋酸盐 和1.5M氯化钠配制pH8 50mM的Tris醋酸盐溶液,2M柠檬酸40倍稀释至pH3.2的5mM柠檬酸溶液,和2M Tris 40倍稀释至pH8的50mM Tris溶液。缓冲液稀释系统稀释结果与手动操作稀释的比较如表6所示。同样,在含有Tris的溶液中观察到一些差异,这可能是缺乏温度补偿所致。在本次评估中,我们使用了较少的冲洗体积(5L)和最小运行体积(10L),在系统运行开始时增加冲洗体积和增加运行时间可能会提高系统稀释的准确度和精密度。总结通过利用体积流速的控制方式, 对缓冲液稀释系统进行的评估结果表明,其在不同流速和稀释比例下的高准确度。在使用1M磷酸钠浓缩液对缓冲液稀释系统进行测试中,表明了在不同流速和在特定稀释比例内,其pH和电导率表现出一致性。 通过研究以不同的流速和稀释倍数, 配制6种不同的工艺缓冲液,证明了用该稀释系统配制即用型缓冲液的准确性。 稀释好的溶液无需再进行额外的操作就可以直接使用。通过使用预先配好的缓冲液浓缩液和缓冲液稀释系统,可简化缓冲液制备。 利用体积流速控制的稀释系统, 可保证精准配制溶液的一致性和可靠性。基于我们工艺中对缓冲液体积要求,需要选择不同的流速的缓冲液稀释系统, 以便提供多种多样的流速和稀释能力,来满足工艺需要,同时最大限度地减少设施占地面积,并降低资本投资费用。 我们提供2种流速的系统:17 L/min 或33 L/min 可以满足大到2000L工艺缓冲液需求。 缓冲液稀释系统
厂商
2020.03.27
纯化工艺精选 | 解决高细胞密度甜蜜的烦恼—絮凝技术
随着生物制药技术的发展,高细胞密度和高产物滴度的细胞培养已经成为一种趋势,这给传统下游澄清工艺带来了越来越大的负担,使得我们传统深层过滤器载量下降,整体纯化效率降低。 什么是絮凝技术?絮凝技术,是通过改变pH值或离子环境,诱导小的易堵塞杂质絮凝或沉淀的方法,从而增加杂质颗粒粒径,减少难以通过离心方式分离且会堵塞下游过滤器的微小颗粒,进一步通过Clarisolve®深层过滤器一步澄清,实现高细胞密度料液(>10^7/ml)的高效澄清。 絮凝原理示意图:絮凝方案如何实现? 针对高密度细胞收获液,默克可提供两款GMP级别絮凝剂:pDADMAC和mPAA。二者均为阳离子聚合物,料液可在絮凝剂加入后30分钟内高效完成絮凝过程。絮凝剂& Clarisolve®深层过滤器:经过絮凝处理后的料液,颗粒物直径会提高2-4倍,往往会大于传统深层过滤器的截留孔径,容易造成滤器的迅速堵塞,载量降低。Clarisolve® 深层过滤器是首款针对絮凝处理后料液的粒径分布而特别设计的,具有梯度密度结构的澄清滤器。Clarisolve® 深层过滤器示意图优点:孔径分布范围大,适用于颗粒粒径范围广的杂质去除梯度过滤,载量高单级过滤即可有效降低浊度,减少深层过滤使用面积对于HCP/DNA有较高的去除能力 传统澄清过滤VS絮凝技术相较于传统深层过滤而言,采用絮凝技术进而进行深层过滤,可达到更高的过滤载量,从而降低深层过滤膜包的使用面积和使用前冲水量。同时,絮凝所需时间在30-60min,相比于两级深层过滤,大大降低了澄清过滤的时间成本。以2000L生产工艺为例,对两种技术进行对比:* 细胞密度>20*10^6 cells/mL絮凝剂的残留絮凝剂通常是一类带正电荷高分子聚合物,在抗体纯化的工艺中,每一个步骤都会对絮凝剂有一定去除作用,大部分的絮凝剂会在阳离子层析后被大量去除,在最终制剂前的蛋白料液中,絮凝剂残留量满足毒理要求,经过细胞血红蛋白释放检测,残留的絮凝剂剂量不具有细胞毒性。 絮凝剂pDADMAC通过层析工艺后的残留:随着上游培养技术的迅速发展,高密度细胞培养将成为趋势,在这种情况下,采用传统深层过滤会迅速堵塞,造成澄清工艺的载量大幅度降低。而采用絮凝技术,则能够有效地解决澄清滤器低载量的挑战,与此同时,对HCP和DNA有更好的去除能力。
厂商
2020.03.24
生物安全精选 | Millipak® Final Fill – 最大程度提升高附加值液体制剂回收率
对于高附加值液体制剂及最终灌装来说,最大限度地提高产品回收率并保持无菌是至关重要的。默克推出的Millipak®系列产品表现优异并被市场及客户给予好评。基于市场发展需要,默克针对高附加值液体制剂的最终过滤推出了全新的Millipak® Final Fill 囊式过滤器,以最大程度满足客户需求。 Millipak® Final Fill 过滤器:Millipak® Final Fill设计:最大限度地提高产品回收率在最终过滤应用中,最大限度地提高产品回收率是至关重要的,Millipak® Final Fill过滤器的低残留体积,意味着与传统的折叠过滤器相比,它能够有效提高最终产出。Millipak®Final Fill过滤器将Durapore®滤膜和固体圆盘支撑层结合,与传统折叠过滤器的支撑材料相比,有效减少了残留体积,并降低了颗粒物释放风险。 层叠式过滤器设计:稳健可靠的无菌保障多功能洁净接口 (Aseptic Multi-Purpose Port, AMPP)的设计符合人体工程学,方便戴手套操作,有明显可见的“开启”和“关闭”锁定位。它包含三层密封圈,当AMPP关闭时,底层密封圈密闭流道;上层两层密封圈保持无菌区域,以防止环境与流道之间发生交叉污染。无菌边界在多次使用及微生物挑战之后仍能够得到有效保持,保障您的工艺安全无污染。 AMPP接口:多种尺寸满足客户需求多种过滤器尺寸可供选择,易于放大和选型。所有Millipak® Final Fill囊式过滤器均可提供非灭菌型(可耐受伽马辐照和高压蒸汽灭菌)或伽马辐照灭菌型。规格及孔径信息:
厂商
2020.03.23
2020默克制药工艺培训
厂商
2020.03.16
制药工艺精选 | 从法规监管视角看制药工艺中取样的风险缓解
制药生产过程微生物污染往往引发严重后果, 污染增加了操作员,公司和患者的风险,所有这些都可能导致严重的负面影响。 生物的污染会导致生产设施长时间关闭,以进行必要的调查,查明根本原因并防止再次发生,这将延缓关键性救生药物的生产和交付。 生物制药生产过程中,不论是中间体还是最终产品的取样对于生产至关重要。 除了通过生物负荷监测确保患者安全外,还需要进行取样以支持由全球监管趋势驱动的几个关键必要事项,包括过程分析技术(QbD)(图1)。 图1.药品生产工艺中取样的的关键驱动力。传统取样方法的局限性和风险表2.与传统采样方法有关的优缺点摘要封闭取样 鉴于传统采样的缺点,许多生物制药公司采用封闭的一次性采样技术也就不足为奇了。封闭式设计可确保将样品从样品点到分析点很好的隔离,从而在保持样品完整性的同时,降低了损失有价值产品的风险。如图2所示,与传统方法相比,封闭的无菌过程采样具有多个优点,包括易用性,更好地符合法规要求和有限的投资。表3总结了封闭式取样符合法规建议的具体方面,包括污染控制,操作员偏差的消除,收集代表性样品的能力以及健康和安全的焦点。 图2.与传统方法相比,一次性无菌取样具有明显优势。表3.无菌取样符合特定的法规要求。无菌取样案例研究--病毒灭活的验证 此案例研究举例通过无菌取样用于病毒灭活验证,说明了封闭式取样的价值。一家生物制药公司,将病毒灭活作为细胞培养生产过程中的步骤,仅在验证过程中通过动力学来验证灭活。但是,FDA建议在验证和生产过程中都需执行灭活动力学。病毒灭活每五到十分钟最多需要15个样品,而使用传统CIP / SIP阀门和玻璃瓶进行取样则不可能完成。最终选择达到FDA的期望的解决方案,是基于封闭的60 mL PETG瓶以及将这些设备连接到罐子所需的合适的连接器,来实施无菌取样。除了满足法规要求外,药企获得的收益还包括质量控制(QC)实验室中更快,更准确的取样过程以及更轻松的样品处理。 总结 没有适当的采样,就无法监控生物制药生产过程。尽管存在许多取样选择,但并非所有方法都能很好地实现预期的收益或完全符合法规要求。选择一种稳健且优化的方法,并实施适当的取样计划可确保符合法规要求,并能更好地进行流程和取样管理。生物制药业界越来越认识到封闭式取样的价值,并利用许多优势来保护生产工艺,操作员以及最终患者。 NovaSeptum®GO™无菌取样与SIP阀门/焊接等传统方法相比,NovaSeptum®GO™无菌取样系统的独特技术可缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险(表4)。集成的安全功能可通过在不使用设备时将其锁定并密封容器,从而在降低风险的策略上更加放心,确保样品安全并控制过程。表4.无菌取样可以缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险。 参考文献 EU Guidelines to Good Manufacturing Practice: Medicinal Products for Human and Veterinary Use; Annex 1 Manufacture of Sterile Medicinal Products. http://www.gmp-compliance.org/guidemgr/files/ ANNEX%2001[2008].PDF World Health Organization: Annex 4 WHO Guidelines for sampling of pharmaceutical products and related materials. http://apps.who.int/prequal/info_general/ documents/TRS929/WHO_TRS_929-Annex4.pdf FDA Guidance for Industry: CGMP for Phase I Investigational Drugs. http:// www.fda.gov/downloads/drugs/ guidancecomplianceregulatoryinformation/ guidances/ucm070273.pdf ICH Harmonised Tripartite Guideline: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients Q7. http://www.ich.org/ fileadmin/Public_Web_Site/ICH_Products/Guidelines/ Quality/Q7/Step4/Q7_Guideline.pdf Suvarna, et al. Case Studies of Microbial Contamination in Biologic Product Manufacturing. American Pharmaceutical Review. Jan 1, 2011. http://www.americanpharmaceuticalreview.com/ Featured-Articles/36755-Case-Studies-of-Microbial-Contamination-in-Biologic-Product-Manufacturing/新冠病毒药物研发默克联系人:史秋明博士 客户技术应用总监联系方式:miles.shi@merckgroup.com我们也将给您配备一对一的技术咨询专家。
厂商
2020.03.13
“爱默学院”正式上线啦!| 默克全新eLearning在线学习平台
“ 制药行业发展到今天,生产工艺和设备变得更加复杂、技术更新更快、合规越来越重要、生产转移越来越频繁,所有这些特点意味着制药企业及其从业人员要想取得成功和发展,不断学习并紧跟行业发展的最新潮流至关重要。20多年来,默克为广大药品研发和生产企业定制了反映行业新技术的培训课程,帮助大家提高工艺效率,符合法规监管,在行业内有口皆碑。同时,为了满足广大制药行业“处处可学,时时可学”的需求,我们经过一年多的筹备,特此推出默克全新eLearning在线学习平台“爱默学院”!”欢迎扫描识别上方二维码登陆“爱默学院”!平台定位默克eLearning平台“爱默学院”是为广大药品研发和生产企业定制的在线学习平台(手机端/pc端同步)。课程讲师由业界知识丰富的专业高级工程师和科学家担当培训师授课。课程内容涵盖几乎所有的制药工艺步骤、相关法规、以及相关工艺步骤的技术应用。按照难易程度分为基础、中级、高级。在持续创新和全球业务扩张的推动下,我们的课程也会不断推陈出新,以反映制药行业的成功标准、新技术和规范的实施、监管方针的变更以及学员的反馈。适合人群从事制药行业工艺开发和药品生产的工艺操作、技术管理、质量控制等操作人员、工程师、科学家等。核心价值●普及和推广制药工艺技术●提高药品研发及生产效率,以推动提高药品质量●更好地降低工艺风险并符合监管要求平台精选首次平台上线我们重磅推出10个课程,覆盖了细胞培养、除菌过滤、澄清、层析、切向流过滤、一次性产品、法规等众多应用。后续我们还将上线更多课程,敬请期待。首页在线课程课程示例学习地图平台特色1. 体系全面:涵盖在线课程、现场培训、学习地图三大板块,便于您选择适合自己的线上或线下课程,利用学习地图动态关注学习进展;2. 内容丰富:为您提供从上游工艺到下游工艺,一直到最终处理和产品放行的全方位培训;3. 课程精短:每个课程按照目录切分为几个5-15分钟的片段,高度浓缩关键点知识,方便您利用碎片化时间随时随地在线学习;4. 分享式:轻松将课程分享到微信、QQ、微博、领英等社交媒体,分享学习智慧。登陆方式1.您可关注默克工艺解决方案公众号,点击进入功能平台的“爱默学院”版块。2.或者扫描识别下方二维码登陆“爱默学院”!学习方式还在等什么,赶紧去学习体验吧!*您在登录或使用过程中,有任何问题请发送至邮箱PSLearning@merckgroup.com,我们会尽快与您联系。
厂商
2020.02.28
上游工艺精选 | 高效平台灌流培养基的开发策略
“ 细胞灌流培养是蛋白药物连续流生产工艺的重要一环,而高效、低消耗的培养基则是细胞灌流培养工艺成败的关键因素。在fed-batch工艺占主导的今天,市面上缺乏灌流专用的平台培养基。生物制药企业在探索灌流工艺时,往往只能使用fed-batch基础培养基(或混合少量补料培养基)来作为灌流培养基使用,这些培养基没有经过专门的灌流营养优化,往往细胞密度和产量不会太高,而且灌流体积比较大,增加生产成本。”本文通过对EX-CELL® Advanced™ HD Perfusion Medium的产品开发过程进行案例分析,为生物制药企业的平台化灌流培养基开发工作提供思路借鉴。最早的灌流培养基原型是利用默克CHO细胞基础培养库(basal media diversity panel)来生成。我们将库中不同培养基原型,进行DOE混料设计,生成多个新的混料配方(Mix)平行培养进行对比,并采集相关培养数据,以便进一步优化时进行MVA分析。根据试验结果,从中初步确定出两种最适灌流的混料培养基原型Mix G1 和 Mix P1;将此二种原型经过与多种富营养灌流培养基(basal medium enriched with Feed)反复进行反应器工艺平行对比,最终决定将混料培养基Mix P1作为灌流原型来进一步进行营养优化。图1 整体优化流程图通过对上一轮实验数据的MVA分析,我们从中找出对灌流工艺关键参数有显著影响的营养成分共计11种。然后,采用DoE中心组合设计(CCD)的方法,对这11种成分的最佳浓度分别进行确定。(见下图2 )图2 关键组分浓度优化等高线图显示出11种关键组分中的两种(组分4,9)对蛋白产量的影响最终,我们得到11种组分优化到最佳浓度的全新灌流培养基原型。由于氨基酸在灌流细胞生长中的特殊重要性,我们又对这种新原型培养基单独进行了氨基酸优化:采用上清分析手段,对灌流中,细胞在生长和表达阶段的各氨基酸消耗速率分别进行测量,根据测量结果,我们按照20 pL/cell/day 的CSPR的模型来计算,对培养基中的氨基酸组分进一步强化调整(主要是增加了重要氨基酸的浓度)。氨基酸调整之后, 培养基的CSPR在几个测试的细胞株上均有显著降低,同时细胞单产(qp)也得以进一步提高。(见下图3)。图3 氨基酸浓度调整后的效果在测试CHO-S细胞株上,CSPR从60 pL/cell/day降低到37 pL/cell/day,同时qp从原来的最高8.4pcd提高到最高11.7pcd接着对调整后原型的氨基酸消耗速率进行重新测试发现:随着CSPR的降低,细胞的氨基酸消耗速率也较之前发生了变化,降低CSPR,某些氨基酸却出现了过量现象(见下图4)。图4 在提高氨基酸浓度,降低CSPR之后,单细胞消耗氨基酸的速率也发生了改变(降低)这表明,培养基中氨基酸浓度及灌流速率等条件的改变,让细胞内的某些代谢通路发生了变化。所以,我们对部分过量的氨基酸进行了重新再平衡调整。我们用不同细胞株对调整后的配方进行反应器灌流验证,以测试其广谱性。结果显示,该配方对不同类型细胞株灌流培养均具有优良效果。(见下图5)图5 在40 pL/cell/day的CSPR下灌流超过30天,细胞数维持在50*106 vc/mL,同时单位产量也维持稳定小结在灌流培养基的开发过程中,统计学工具是必不可少的。如通过MVA分析定向找出关键组分,再通过DOE设计,对关键组分浓度进行快速优化,从而提升性能,这是灌流培养基开发的一个重要手段。另外,本案例显示,氨基酸浓度对灌流效果有相对重要的作用,通过氨基酸浓度的优化,较明显提升了培养效果。但在初次调整氨基酸浓度后,细胞的氨基酸代谢也随着出现了一定的变化(如重新测试后发现某些氨基酸有过量现象),说明细胞的氨基酸代谢之间有复杂的关联,对氨基酸的调整需要进行反复摸索,才可找到最佳的浓度组合。默克新一代EX-CELL® Advanced™ HD Perfusion Medium订购信息:如需咨询产品信息,请扫描以下二维码。如您正在研发新冠病毒药物,请扫描以下二维码填写问卷调查。我们会为您提供新冠药物开发所涉及的产品技术与服务组合,及全球专家的优先支持。帮助您快速到达临床,取得战“疫”的胜利。新冠病毒药物研发默克联系人:史秋明博士 客户技术应用总监联系方式:miles.shi@merckgroup.com我们也将给您配备一对一的技术咨询专家。
新品
2020.02.26