制药工艺精选 | 从法规监管视角看制药工艺中取样的风险缓解
制药生产过程微生物污染往往引发严重后果, 污染增加了操作员,公司和患者的风险,所有这些都可能导致严重的负面影响。 生物的污染会导致生产设施长时间关闭,以进行必要的调查,查明根本原因并防止再次发生,这将延缓关键性救生药物的生产和交付。
生物制药生产过程中,不论是中间体还是最终产品的取样对于生产至关重要。 除了通过生物负荷监测确保患者安全外,还需要进行取样以支持由全球监管趋势驱动的几个关键必要事项,包括过程分析技术(QbD)(图1)。
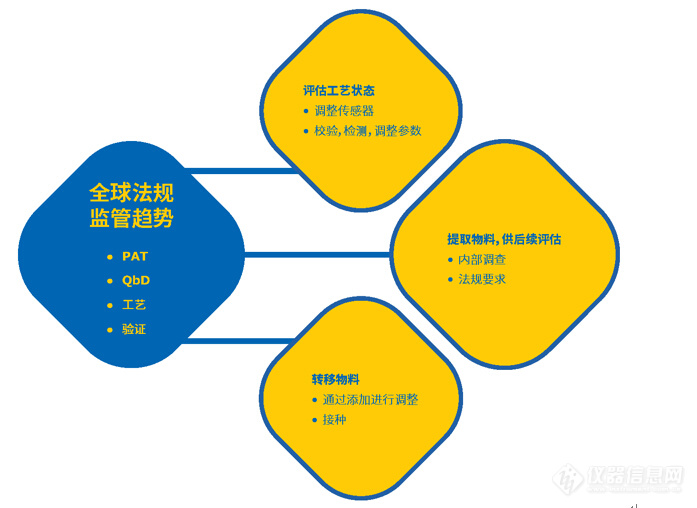
图1.药品生产工艺中取样的的关键驱动力。
传统取样方法的局限性和风险
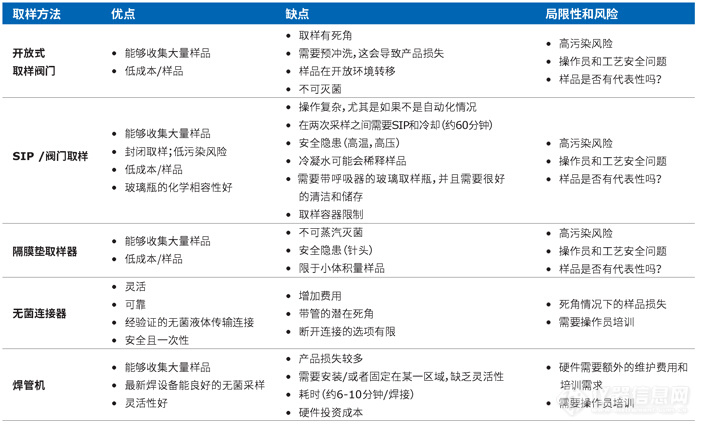
表2.与传统采样方法有关的优缺点摘要
封闭取样
鉴于传统采样的缺点,许多生物制药公司采用封闭的一次性采样技术也就不足为奇了。封闭式设计可确保将样品从样品点到分析点很好的隔离,从而在保持样品完整性的同时,降低了损失有价值产品的风险。
如图2所示,与传统方法相比,封闭的无菌过程采样具有多个优点,包括易用性,更好地符合法规要求和有限的投资。
表3总结了封闭式取样符合法规建议的具体方面,包括污染控制,操作员偏差的消除,收集代表性样品的能力以及健康和安全的焦点。

图2.与传统方法相比,一次性无菌取样具有明显优势。

表3.无菌取样符合特定的法规要求。
无菌取样案例研究--病毒灭活的验证
此案例研究举例通过无菌取样用于病毒灭活验证,说明了封闭式取样的价值。一家生物制药公司,将病毒灭活作为细胞培养生产过程中的步骤,仅在验证过程中通过动力学来验证灭活。但是,FDA建议在验证和生产过程中都需执行灭活动力学。病毒灭活每五到十分钟最多需要15个样品,而使用传统CIP / SIP阀门和玻璃瓶进行取样则不可能完成。最终选择达到FDA的期望的解决方案,是基于封闭的60 mL PETG瓶以及将这些设备连接到罐子所需的合适的连接器,来实施无菌取样。除了满足法规要求外,药企获得的收益还包括质量控制(QC)实验室中更快,更准确的取样过程以及更轻松的样品处理。
总结
没有适当的采样,就无法监控生物制药生产过程。尽管存在许多取样选择,但并非所有方法都能很好地实现预期的收益或完全符合法规要求。选择一种稳健且优化的方法,并实施适当的取样计划可确保符合法规要求,并能更好地进行流程和取样管理。生物制药业界越来越认识到封闭式取样的价值,并利用许多优势来保护生产工艺,操作员以及最终患者。
与SIP阀门/焊接等传统方法相比,NovaSeptum®GO™无菌取样系统的独特技术可缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险(表4)。集成的安全功能可通过在不使用设备时将其锁定并密封容器,从而在降低风险的策略上更加放心,确保样品安全并控制过程。

表4.无菌取样可以缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险。
参考文献
EU Guidelines to Good Manufacturing Practice: Medicinal Products for Human and Veterinary Use; Annex 1 Manufacture of Sterile Medicinal Products. http://www.gmp-compliance.org/guidemgr/files/ ANNEX%2001[2008].PDF
World Health Organization: Annex 4 WHO Guidelines for sampling of pharmaceutical products and related materials. http://apps.who.int/prequal/info_general/ documents/TRS929/WHO_TRS_929-Annex4.pdf
FDA Guidance for Industry: CGMP for Phase I Investigational Drugs. http:// www.fda.gov/downloads/drugs/ guidancecomplianceregulatoryinformation/ guidances/ucm070273.pdf
ICH Harmonised Tripartite Guideline: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients Q7. http://www.ich.org/ fileadmin/Public_Web_Site/ICH_Products/Guidelines/ Quality/Q7/Step4/Q7_Guideline.pdf
Suvarna, et al. Case Studies of Microbial Contamination in Biologic Product Manufacturing. American Pharmaceutical Review. Jan 1, 2011. http://www.americanpharmaceuticalreview.com/ Featured-Articles/36755-Case-Studies-of-Microbial-Contamination-in-Biologic-Product-Manufacturing/
新冠病毒药物研发默克联系人:
史秋明博士 客户技术应用总监
联系方式:miles.shi@merckgroup.com
更多![]()
“量体裁衣“ZFN,从源头降低岩藻糖!
厂商
2022.04.06
使用高剪切湿法制粒工艺充分发挥Delta晶型甘露醇的优势
厂商
2022.04.06
一个“金牌”元件出马,载体“更高更快更强大”
厂商
2022.04.06
宿主细胞使用的技术梳理
厂商
2022.04.05












