方案详情
文
在使用高效液相色谱(HPLC)进行分析时,溶剂的质量和纯度非常重要,因为溶剂要全程使用。对化合物的检测、定
性和定量分析很大程度上依赖于检出限,检出限可以在基线分析的同时获得。本文主要考察超纯水作为一种试剂对实验的
影响。我们出示了各种不同质量的水对分析的影响方式。在产生超纯水的整个复合纯化过程中,我们对有机污染物进行了
监测。这个超纯水纯化链的构造使得输出的超纯水无有机污染物(这些有机污染物会干扰反相色谱的灵敏性)。在进行痕
量有机物分析时,小心维持水纯化系统的稳定也是非常关键的。
方案详情

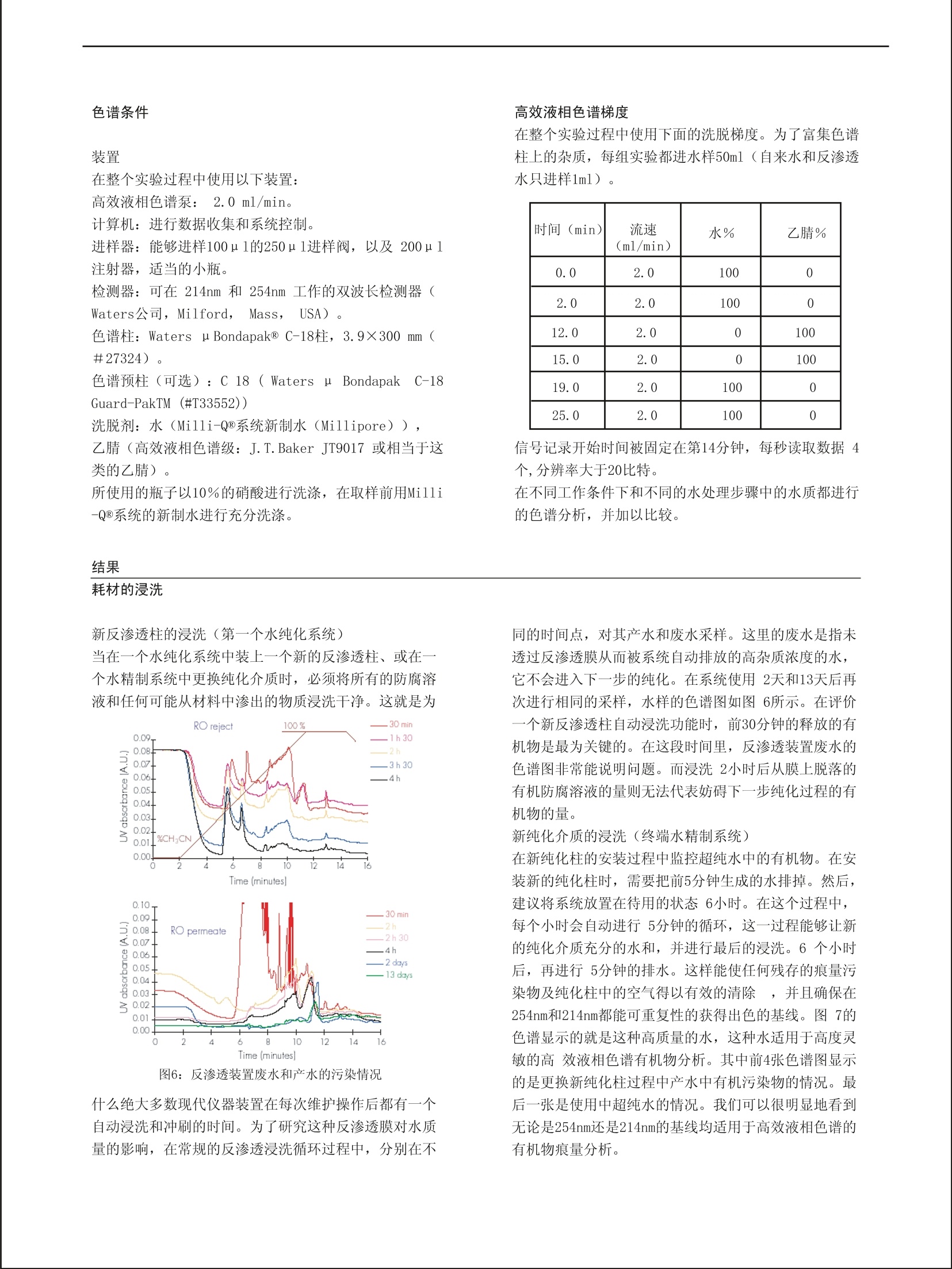
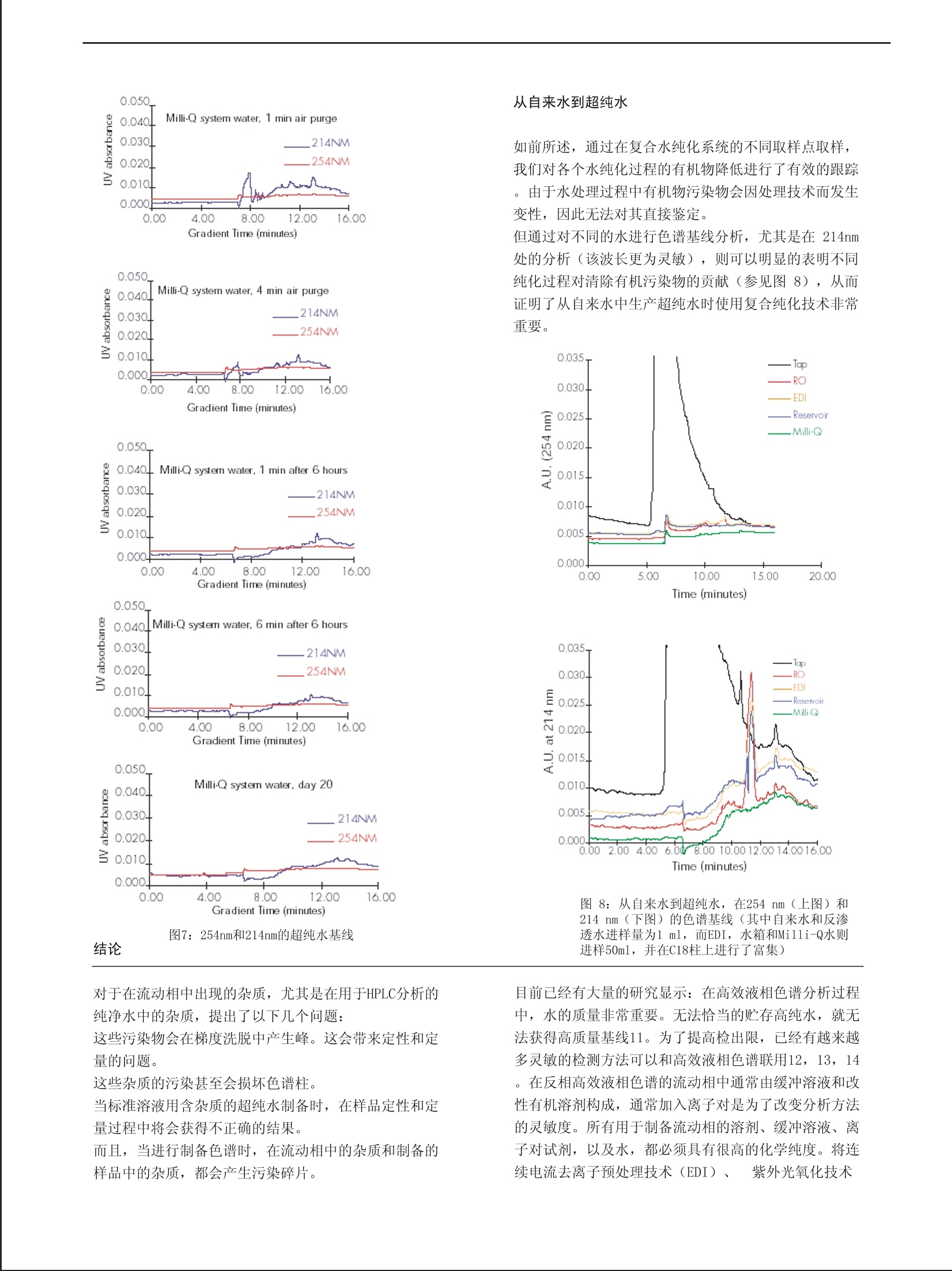
RD005 The R&D Notebook A publication of the Laboratory Water Division of Millipore 从自来水到超纯水:有机污染物的跟踪 Daniel Darbouret (1), Thomas Stone (2), 姜勇(译)(3) (1) Research & Development, Laboratory Water Division, Millipore S. A., St Quentin en Yvelines, France. (2) Central Research & Development, Analytical Lab, Millipore Corp, USA. (3)密理博中国有限公司北京代表处 关键词:超纯水,有机污染物,反相色谱,紫外检测,基线 摘要: 在使用高效液相色谱(HPLC) 进行分析时,溶剂的质量和纯度非常重要,因为溶剂要全程使用。对化合物的检测、定 性和定量分析很大程度上依赖于检出限,检出限可以在基线分析的同时获得。本文主要考察超纯水作为一种试剂对实验的 影响。我们出示了各种不同质量的水对分析的影响方式。在产生超纯水的整个复合纯化过程中,我们对有机污染物进行了 监测。这个超纯水纯化链的构造使得输出的超纯水无有机污染物(这些有机污染物会干扰反相色谱的灵敏性)。在进行痕 量有机物分析时,小心维持水纯化系统的稳定也是非常关键的。 前言 高效液相色谱分析的质量很大程度上依赖于所使用 的检测系统及所使用的溶剂的质量1。从物理信号的检 测,到光发射/吸收信号的检测,再到电信号的检测,其检测方法各不相同。每种技术都对流动相有特殊要求 ,而且尤其关键的是:所用超纯水的质量将会影响检出 限2。反相模式和紫外检测结合使用是液相色谱最常用 的分离方法之一3,4,5。各种有机溶剂,如甲醇、乙 腈、四氢呋喃,和水通常被用作流动相。因为流动相条 件的变化能改变色谱柱的吸附特点,因此,流动相的优 化对于获得有效的色谱分离非常重要6。绝大多数有机 分子在其色谱的紫外检测区有吸收值。目前市场上有很 多高效液相色谱级溶剂供应。它们是专门为使用紫外检 测器的高效液相色谱准备的,它们能有效的降低背景。在波长大于240 nm的区域,溶剂的干扰没有波长在190~230 nm之间的干扰严重, 在190~230 nm之间,微小的杂 前期的研究:传统的高效液相色谱 当获得的基线比较差时(尤其是在214nm处,这个 波长是绝大多数有机污染物的吸收波长),纯化水的质 量通常遭到置疑。 为了验证这一点,我们先保持梯度洗脱起始条件(100%水)4分钟,在无测试样品的条件下用20分钟线性 改变流动相至组成终点(100%乙腈)。另一组的过程 基本相同,只是初始条件(100%水) 质也将会产生吸收。 当进行梯度洗脱时,流动相从100%水到100%有机溶 剂,这时水中的杂质将会导致色谱图前段出现大量额外的 吸收峰。后半段(流动相中有机溶剂的比例会逐渐提高)会出现相似的峰,这主要是由于有机溶剂的纯度受到水中 杂质削弱所致。 为了获得能够在流动相中使用的低有机物污染的超纯 水,我们使用复合纯化技术,以自来水为原料生产超纯水 。在这个研究中,在每个水纯化步骤中都进行有机污染物 的跟踪。 同时,给出确保高质量超纯水水质稳定的技术建议,包括更换耗材的注意事项。 对超纯水水质进行跟踪的参数使用最广泛的就是电阻 率,但这个值无法反应有机污染物。在明显存在有机污染 物时,电阻率读数依然还是18.2MQ.cm7。 要保持36分钟,而不是4分钟。后者杂质峰明显变 大,所以可以肯定这些杂质来自水而非乙腈 (图1)。 一旦待样品的峰和这些杂质峰重叠,定量分析就会产生 误差,即便不重叠,这些杂质峰也容易和未知产物峰搞 混。 下面对不同类型纯化水进行了色谱分析。 Flgure 2: Poor baseline profiles of 214 ond 254nm. 图2:在214nm 和254 nm 处获得的很差的基线谱 首先是对50ml非超纯水的实验用水进行的梯度分析 。先将水样用C18柱富集,然后梯度洗脱至100%乙腈,调整检测波长,用双波长紫外检测器收集信号。如图2所示,这种水显然不能用于高效液相色谱分析,不论是 等度洗脱还是梯度洗脱。图中大多数峰都是水中杂质峰 只有最后两个峰是乙腈峰。 实验 图4:反渗透水 然后是对50ml三蒸水进行的梯度分析。先将水样用 C18柱富集,然后梯度洗脱至100%乙腈,调整检测波长 ,用双波长紫外检测器收集信号。这种水显然也不能用 于高效液相色谱分析。如图3所示,前面的峰都是水中 杂质峰,最后两个峰是乙腈峰。 图4显示的是对50ml反渗透水进行的梯度分析。也 是先用C1柱富集,然后梯度洗脱至100%乙腈,调整检 测波长,用双波长紫外检测器收集信号。这种水显然也 不能用于高效液相色谱分析,不论是等度洗脱还是梯度 洗脱。图中前面峰都是水中杂质峰,最后两个峰来自是 乙腈。不仅如此,这种类型的纯化水残留背景非常高。 要想将自来水纯化成适合有机色谱分析的超纯水,将各种纯化技术整合链接势在必行。而为了确认这种纯 化方法去除有机杂质的有效性,我们对各个主要纯化步 骤输出的水都进行了有机物研究。 水纯化系统 图5:被研究的水纯化系统 如上所述,要得到超纯水,复合纯化技术是必需的 。在水纯化系统的各个位置对各种类型有机物进行跟踪 的方法最早在1987年出现8。而复合技术则曾应用于去 离子水生产过程中对污染情况的监控9。这里定性研究 所用到的装置由两个新型水纯化系统构成。第一个是由 反渗透装置和连续电流去离子 装置(EDI)组成的复合系统。它由自来水供水,产生的纯水储存在一个60升的水箱中。这种水箱是专门 为优化高纯水的存储而设计的10。第二个则是活性炭吸 附装置、离子交换树脂和紫外光处理装置组成的复合系 统。该系统由第一个系统的产水供水。多个取样口保证 水纯化过程全程都能取水(参见图5的箭头) 色谱条件 装置 在整个实验过程中使用以下装置: 高效液相色谱泵:2.0 ml/min。 计算机:进行数据收集和系统控制。 进样器:能够进样100以1的250ul进样阀,以及 200以l 注射器,适当的小瓶。 检测器:可在214nm 和 254nm 工作的双波长检测器( Waters公司, Milford, Mass,USA)。 色谱柱: Waters u Bondapak@ C-18柱,3.9×300mm (#27324)。 色谱预柱(可选): C 18 ( Waters u山BondapakC-18Guard-PakTM (#T33552)) 洗脱剂:水(Milli-Q@系统新制冰(Millipore)), 乙腈(高效液相色谱级: J.T.Baker JT9017 或相当于这 类的乙腈)。 所使用的瓶子以10%的硝酸进行洗涤,在取样前用Milli -Q@系统的新制水进行充分洗涤。 结果 耗材的浸洗 新反渗透柱的浸洗(第一个水纯化系统) 当在一个水纯化系统中装上一个新的反渗透柱、或在一 个水精制系统中更换纯化介质时,必须将所有的防腐溶 液和任何可能从材料中渗出的物质浸洗干净。这就是为 图6:反渗透装置废水和产水的污染情况 什么绝大多数现代仪器装置在每次维护操作后都有一个 自动浸洗和冲刷的时间。为了研究这种反渗透膜对水质 量的影响,在常规的反渗透浸洗循环过程中,分别在不 高效液相色谱梯度 在整个实验过程中使用下面的洗脱梯度。为了富集色谱 柱上的杂质,每组实验都进水样50ml(自来水和反渗透 水只进样1ml)。 时间(min) 流速 (ml/min) 水% 乙腈% 0.0 2.0 100 0 2.0 2.0 100 0 12.0 2.0 0 100 15.0 2.0 0 100 19.0 2.0 100 0 25.0 2.0 100 0 信号记录开始时间被固定在第14分钟,每秒读取数据4个,分辨率大于20比特。在不同工作条件下和吥同的水处理步骤中的水质都进行 的色谱分析,并加以比较。 同的时间点,对其产水和废水采样。这里的废水是指未 透过反渗透膜从而被系统自动排放的高杂质浓度的水,它不会进入下一步的纯化。在系统使用2天和13天后再 次进行相同的采样,水样的色谱图如图6所示。在评价 一个新反渗透柱自动浸洗功能时,前30分钟的释放的有 机物是最为关键的。在这段时间里,反渗透装置废水的 色谱图非常能说明问题。而浸洗2小时后从膜上脱落的 有机防腐溶液的量则无法代表妨碍下一步纯化过程的有 机物的量。 新纯化介质的浸洗(终端水精制系统) 在新纯化柱的安装过程中监控超纯水中的有机物。在安 装新的纯化柱时,需要把前5分钟生成的水排掉。然后,建议将系统放置在待用的状态6小时。在这个过程中,每个小时会自动进行5分钟的循环,这一过程能够让新 的纯化介质充分的水和,并进行最后的浸洗。6个小时 后,再进行5分钟的排水。这样能使任何残存的痕量污 染物及纯化柱中的空气得以有效的清除,并且确保在 254nm和214nm都能可重复性的获得出色的基线。图7的 色谱显示的就是这种高质量的水,这种水适用于高度灵 敏的高效液相色谱有机物分析。其中前4张色谱图显示 的是更换新纯化柱过程中产水中有机污染物的情况。最 后一张是使用中超纯水的情况。我们可以很明显地看到 无论是254nm还是214nm的基线均适用于高效液相色谱的 有机物痕量分析。 0.050 0.050 图7:254nm和214nm的超纯水基线 结论 对于在流动相中出现的杂质,尤其是在用于HPLC分析的 纯净水中的杂质,提出了以下几个问题: 这些污染物会在梯度洗脱中产生峰。这会带来定性和定 量的问题。 这些杂质的污染甚至会损坏色谱柱。 当标准溶液用含杂质的超纯水制备时,在样品定性和定 量过程中将会获得不正确的结果。 而且,当进行制备色谱时,在流动相中的杂质和制备的 样品中的杂质,都会产生污染碎片。 从自来水到超纯水 如前所述,通过在复合水纯化系统的不同取样点取样,我们对各个水纯化过程的有机物降低进行了有效的跟踪 。由于水处理过程中有机物污染物会因处理技术而发生 变性,因此无法对其直接鉴定。 但通过对不同的水进行色谱基线分析,尤其是在 214nm 处的分析(该波长更为灵敏),则可以明显的表明不同 纯化过程对清除洧机污染物的贡献(参见图8),从而 证明了从自来水中生产超纯水时使用复合纯化技术非常 重要。 Time (minutes) 图8:从自来水到超纯水,在254nm(上图)和 214nm(下图)的色谱基线(其中自来水和反渗 透水进样量为1 ml, 而EDI,水箱和Milli-Q水则 进样50ml, 并在C18柱上进行了富集) 目前已经有大量的研究显示:在高效液相色谱分析过程 中,水的质量非常重要。无法恰当的贮存高纯水,就无 法获得高质量基线11。为了提高检出限,已经有越来越 多灵敏的检测方法可以和高效液相色谱联用12,13,14。在反相高效液相色谱的流动相中通常由缓冲溶液和改 性有机溶剂构成,通常加入离子对是为了改变分析方法 的灵敏度。所有用于制备流动相的溶剂、缓冲溶液、离 子对试剂,以及水,都必须具有很高的化学纯度。将连 续电流去离子预处理技术(EDI)、 紫外光氧化技术 (UV)和高质量的纯化介质等水纯化技术结合起来,同 时保证易于维护的自动清洗和冲刷的能力,这样的超纯 水生产系统输出的超纯水能适用于高灵敏的有机物分析 。另外,给超纯水系统配备在线 TOC (总的有机炭)检 测器,将是在使用超纯水时对水中有机污染物进行监控 的最好方法。 1. Verity, I.;“Solvent Purity and the Individual Requirements of Different HPLC Detectors””LC-GC INT., Volume 8, Number 11, 652-655,1995 2. Miyabe, K. ; Takeushi, S.; “ Effect ofAcetonitrile / Water MobilePhase CompositionCon Adsorption Characteristics of Reversed Phase Liquid Chromatography”Analytical Chemistry,Volume 69, 2567-2574,1997 3. Tanaka , M.; Yamazaki, H.;“Direct Determination of Pantoprazole Enantiomers in Human Serum by Reversed-Phase High-Performance LiquidChromatography Using a Cellulose-Based Chiral Stationary Phase and Column Switching System as a Sample Cleanup Procedure” Analytical Chemistry, Volume 69, Number 9,1513-1516,1996 4. Kuangjing Shao, L.; Locke, D. C.; “Determination of Paclitaxel and Related Taxanes in Bulk Drug and In jectable Dosage Forms by Reversed Phase Liquid Chromatography” Analytical Chemistry,,Volume 69, Number 11,2008-20160,,1997 5. Corran,P.H.;;“Reversed phase chromatography of proteins”in HPLC of Macromolecules. A practical approach. (ed. Oliver, R.W.A.) IRL Press, Oxford, 120-156),,1989 6. McCown, S.M. ; Southern, D. ; Morrison, B. E. ;;“Solvent properties and their effects on gradient elution highperformance liquid chromatography. IIIExperimental findings for water and acetonitrile”Journal of Chromatography, 352, 493-509,,1986 7. Darbouret,D.; Ishii, N. ; Kanazawa, M. ; Kano, I.;“Impact of feed water quality on the production of ultrapure water“ The R&D Notebook, Millipore RD004(2000) 8. Denoncourt , J.P.; Egozy, Y.;;“Trace-level Analysis of High Purity Water Part III: High Performance Liquid Chromatography” Ultrapure Water January/February 1987 9. Anantharaman, V. ; Parekh, B. ; Hegde, R. ; “Detection and Characterization of Organics in Semiconductor DI Water Processes”Ultrapure Water 11(3), 30-36,1994 10.Darbouret, D.; Kano, I.; Youf, E. ; Stewart, B.;;“Optimizing Storage of purified water forLaboratory Applications”The R&D Notebook, Millipore RD001, 1998 11.Gabler, R.; Hegde, R. ; Hughes, D.;“ Degradation of High Purity Water on Storage”Journal of liquid Chromatography, 6(13), 2565-2570 12.Achilli , G.; Cellerino ,G.P.; Melzi d’ Eril,G.;“Simultaneous d etermination of27 phenols and herbicides in water by high-performance liquid chromatography with multielectrode electrochemical detection”Journal of Chromatography A, 697, 357-362,1995 13.Coquart, V.; Hennion, M.C.;“Determination of Chlorotriazines in Aqueous Environmental Samples at the ng/l1LLevel1UUsing Preconcentration with a Cation Exchanger and On-Line High-Performance Liquid Chromatography” Journal of Chromatography, 585, 67-73,1991 14.Somsen, G.W. ; Hooyschuur, E.W.J.; Gooije r, C.; Brinkman, U.A. Th.; Velthorst, N.H.; Visser, T.;“Coupling of Reversed Phase Liquid Column Chromatography and Fourrier Transform Infrared Spectrometry Using Postcolumn On-Line Extraction and Solvent Elimination ”Analytical Chemistry, 688(5), 746-752, 1996 15.Clark, K.; Retzik, M.; Darbouret, D. “Measuring TOC to maintain high-purity water ” Ultrapure Water 14(2), pp 21-24上,,(1997) 地址:北京建国门北大街8号密理博中国有限公司北京代表处姜勇 邮编:100005 电话:010-65181058-634 传真:010-85191255
确定



还剩3页未读,是否继续阅读?
默克化工技术(上海)有限公司为您提供《自来水中有机污染物检测方案(纯水器)》,该方案主要用于环境水(除海水)中有机污染物 检测,参考标准--,《自来水中有机污染物检测方案(纯水器)》用到的仪器有默克Milli-Q Super-Q™ Plus试剂级超纯水系统
相关方案
更多
该厂商其他方案
更多










