







电镜#新能源 ; 邮箱:yanglz@instrument.com.cn; 微信:yanglizhe2011


在分子水平上,一个生物体的生理功能在很大程度上由它所表达的蛋白质决定,并且在大多数疾病病例中,蛋白质的功能失常往往是疾病的根本原因。
与传统的故障排查和维修一样,蛋白质的功能失常要找到问题根源进行修复,必须了解它是如何构建的,以及维持其各个功能的组件。而冷冻电镜技术(cryo-EM)正是可以帮助我们解读蛋白质等重要细胞机制的结构生物学。
近期,国外媒体采访了格罗宁根大学(University of Groningen) 结构生物学系高分辨率cryo-EM负责人Cristina Paulino(助理教授),请其介绍了cryo-EM在其团队研究膜蛋白结构和功能方面所发挥的重要作用。
媒体:研究膜转运蛋白的机制及结构的重要意义?您通常研究哪些特定类型的膜转运蛋白?为什么?
Cristina Paulino(CP):获得结构性见解是解开蛋白质作用机制的基础。将蛋白质功能和生理数据相结合时,我们能够详细了解这些蛋白质如何运作,了解它们为什么以及如何发生故障,疾病的原因是什么以及我们如何解决它。我喜欢将蛋白质结构比作“组装机器的蓝图”。虽然遗传学和生物化学有助于理解蛋白质的生理作用,但结构生物学揭示了这些纳米机器的外观以及它们的连接方式。只有这样,我们才能理性地理解它们并利用这些知识来修复、设计或阻止它们。例如,基于结构的药物设计等。
我的研究重点是阐明嵌入膜中的蛋白质的作用机制,特别是膜转运蛋白和通道的作用机制。尽管膜蛋白具有高药理学相关性(目前超过60%市售药物的目标膜蛋白),但对膜蛋白的结构-功能-关系的研究还很少,需要生物学、化学和物理学等跨学科方法交叉研究。
虽然我的小组主要研究关于这些蛋白质如何发挥作用的基本问题,但研究结果可以带来额外的社会经济应用。这在我们对人类ASCT2的研究中得到证实,人类ASCT2是人体细胞中谷氨酰胺摄取的主要来源,与癌细胞生长,患者生存率低以及癌症治疗的新热靶点密切相关。除了解开其运输机制细节的工作外,我们还与药物化学家合作,以确定新的抑制剂并指导基于结构的药物设计。其他研究模糊了传统运输机制中存在的传统概念边界。例如,KdpFBAC复合物,即细菌中的紧急钾摄取系统,结合了主要活性转运蛋白和通道的特征。在TMEM16家族中,成员既可以作为钙激活的氯离子通道,也可以作为脂质打乱酶,甚至两者兼而有之。我们的研究表明,在进化过程中,保守蛋白结构不仅相互进化,而且可以融合在一起,以适应不同的环境和细胞需求。
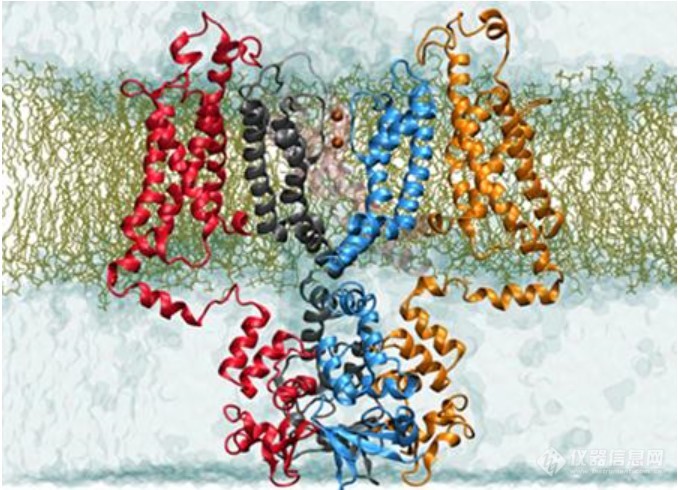
TMEM16家族的膜蛋白研究成果发表在2019年3月12日的eLife期刊上的两篇背靠背论文中
媒体:cryo-EM对你工作的重要性如何?对团队能力提升有哪些影响?
CP:在过去几年中,cryo-EM已被证明是结构生物学中不可或缺的技术,提供了超过X射线晶体学的几个优点,即(i)只需要少量的蛋白质; (ii)不受蛋白质晶体形成的限制;(iii)几乎不受缓冲成分的限制,并允许在冻结前诱导构象变化;(iv)不受样本成分或构象异质性的影响,使我们得以一窥结构动力学; (v)能够确定低分辨率和高分辨率结构;(vi)允许使用模拟天然脂质环境的工具,如纳米盘。值得注意的是,虽然冷冻电镜获得的分辨率平均低于x射线晶体学,但对于膜蛋白获得的共同分辨率是相似的(约3-4埃)。事实证明,这些优势对于解决使用膜蛋白时面临的几个挑战至关重要,可以进行前所未有的研究,并使cryo-EM成为研究膜蛋白结构的首选技术。因此,cryo-EM是我们小组采用的主要技术。
媒体:使用cryo-EM推断一个膜蛋白结构的实验周期大概需要多久?
CP:在比较理想环境条件下,有一个比较理想的样品,一个性能良好的高端显微镜,有一套强大的图像处理集群,你可以在几天内解决一个高分辨率的结构。然而,在现实实验中,特别是在处理具有挑战性的膜蛋白时,时间周期通常是几周或几个月。
媒体:你最近用cryo-EM测定了TMEM16蛋白家族的结构。在新闻稿中,您声明这种方法“允许您对活动结构动态进行采样”。能详细谈谈吗?为什么cryo-EM优于其他可用的方法?
CP: cryo-EM的优点之一是样品经过震荡冷冻,保留了溶液中的所有构象。这与x射线晶体学形成了强烈的对比,x射线晶体学的定义是,晶体中的所有蛋白质都处于相同的状态,而这种状态通常局限于能量优先构象。此外,我们还可以在图像处理的层面上处理cryo-EM图像中存在的构象异质性。因此,我们可以从相同的样品中确定蛋白质在溶液中的几种结构,它们代表不同的功能状态。在我们最近关于脂质scramblase TMEM16的研究中,我们能够在激活条件下获得几种超燃酶结构。我们将这些不同的构象解释为该蛋白逐步激活机制的快照,并提出其中一种中间状态可能与某些TMEM16蛋白中观察到的非选择性离子传导有关。
媒体:在您的研究领域里使用cryo-EM有什么限制吗?如何才能克服这些限制?
CP: cryo-EM在过去几年里发展得如此之快和如此之多,我感到非常兴奋。尽管该技术不断地重新定义其局限性并变得更加用户友好,但我们仍然面临一些挑战。然而,对于x射线晶体学来说,获得完全可操作和维护的同步加速器束流线基本上是免费的,而cryo-EM的总体成本和操作所需的专业水平一直是一个障碍。在一定程度上,政府对cryo-EM设备的补贴缓解了这一问题,但并没有完全解决。
在我的小组中,我们有一个内部的高端cryo-EM供我们使用,我们确保对所有小组成员进行彻底的培训。其他障碍包括图像处理集群的获取和成本、数据管理(每天可以记录几个TB数据)和图像处理方面的专门知识。幸运的是,它的成本随着时间的推移而降低,而图形处理单元驱动软件的实现使成本保持在可承受范围内。当然,样品制备有很大的改进空间(例如,需要更少量的蛋白质并避免空气 - 水界面),几个团队和公司正在致力于解决这个问题。
最后,解决一个结构所需的总时间,以及尺寸和平均分辨率的限制,仍然对基于结构的药物设计所需的高通量方法构成挑战和阻碍。这些问题正在通过结合更稳定的电子显微镜、更好和更有效的电子探测摄像机和改进的处理算法得到解决。
[来源:仪器信息网译] 未经授权不得转载
 图解2019年5月地表水环境质量
图解2019年5月地表水环境质量
2024.09.19

2024.09.18

2024.09.18

2024.09.13

逆风破浪,仪器信息网扬帆出海——2024日本JASIS展纪实
2024.09.12

2024.09.12
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~