看了植物荧光成像仪的用户又看了
PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术与CCD技术结合在一起,于1996年在世界上成功研制生产出FluorCam叶绿素荧光成像系统(Heck等,1999;Nedbal等,2000;Govindjee and Nedbal, 2000)。FluorCam叶绿素荧光成像技术成为上世纪90年代叶绿素荧光技术的重要突破,使科学家们对光合作用与叶绿素荧光的研究一下子进入二维世界和显微世界。目前PSI公司已成为世界上最权威、使用最广、种类最全面、发表论文最多的叶绿素荧光成像专业生产厂商。
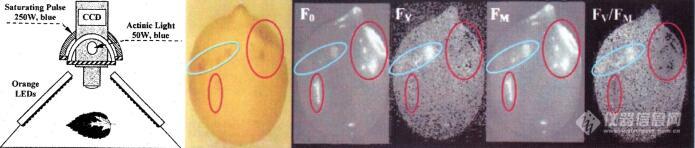
上左图为上世纪90年代Nedbal等设计的FluorCam叶绿素荧光成像技术(Photosynthesis Research, 66: 3-12, 2000),右图为柠檬彩色图及叶绿素荧光成像图(Photosynthetica, 38: 571-579, 2000)
FluorCam台式植物多光谱荧光成像系统是一款高度集成、高度创新、使用方便、应用广泛的高端植物活体成像技术设备,高灵敏度CCD镜头、4个固定的LED光源板及控制系统等集成于一个暗适应操作箱内(还可根据需求选配第五个光源板置于顶部),植物样品放置在暗适应操作箱内的隔板上,隔板7级高度可调;光源由高稳定性供电单元提供电源,4个高能、高稳定性LED光源板均一性照在植物样品上,成像面积可达13×13 cm;控制系统通过USB与计算机相联,并通过FluorCam软件程序控制和采集分析数据。适用于植物叶片及果实等其它植物组织、整株植物或培养的多株植物、苔藓地衣等低等植物、藻类等,广泛应用于植物包括藻类光合生理生态、植物逆境胁迫生理与易感性、气孔功能、植物环境如土壤重金属污染响应与生物检测、植物抗性检测与筛选、作物育种、Phenotyping等研究。
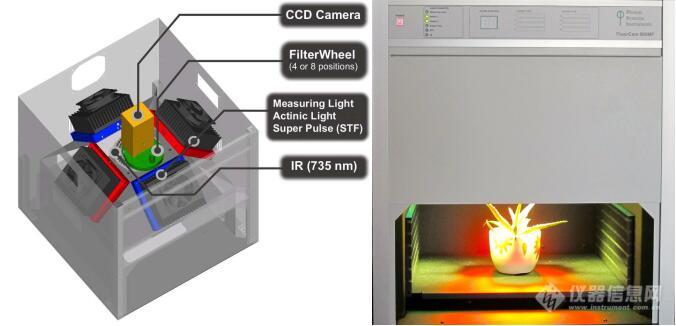
主要功能特点:
· 系统集成于暗适应操作箱内,操作简便、便于移动,既可在实验室内也可在室外进行暗适应成像测量分析
· 高灵敏度CCD镜头,时间分辨率达50张每秒,快速捕捉叶绿素荧光瞬变,成像面积达13x13cm
· 是世界上唯一可进行OJIP快速荧光动力学成像分析的高端叶绿素荧光技术设备,可得到OJIP快速叶绿素荧光动态曲线及Mo(OJIP曲线初始斜率)、OJIP固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI(Performance Index)等20多个参数
· 是世界上唯一可进行QA再氧化动力学成像分析的高端叶绿素荧光技术设备,可运行单周转饱和光闪(STF)叶绿素荧光诱导动态,光强在100μs内可达到120,000 μmol(photons)/m2.s
· 具备功能最全的、可编辑的叶绿素荧光实验程序(Protocols),包括快照模式、Fv/Fm、Kautsky诱导效应、2个叶绿素荧光淬灭分析(NPQ)protocolas(2套定制给光方案)、LC光响应曲线、PAR吸收与NDVI成像分析、QA再氧化动力学分析(选配)、OJIP快速荧光动力学分析(选配)及GFP绿色荧光蛋白成像(选配)等
· 可进行自动重复成像测量分析,预设一个实验程序(Protocols)、测量次数及间隔,系统将自动循环运行成像测量,并自动将数据按时间日期存入计算机(带时间戳);还可预设两个实验程序(Protocols);比如使系统白天自动运行Fv/Fm,夜间自动运行NPQ分析等
· 具备双色光化学光激发光源,标准配置为红色和白色,可选配红色与蓝色等双波段光化学光,双色光化学光可按不同比例搭配使用,以便实验不同光质对作物/植物的光合效益

左图A为100%红色光源条件下黄瓜叶片的Fv/Fm,左图B为30%蓝色光源条件下黄瓜叶片的Fv/Fm;右上图为光合作用强度随光照强度(不同比例蓝色光)的关系,右下图为气孔导度随光照强度(不同比例蓝色光)的关系
· 可运行叶绿素荧光成像、多光谱荧光成像、GFP稳态荧光成像
· 可选配TetraCam彩色成像模块,最大成像面积20x25cm,用于叶片或植物形态成像分析和叶绿素荧光成像对比分析
· 可选配高光谱成像单元和红外热成像单元,植物性状数字化、可视化,全面测量分析植物形态、光合效率、生化性状、气孔导度、胁迫与抗性等
· 可选配大型版移动式植物成像分析系统,成像面积35x35cm,可运行叶绿素荧光成像、红外热成像及RGB成像分析

最新应用案例:
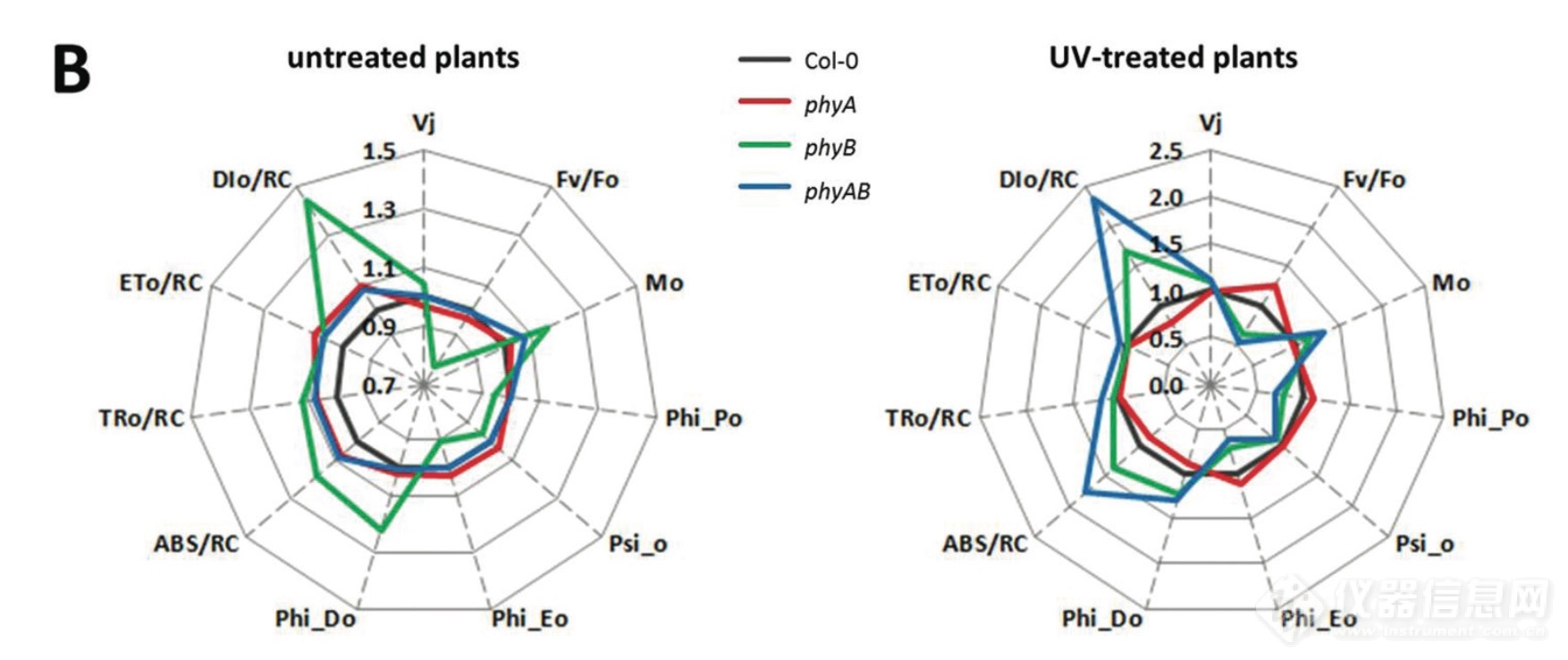
Hendrik Kupper与Zuzana Benedikty等,在2019年2月出版的《Plant Physiology》,发表了Analysis of OJIP Chlorophyll Fluorescence Kinetics and QA Reoxidation Kinetics by Direct Fast Imaging,该研究首次采用超高速成像传感器FluorCam台式植物叶绿素荧光成像系统与FKM多光谱显微荧光成像系统,成像速度可达4000fps@640x512,QA再氧化叶绿素荧光动力学成像测量单脉冲饱和光闪达150,000 μmol/m2.s1。
附:OJIP快速荧光动力学测定分析参数包括:
a) Fo:初始荧光或称最小荧光,50μs时的荧光
b) Fj:2ms时的荧光
c) Fi:60ms时的荧光
d) P或Fm:最大荧光
e) Vj=(Fj-Fo)/(Fm-Fo):j阶荧光相对变量
f) Vi=(Fi-Fo)/(Fm-Fo):i阶荧光相对变量
g) Mo=TRo/RC-ETo/RC=4(F300-Fo)/(Fm-Fo):荧光瞬变初始斜率,或称OJIP曲线初始斜率
h) Area:OJIP曲线与Fm之间的面积,可称为补偿面积(complementary area)为了对不同样品进行比较,Area需要标准化为:Sm=Area/(Fm-Fo),Sm是对关闭所有光反应中心所需能量的量度
i) Fix Area:OJIP固定面积,OJIP曲线40微妙时的F值至1秒时的F值下面的面积
j) Sm:标准化OJIP补偿面积,反映QA还原多次周转
k) Ss=Vj/Mo:标准化OJ相补偿面积,反映单周转QA还原
l) N=Sm/Ss=Sm Mo(1/Vj):OJIP QA还原周转数量(between 0 and tFm)
m) Phi_Po=QY=φpo=TRo/ABS=Fv/Fm,最大光量子产量,吸收光量子通量反应中心初始捕获比率
n) Psi_o=ψo=ETo/TRo=1-Vj,捕获光量子通量中电子传递光量子通量比率
o) Phi_Eo=φEo=ETo/ABS=(1-(Fo/Fm))(1-Vj),吸收光量子通量中电子传递光量子通量比率,或称电子传递光量子产量(quantum yield of electron transport at t=0)
p) Phi_Do=φDo=1-φpo=Fo/Fm,能量散失光量子产量(t=0)
q) Phi_pav=φpav=φpo(Sm/tFm),平均光量子产量,tFm为达到Fm所需时间(ms)
r) ABS/RC=Mo(1/Vj)(1/QY):为单位反应中心的吸收光量子通量,这儿的反应中心仅指the active (QA to QA– reducing) centers(下同)。QY=TRo/ABS=Fv/Fm
s) TRo/RC=Mo(1/Vj):单位反应中心初始(或称最大)捕获光量子通量(导致QA的还原,也即反应中心关闭比率B的增加)
t) ETo/RC=Mo(1/Vj)(1-Vj):单位反应中心初始电子传递光量子通量
u) DIo/RC=(ABS/RC)-(TRo/RC):单位反应中心能量散失
v) ABS/CS:单位样品截面的吸收光量子通量,CS stands for the excited cross-section of the tested sample(下同)。ABS/CSo=Fo,ABS/CSm=Fm,TRo/CSx=QY(ABS/CSx)——单位截面捕获能量或光量子通量
w) TRo/CSo=QY.Fo;ETo/CSo=φEo.Fo =QY.(1-Vj).Fo
x) RC/CSx:反应中心密度,RC / CS0 (active RCs per excited cross-section)
y) PIABS=(RC/ABS)(φpo/φDo)(ψo/Vj):基于吸收光量子通量的“性能”指数或称生存指数
z) PIcs=(RC/CSx)(φpo/φDo)(ψo/Vj):基于截面的“性能”指数或称生存指数
FluorCam便携式、开放式、封闭式等系列叶绿素荧光成像系统在藻类方面研究的文献文献名录,可以根据自己的研究需求进行查询下载。
捷克PSI植物荧光成像FluorCam台式植物多光谱荧光成像系统的工作原理介绍
植物荧光成像FluorCam台式植物多光谱荧光成像系统的使用方法?
捷克PSIFluorCam台式植物多光谱荧光成像系统多少钱一台?
植物荧光成像FluorCam台式植物多光谱荧光成像系统可以检测什么?
植物荧光成像FluorCam台式植物多光谱荧光成像系统使用的注意事项?
捷克PSIFluorCam台式植物多光谱荧光成像系统的说明书有吗?
捷克PSI植物荧光成像FluorCam台式植物多光谱荧光成像系统的操作规程有吗?
捷克PSI植物荧光成像FluorCam台式植物多光谱荧光成像系统报价含票含运吗?
捷克PSIFluorCam台式植物多光谱荧光成像系统有现货吗?
最多添加5台
